甜菊醇、异甜菊醇抑制α-葡萄糖苷酶和HMG-CoA还原酶的分子机制研究
2021-12-16于宁康岳兴旺王晴晴
张 军,王 芳,王 杭,于宁康,岳兴旺,王晴晴
(郑州工程技术学院化工食品学院,河南郑州 450000)
随着现代社会文明进程加快,由食物引起的营养过剩等代谢性疾病如:高血脂、糖尿病、卒中等危害越来越严重。据国际糖尿病联盟(IDF)官网(www.diabetesatlas.org)发布的最新报告,2019年全球约4.63亿人患糖尿病,其中我国1.164亿;预测到2045年,全球糖尿病患者会达到7.002亿人,我国1.472亿人。据新华网发布,2019年我国高血脂患者已达4亿人[1]。糖尿病的治疗主要是使用α-葡萄糖苷酶抑制剂,其中较为常用的是α-葡萄糖苷酶(α-Glucosidase)抑制剂阿卡波糖(Acarbose)等药[2],高血脂的治疗往往选择血脂代谢关键限速HMGCoA[3],有效抑制剂是阿托伐他汀(Atorvastatin)。天然产物小分子影响α-葡萄糖苷酶和HMG-CoA还原酶来改善糖尿病、高血脂越来越受到人们的关注,如Magana-Barajas等[4]研究胡椒碱、辣椒素对α-Glucosidase的抑制,Mahdavi等[5]分析了天然产物抑制HMG-CoA活性的研究进展。
甜菊糖苷(Steviolglycosides)是从甜叶菊(Stevia rebaudianaBertoni)的茎叶中提取出来的具有甜味成分的总称[6],甜菊糖苷中的甜菊糖(Stevioside)经酶解或使用高碘酸钠和强碱处理可以得到甜菊醇(Steviol,或斯特维醇),甜菊醇在酸性条件下发生分子重排得到异甜菊醇(Isosteviol,或异斯特维醇)[7],甜菊醇与异甜菊醇互为同分异构体,分子式:C20H30O3[8]。甜菊醇与异甜菊醇具有多种药理生物活性[9-10],如降血糖、降血脂等。Gregersen等[11]的研究表明甜菊糖苷有降低血糖的功能;Gu等[12]基于体外细胞研究了异甜菊醇对胰岛素抑制和脂细胞的功能影响;Xu等[13]发现异甜菊醇有控制胰岛素和降血脂作用。以上研究基于药理学研究思路,可以从表型上解释糖尿病、高血脂症治疗的因果关系,对于作用关键靶点及相互作用机理仍需要进一步探讨。
随着计算化学的发展,“分子对接”成为研究分子相互作用领域的一项重要技术,其是基于生物信息学的理论模拟方法,从理论上模拟蛋白质分子与配体的相互作用情况[14]。它首先运用于探索药物小分子和受体的作用方式和结合构型,筛选可以与靶点结合的药物,解释药物分子产生活性的原因,优化药物分子结构[15]。近些年,研究食品功能因子对疾病的干预逐渐成为热点,如马庆一等[16]研究杜仲、桑叶提取物对α-葡萄糖苷酶的抑制,叶雅沁等[17]研究南非叶总黄酮的降血脂作用,即对糖尿病、高血脂发生和预防提出了新的尝试,而甜叶菊醇、异甜菊醇与受体的相互作用和分子对接效果未见报道。
本研究依据甜菊醇、异甜菊醇对高血糖、高血脂病理形成的关键限速酶:α-葡萄糖苷酶、HMG-CoA还原酶的酶动力学反应特征,利用AutoDock软件对甜菊醇、异甜菊醇与α-葡萄糖苷酶、HMG-CoA还原酶蛋白进行分子对接,以阿卡波糖[2]、阿托伐他汀[3]作参照,探索甜菊醇和异甜菊醇对α-葡萄糖苷酶、HMG-CoA还原酶的作用机理,为进一步开发新药品或功能食品提供理论参考。
1 材料与方法
1.1 材料与仪器
α-葡萄糖苷酶、对硝基苯-α-D-吡喃葡萄糖苷(PNPG)、阿卡波糖(纯度95%) 上海源叶生物科技有限公司;磷酸二氢钾、氢氧化钠、无水碳酸钠 分析纯,国药集团上海化学试剂有限公司;甲醇、水、二甲基亚砜 色谱纯,天津市福晨化学试剂有限公司;SDS裂解液、二硫苏糖醇、乙二胺四乙酸(EDTA)、乙二胺四乙酸二钠盐(EDTA-Na)、还原型辅酶Ⅱ(NADPH) 北京索莱宝科技有限公司。
UV-2450紫外可见分光光度计 日本岛津公司;BS 210 S电子天平 德国Sartorius公司;上海雷磁PHS-3CpH计 上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 甜菊醇与异甜菊醇对α-葡萄糖苷酶活性的抑制作用α-葡萄糖苷酶活性的检测方法、反应体系参照文献[18-19],设置甜菊醇与异甜菊醇6个浓度梯度 10、20、40、80、120、160mg/L,设置阳性对照试验阿卡波糖 6个浓度梯度 0.05、0.1、0.2、0.3、0.4、0.5 mg/L,计算α-葡萄糖苷酶半数抑制浓度(IC50);取 10、20、40 mg/L三个浓度用双倒数法(Lineweaver-Burk)研究甜菊醇、异甜菊醇对α-葡萄糖苷酶活性的抑制类型。
1.2.2 甜菊醇与异甜菊醇对HMG-CoA还原酶活性的抑制作用 HMG-CoA还原酶活性的检测方法、反应体系参照文献[20-21]方法,设置甜菊醇与异甜菊醇 6个浓度梯度 10、20、40、80、120、160mg/L,设置阳性对照试验阿托伐他汀6个浓度梯度1、2、4、8、12、20 mg/L,计算 HMG-CoA 还原酶 IC50;取10、20、40 mg/L三个浓度用双倒数法研究甜菊醇、异甜菊醇对HMG-CoA还原酶活性的抑制类型。
1.2.3 甜菊醇、异甜菊醇与α-葡萄糖苷酶、HMG-CoA还原酶分子对接 配体准备及预处理:从pubchem数据库下载配体化合物结构(见图1),使用Chem3D软件MM2分子力学优化,使用AutodockTools1.5.6在PMV中给配体小分子加氢、计算电荷等。
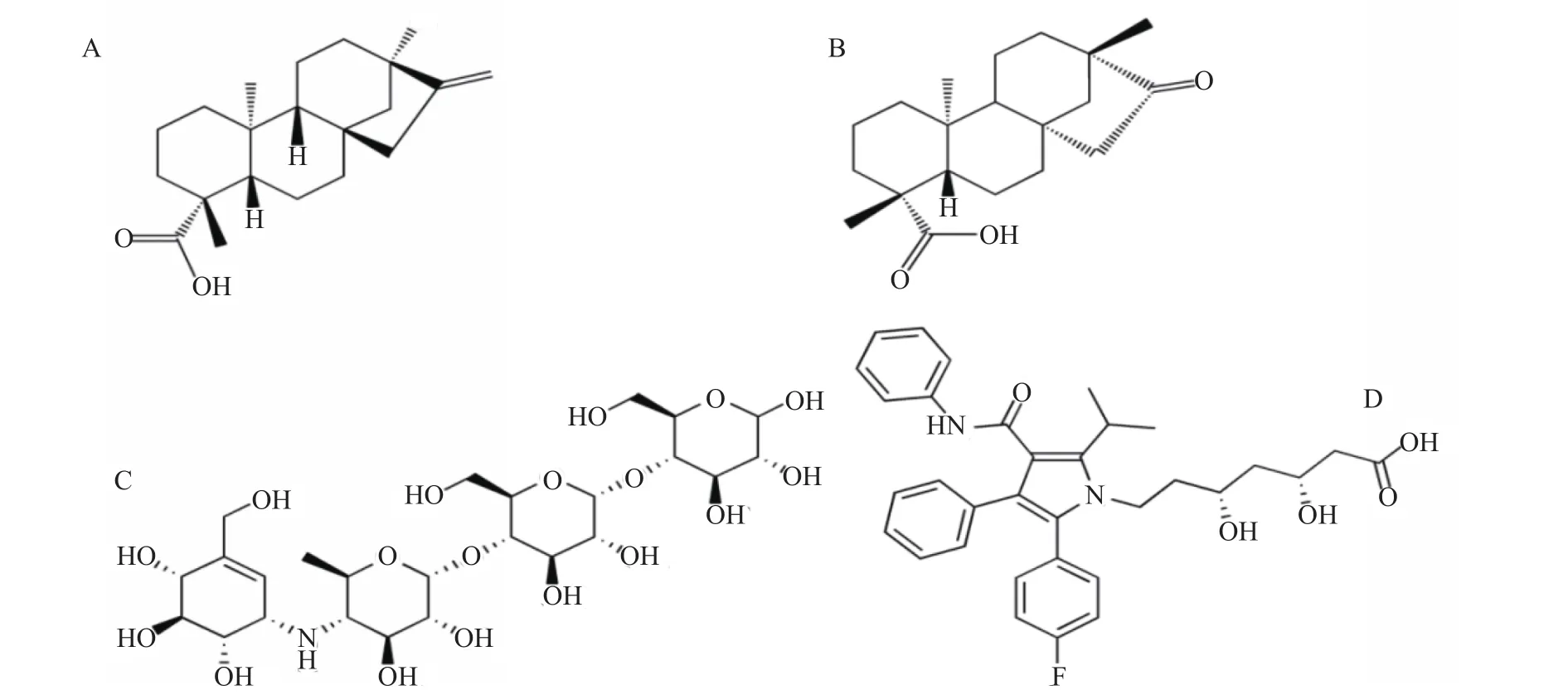
图1 配体化合物结构式Fig.1 Structural formula of ligand compound
受体准备及预处理:从PDB数据库http://www.rcsb.org 下载α-Glucosidase(PDB ID:2F6D)和HMGR(PDB ID:1HWK,2.22Å阿托伐他汀的催化部分的复合物)的蛋白晶体结构(含配体),作为本研究对接所用的蛋白,下载为MOL格式。再使用PyMOL软件对蛋白晶体结构去除其中的溶剂分子、钠离子和磷酸根离子及原配体,保存为PDB格式,备用。
运用AutoDock软件预测甜菊醇、异甜菊醇和对照物阿卡波糖与阿托伐他汀分别于与受体α-Glucosidase、HMG-CoA蛋白的结合,对接参数采用默认设置,用autogrid计算格点能量,采用拉马克遗传算法,用半经验的自由能计算方法评价甜菊醇、异甜菊醇、阿卡波糖与阿托伐他汀与蛋白受体之间的结合情况。使用PyMOL的AutoDock插件进行查看AutoDock分子对接的结果。
1.3 数据处理
AutoDock 4.2及AutoDock Tools 1.5.6软件下载自http://autodock.scripps.edu,美国斯克利普斯研究所官网;蛋白受体晶体结构来源于http://www.rcsb.org数据库;分子可视化分析软件PyMOL为免费授权软件,DeLano Scientific LLC软件公司。
2 结果与分析
2.1 甜菊醇、异甜菊醇对α-葡萄糖苷酶的抑制作用
不同浓度的甜菊醇、异甜菊醇分别与α-葡萄糖苷酶发生反应的结果显示:甜菊醇、异甜菊醇对α-葡萄糖苷酶的抑制呈明显剂量依赖关系,随着浓度增大,抑制率增高。当甜菊醇、异甜菊醇浓度为160 mg/L时对α-葡萄糖苷酶的抑制率分别达到81.4%与89.1%,见图2。当阿卡波糖浓度为0.5 mg/L时对α-葡萄糖苷酶的抑制率为96.3%。酶的半数抑制浓度(IC50)是用来衡量物质效价强度的指标,半数抑制浓度越低,说明其效价越高,抑制效果越好[22],由本试验得出甜菊醇、异甜菊醇、阿卡波糖对α-葡萄糖苷酶的IC50分别为70.75、49.65、0.11 mg/L。因此,甜菊醇、异甜菊醇对α-葡萄糖苷酶活性具有一定的抑制作用,但抑制强度远小于对照物阿卡波糖,抑制强度排序为:甜菊醇<异甜菊醇<阿卡波糖。
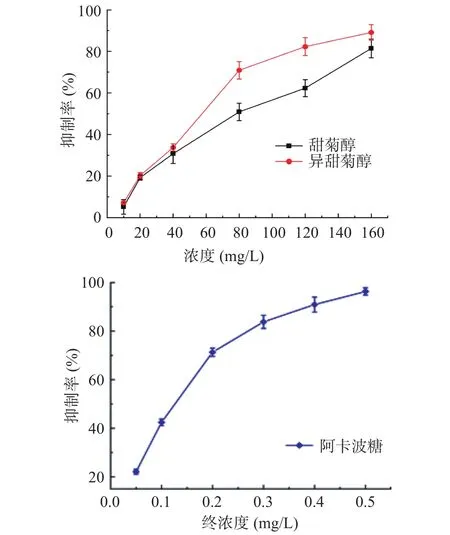
图2 甜菊醇、异甜菊醇及阿卡波糖对α-葡萄糖苷酶的抑制作用Fig.2 Inhibitory effects of steviol, isosteviol and acarbose on α-glucosidase
2.2 甜菊醇、异甜菊醇对HMG-CoA还原酶的抑制作用
如图3所示,随着浓度的增大,甜菊醇、异甜菊醇对HMG-CoA还原酶活性抑制率增高。甜菊醇为160 mg/L时,对HMG-CoA还原酶的抑制率达到88.3%,而异甜菊醇浓度为80 mg/L时,抑制率达到85.9%,说明异甜菊醇对HMG-CoA还原酶的抑制作用强于甜菊醇。甜菊醇、异甜菊醇和阿托伐他汀对HMG-CoA还原酶的IC50分别为46.29、36.66、2.11 mg/L,说明甜菊醇、异甜菊醇对HMG-CoA还原酶活性具有一定的抑制作用,但抑制作用与小于对照物阿托伐他汀,而甜菊醇活性小于异甜菊醇。酶的半数抑制浓度取决于酶的活力和来源、浓度以及反应时间、温度、pH等,本实验HMG-CoA还原酶来自新鲜猪肝,因此,提取过程中尽可能模拟与猪身体环境相似条件,从而减少可能的误差。
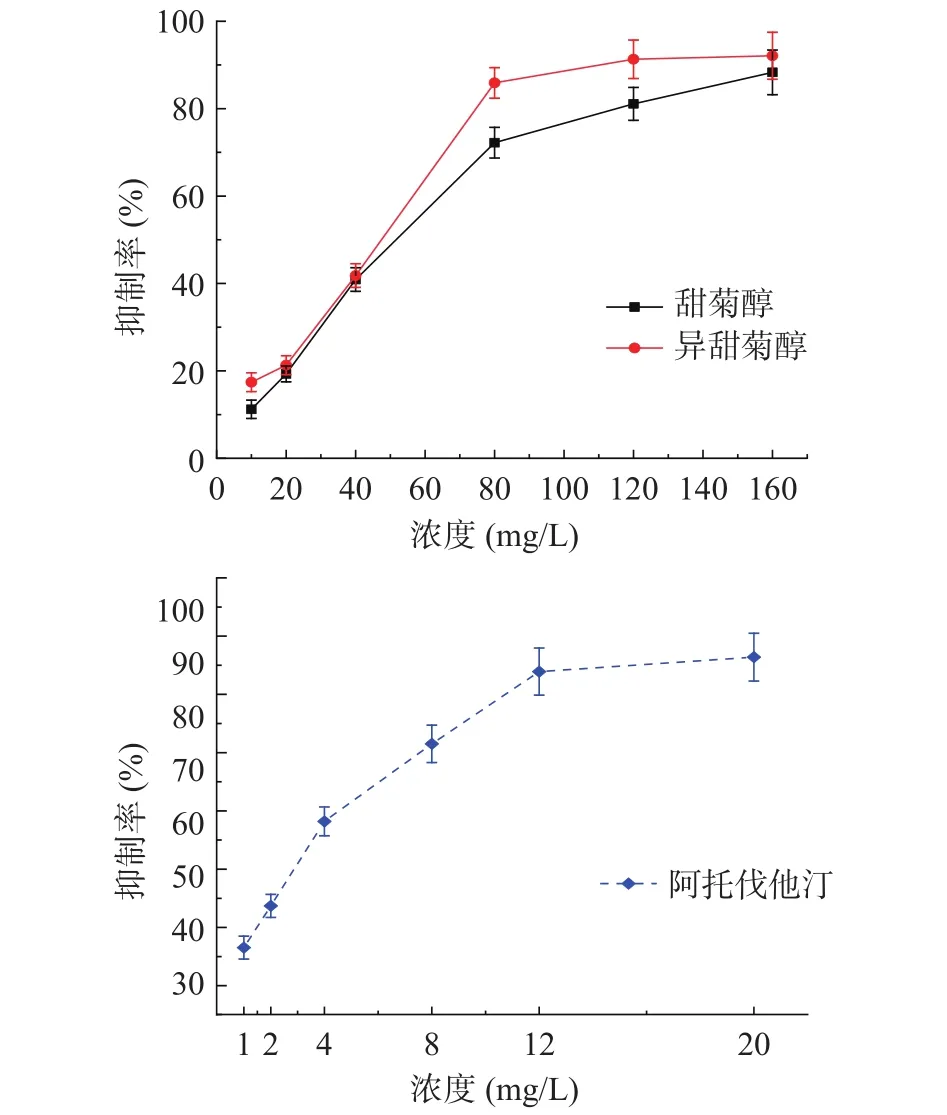
图3 甜菊醇、异甜菊醇及阿托伐他汀对HMG-CoA还原酶的抑制作用Fig.3 Inhibitory effects of steviol, isosteviol and atorvastatin on HMG-CoA
2.3 甜菊醇、异甜菊醇对α-葡萄糖苷酶的抑制类型
由图4所示,随着抑制剂甜菊醇、异甜菊醇浓度的上升,α-葡萄糖苷酶Lineweaver-Burk曲线的米氏常数Km逐渐增加,最大反应速度Vm逐渐减小,不同甜菊醇、异甜菊醇浓度的直线交于坐标第二象限的一点,而并非交于横轴或纵轴[23],表明甜菊醇、异甜菊醇采用竞争性与非竞争性相混合方式抑制α-葡萄糖苷酶活性,也即甜菊醇、异甜菊醇不仅与α-葡萄糖苷酶的活性部位相结合,还可与酶的非活性部位相结合,发挥抑制作用,因而在酶抑制实验中展现了明显的抑制效果,这与韩芬霞等[24]研究异甘草素抑制α-葡萄糖苷酶作用类型相似。
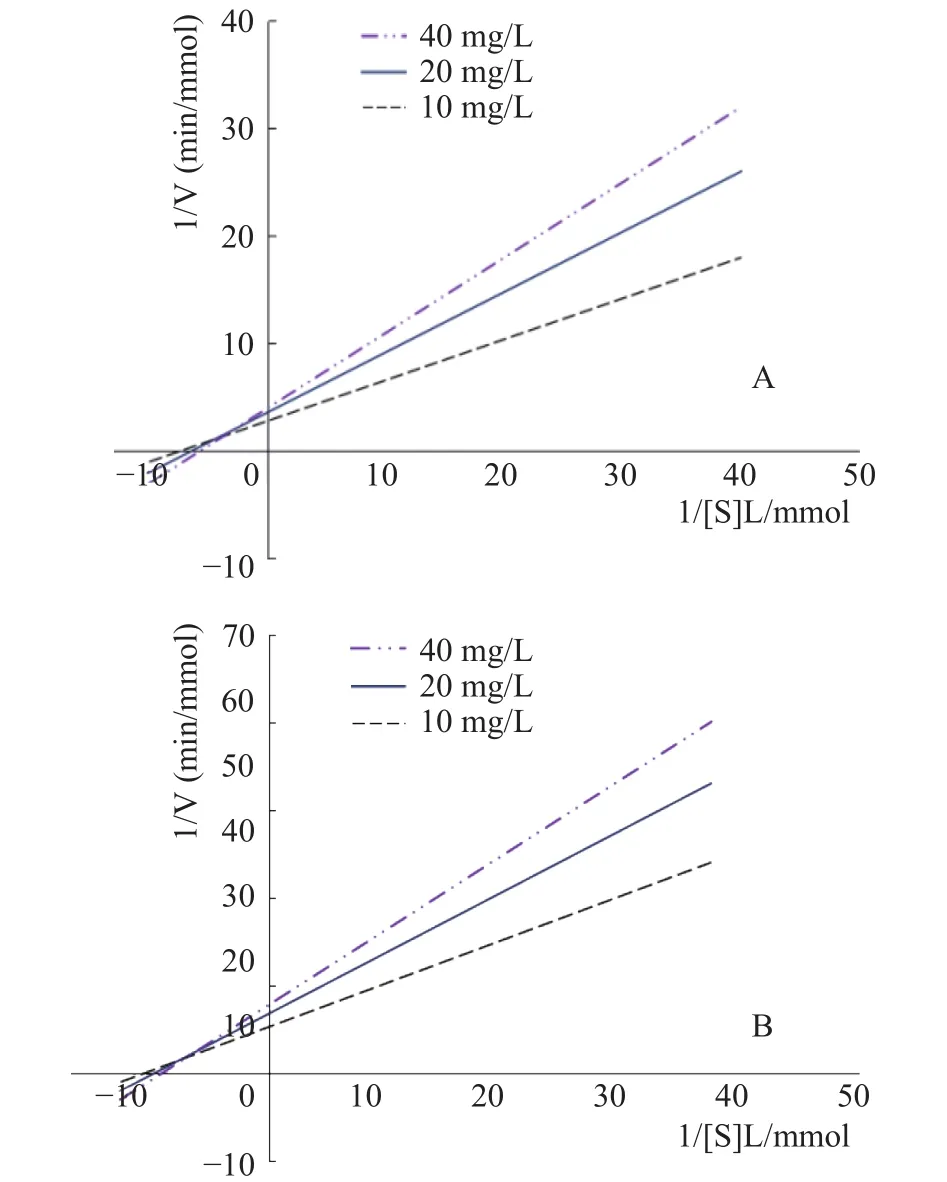
图4 甜菊醇、异甜菊醇对α-葡萄糖苷酶的Lineweaver-Burk图Fig.4 Lineweaver-Burk curve of steviol, isosteviol on α-glucosidase
2.4 甜菊醇、异甜菊醇对HMG-CoA还原酶的抑制类型
由图5所示,不同浓度甜菊醇、异甜菊醇抑制剂的Lineweaver-Burk曲线均为相交于纵轴,随着抑制剂甜菊醇、异甜菊醇溶液浓度增大,Lineweaver-Burk曲线截距不变,斜率逐渐增大,因此,米氏常数Km值随抑制剂浓度的增大而增大,最大反应速率Vmax(纵截距为1/Vmax)保持不变,可推测甜菊醇、异甜菊醇对HMG-CoA还原酶的抑制类型为竞争性抑制[19]。
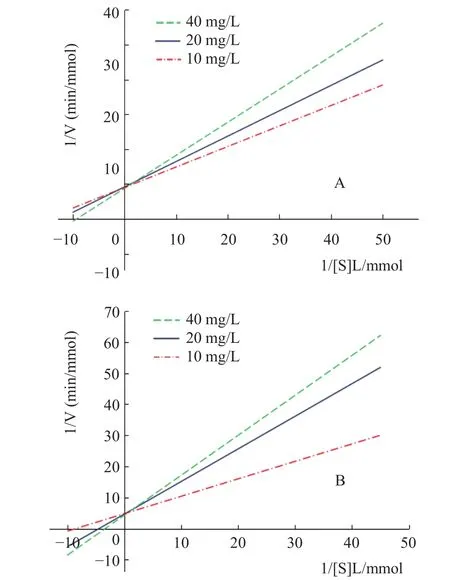
图5 甜菊醇、异甜菊醇对HMG-CoA酶的Lineweaver-Burk图Fig.5 Lineweaver-Burk curve of steviol,isosteviol on HMG-CoA
2.5 对照物阿卡波糖、阿托伐他汀与配体蛋白的对接验证
利用分子对接软件Autodock分别构建对照物阿卡波糖与α-葡萄糖苷酶、阿托伐他汀与HMGCoA还原酶的对接模型,确定和验证该条件的准确性,图6展示了阿卡波糖、阿托伐他汀分别与α-葡萄糖苷酶、HMG-CoA还原酶的对接模式和氢键相互作用。
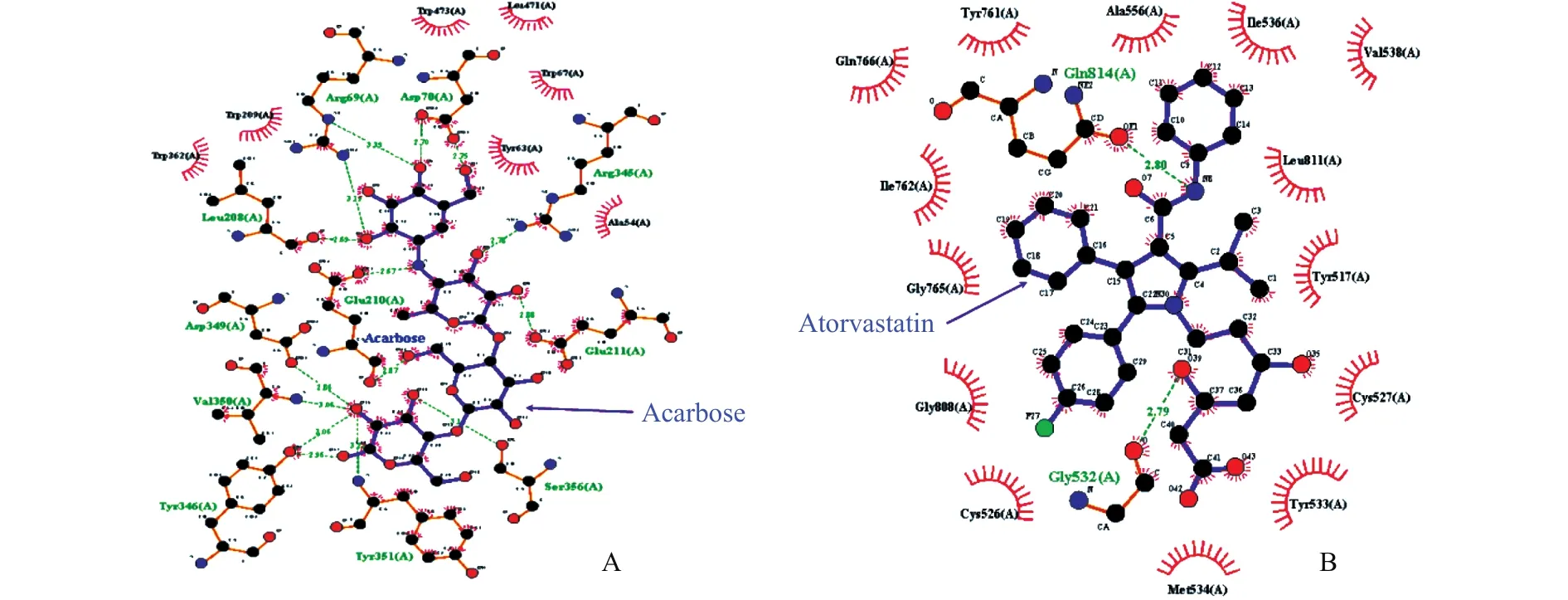
图6 阿卡波糖、阿托伐他汀与配体的对接相互作用Fig.6 Docking interaction of acarbose and atorvastatin with ligands
对照物阿卡波糖与α-葡萄糖苷酶用Autodock作分子对接,对接结合能最小为-11.43 kcal/mol,其均方根偏差值refRMS值为1.57,一般认为refRMS值小于2就可认为小分子与蛋白质受体是有效对接[25]。图6A可见阿卡波糖与α-葡萄糖苷酶能很好的结和,说明参数设置合适。把对接结果用可视化软件Pymol进行分析,结果显示配体作用位点有19 个:TYR63、TYR135、LEU364、LEU471、TRP209、TRP473、TRP67、GLU456、ASP70、TRP362、ALA138、TYR351、 TRP139、 PHE206、 ARG69、 LEU208、GLU211、ARG345、GLU210,与 6个作用位点形成氢键作用,分别为:ARG69、ASP70、GLY140、TRP209、GLU210、ARG345,与 Sevcik 等[26]的研究结果相似。由此可见,阿卡波糖α-葡萄糖苷酶结合的主要作用力是氢键作用。
阿托伐他汀与HMG-CoA还原酶最低结合能量约为-4.29 kcal/mol,refRMS值为1.26,由图6B可见,阿托伐他汀与HMG-CoA还原酶LYS633、PHE615、HIS635等位点结合。与HMG-CoA还原酶残基LYS633、LYS633、LEU634形成键长分别为 2.1Å、2.5Å、2.6Å氢键。阿托伐他汀抑制HMG-CoA还原酶的活性,阻碍了胆固醇的合成,从而达到降血脂的目的,他汀类药物是临床上的常用降血脂药物[27]。
2.6 甜菊醇、异甜菊醇对α-葡萄糖苷酶的分子对接分析
用AutodockTools在PMV中打开1.2.3部分中准备好的α-Glucosidase和HMG-CoA分子,加氢、电荷、质子化状态确认、进行可旋转键的搜寻与定义,并保存为pdbqt文件,如下图7。
图7 α-葡萄糖苷酶和HMG-CoA还原酶结构晶体Fig.7 Crystal structure of α-glucosidase and HMG CoA
经Autodock运算分析,对接使用半柔性对接方法,选择结合自由能最低的构象来进行后续的分析,并得到甜菊醇、异甜菊醇与α-葡萄糖苷酶的最佳复合结果。
图8为对接结果,表明其结合位点的位置。图8中所示:半透明区域表明甜菊醇、异甜菊醇与α-葡萄糖苷酶相互作用的分子表面,绿色区是结合位点区域,表示甜菊醇、异甜菊醇与α-葡萄糖苷酶的结合位点,位点均位于其活性口袋内。甜菊醇与α-葡萄糖苷酶对接结果发现酶活性中心点氨基酸残基中PRO61、ASP62、TYR63、TRP67、LYS127、TRP139、TRP209、GLU210、GLU211、ARG345、TYR351和ASP354等12个氨基酸酸残基最容易与甜菊醇配体相互作用,这些残基有疏水作用。异甜菊醇与α-葡萄糖苷酶对接有 ASP61、PRO62、TYR63、LYS127、TRP139、 TRP209、 GLU210、 GLU211、 ARG345、TYR351等10个氨基酸残基与甜菊醇配体相互作用。这些氨基酸残基与异甜菊醇相互作用形成氢键等作用力,其中氨基酸残基TRP209与异甜菊醇形成了键长为1.9Å的氢键作用力,3.0Å以内相互作用的氨基酸位点有10个。这些位于α-葡萄糖苷酶蛋白的功能域内氨基酸均和甜菊醇、异甜菊醇相互作用形成氢键、范德华力等作用力,对于α-葡萄糖苷酶的抑制活性有着重要的作用。
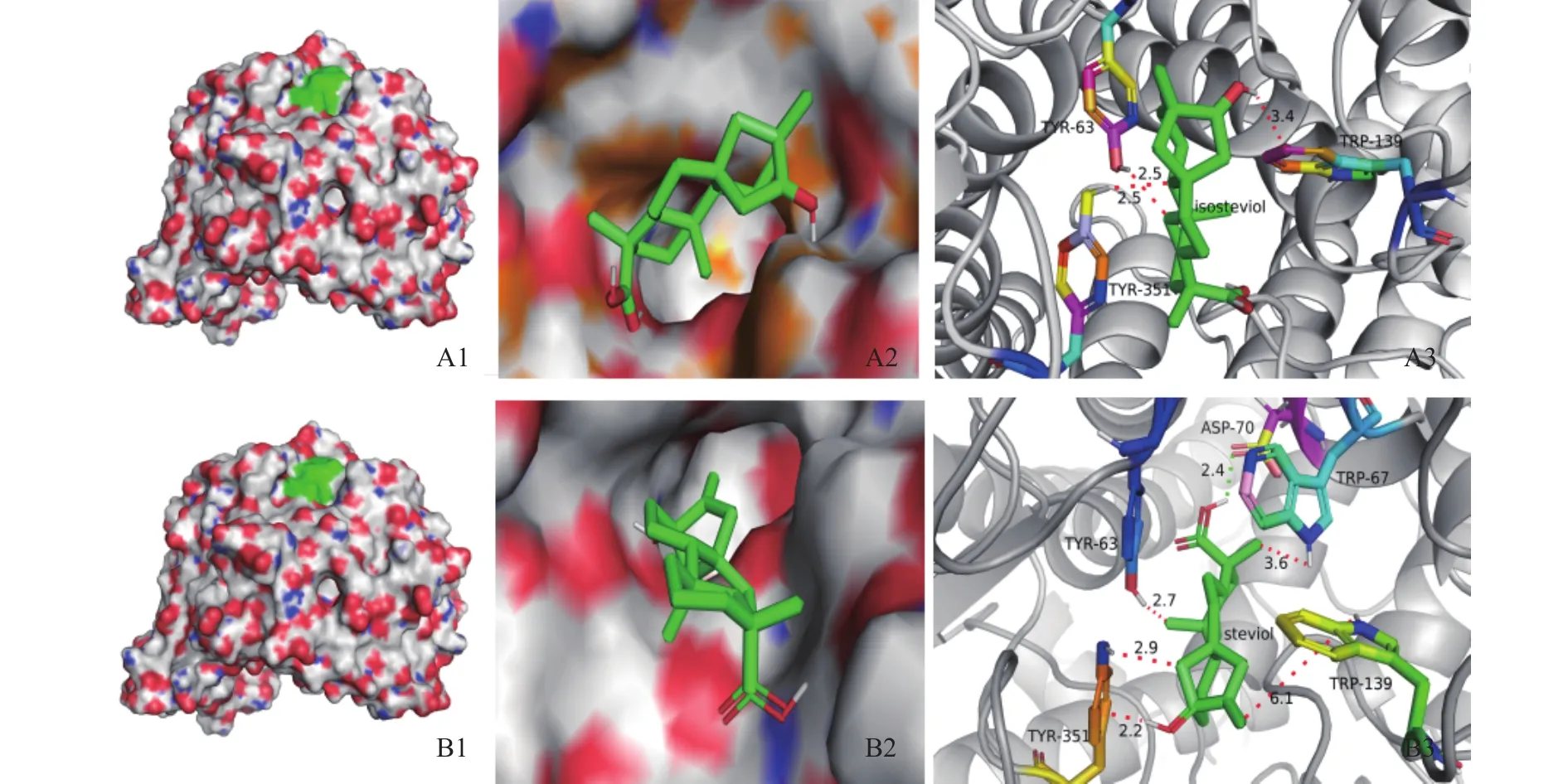
图8 甜菊醇、异甜菊醇与α-葡萄糖苷酶的分子对接效果图Fig.8 Molecular docking effect of steviol, isosteviol and α-glucosidase
将甜菊醇与α-葡萄糖苷酶的所有空腔进行对接并计算结合能,本次对接使用柔性对接,对接自由能越小配体小分子与受体蛋白结合越稳定[28]。甜菊醇、异甜菊醇与α-葡萄糖苷酶对接自由能分别是-6.09、-7.34 kcal/mol,而经典降血糖药阿卡波糖与α-葡萄糖苷酶对接自由能-11.43 kcal/mol,因此表明甜菊醇、异甜菊醇有降血糖功效,其中异甜菊醇的活性稍高于甜菊醇。
2.7 甜菊醇、异甜菊醇对HMG-CoA还原酶的分子对接分析
经Autodock运算,选择结合自由能最低的构象进行后续分析,得到甜菊醇、异甜菊醇与HMGCoA还原酶的最佳复合结果。
由阿托伐他汀与HMG-CoA还原酶受体之间的结合情况用半经验的自由能计算方法评价,针对HMG-CoA还原酶蛋白情况将中心轴改为8.077,-14.968,12.92,分析甜菊醇、异甜菊醇与 HMGCoA还原酶结合的最佳分子对接复合结构,如图9所示,发现甜菊醇与HMG-CoA还原酶的TYR517、TYR533、 MET534、 PRO535、 ILE536、 VAL538、ALA556、ILE762、ALA763、PRO813和 GLN814等11个氨基酸位点产生结合,对比阿托伐他汀与HMG-CoA还原酶结合的晶体结构,可知作用位点处于活性口袋内,功能域内并有MET534、ILE536这2个氢键。异甜菊醇与HMG-CoA还原酶结合11个氨基酸,如 TYR517、VAL522、CYS527、GLY532、TYR533、 MET534、 PRO535、 ILE536、 ALA763、PRO813和 GLN814,有 1个 ILE536位氢键,异甜菊醇和阿托伐他汀与HMG-CoA还原酶作用的位点基本一致(见图9B)。
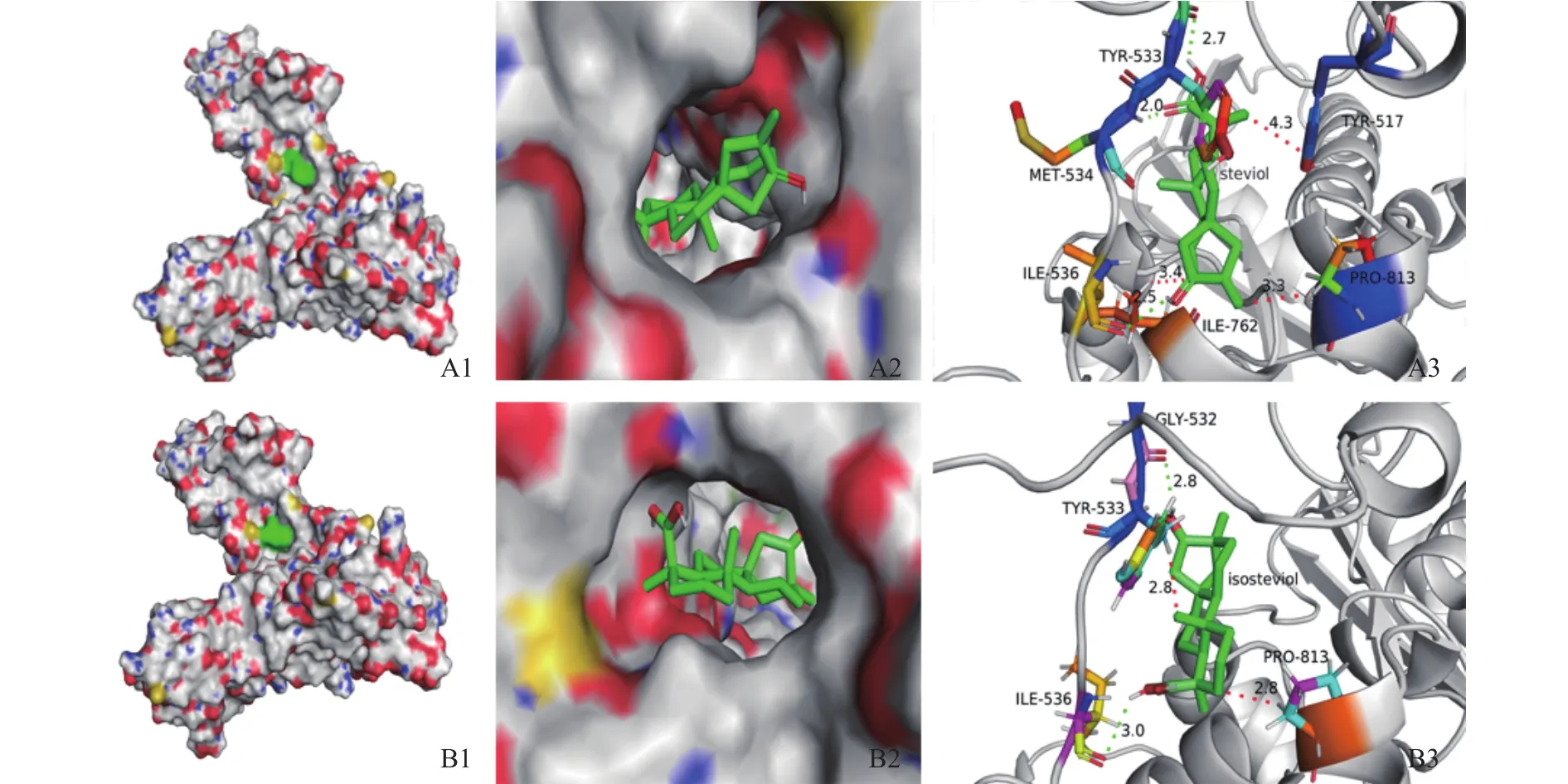
图9 甜菊醇、异甜菊醇与HMG-CoA还原酶的分子对接效果图Fig.9 Molecular docking effect of steviol, isosteviol and HMG CoA reductase
在分子对接中,配体构象的结合自由能越低,构象越稳定,与蛋白质受体结合的亲和力就越强,对蛋白质受体可能具有抑制活性越强[29]。因此,对接自由能数值越小说明抑制效果越好,分析得阿托伐他汀、甜菊醇和异甜菊醇分别与配体HMG-CoA还原酶结合自由能分别为-4.29、-6.24、-6.27 kcal/mol,说明异甜菊醇对配体HMG-CoA还原酶活性的抑制效果比甜菊醇效果好,异甜菊醇通过抑制HMG-CoA还原酶的活性来影响胆固醇的合成,从而达到降血脂的目的。
3 结论
甜菊醇与异甜菊醇的功能性[30]已被食品行业广泛了解和研究,但其在降血糖、降血脂关键靶点和作用机理方面尚未见报道。本研究以甜菊醇与异甜菊醇为试验材料,经过查阅血糖、血脂代谢通路,确定了代谢关键酶:α-葡萄糖苷酶、HMG-CoA还原酶,并在此基础上进一步考察分析甜菊醇、异甜菊醇与靶点蛋白之间的相互关系。
通过酶动力学实验研究结果表明甜菊醇、异甜菊醇对α-葡萄糖苷酶、HMG-CoA还原酶有抑制作用且随着甜菊醇、异甜菊醇浓度的升高,其抑制作用逐渐增强。甜菊醇、异甜菊醇对α-葡萄糖苷酶的 IC50高于阿卡波糖(0.11 mg/L)分别为 70.75、49.65 mg/L,说明甜菊醇活性小于异甜菊醇,小于阿卡波糖;通过Lineweaver-Burk曲线判断甜菊醇、异甜菊醇与α-葡萄糖苷酶采用竞争性与非竞争性相混合类型。甜菊醇、异甜菊醇对HMG-CoA还原酶的IC50分别为46.29、36.66 mg/L,阿托伐他汀的IC50为2.11 mg/L,甜菊醇、异甜菊醇与HMG-CoA还原酶属于竞争性抑制类型。
AutoDock分子对接实验对接自由能和结合氨基酸及其形成氢键数量[31],进一步表明甜菊醇、异甜菊醇分别对α-葡萄糖苷酶、HMG-CoA还原酶有明确的效果。阿卡波糖、甜菊醇和异甜菊醇与α-葡萄糖苷酶对接自由能分别是-6.09、-7.34、-11.43 kcal/mol;阿托伐他汀、甜菊醇和异甜菊醇分别与HMG-CoA还原酶自由能分别为-4.29、-6.24、-6.27 kcal/mol。甜菊醇、异甜菊醇对接与α-葡萄糖苷酶、HMGCoA还原酶均形成疏水活性口袋,有多个氨基酸残基结合,说明对接有效。
综上所述,从酶动力学和分子对接方面确定了甜菊醇、异甜菊醇具有对α-葡萄糖苷酶、HMG-CoA还原酶活性的抑制作用,酶动力学试验与分子对接技术结果相互验证,为探索天然产物的活性机制提供了新方法,为进一步理清作用机制及其在药物开发研究中具有重要意义。
