多汁乳菇多糖对小鼠急性酒精性肝损伤的保护作用
2021-12-16王秋艳丁慧敏朱亚男黄馨阅陶明煊
王秋艳,丁慧敏,朱亚男,黄馨阅,陶明煊
(南京师范大学食品与制药工程学院, 江苏南京 210046)
酒精性肝病(alcoholic liver disease,ALD)是常见的肝脏疾病。近年来随着人们饮酒习惯的改变和饮酒人数的增加,发病率正在逐年上升。长期过量饮酒会导致酒精性肝脏中毒,进而逐步引起肝脏炎症、纤维化或硬化的发生,不加控制还会恶化成癌症,严重危害人体健康[1-3]。ALD早期病症表现为急性的酒精性损伤,主要是短期内大量酒精及其代谢产物本身对肝脏具有一定毒性,且体内酒精代谢过程中还会出现氧化应激和脂质过氧化反应,都会对肝脏组织造成一定的损伤[4-6]。
食用菌多糖作为一种具有极高抗氧化活性的天然产物,毒性小、安全性高,可以通过提高机体内抗氧化酶的活性和抑制代谢过程中的脂质过氧化反应来减弱酒精造成的肝脏组织中毒损伤[7-9]。目前国内外对多汁乳菇多糖(Refined polysaccharide fromLactarius volemusFr)的研究主要集中在分离鉴定、抗肿瘤、免疫调节等方面[10-12],而其在酒精作用下对肝脏的保护状况尚未有报道,因此,本实验通过研究多汁乳菇精多糖(RPLV)对酒精性肝损伤的保护作用,拟为天然药物和保健品开发提供理论和实验依据。
1 材料与方法
1.1 材料与仪器
ICR 雄性小鼠(8周龄) 55只,体重 32±2 g,动物试验在南京师范大学动物饲养中心进行,动物饲养许可证号(SYXK(苏)2015-0028),饲养温度保持在23±2 ℃,湿度保持在 50%±5%,每天照明 12 h,昼夜交替;多汁乳菇精多糖 采用水提醇沉法并通过Sevage法除蛋白后得到的纯度为66.44%;丙二醛(malondialdehyde,MAD)、还原型谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、谷草转氨酶(aspartate amino transferase,AST)、甘油三酯(triglyceride,TG)和谷丙转氨酶(aspartate transaminase,ALT)测定试剂盒 南京建成生物工程研究所;联苯双酯滴丸 浙江医药有限公司新昌制药厂;甲醛、戊二醛 南京化学试剂有限公司;四氧化锇中国上海试剂三厂。
754紫外可见分光光度计 上海光谱仪器有限公司;YD-6L型全自动生物组织包埋机 浙江金华益迪医疗设备厂;HMIAS-2000彩色医学图文分析系武汉千屏影像技术有限公司;CKX41组织培养用显微镜 日本OLYMPUS公司;H-7650日立透射电镜(TEM) 日本日立公司。
1.2 实验方法
1.2.1 酒精诱导急性肝损伤动物模型的建立 55只小鼠适应性喂养3 d后,随机分为空白对照组、模型组、阳性对照组(联苯双酯150 mg/kg·BW)、RPLV低、高剂量组(100、400 mg/kg·BW),每组 11 只。每日同一时间段进行灌胃,连续30 d,实验期间不限制饮食饮水,并每天对小鼠进行称重,以调整受试样品的剂量。实验31 d,所有小鼠禁食12 h,空白组以外的各组均灌予50%的乙醇溶液(12 mL/kg),建立动物模型。12 h后,每组取8只小鼠,取血后处死小鼠,快速解剖并取出肝脏,冲洗称重冷藏备用。
1.2.2 血液指标测定 取眼球血于抗凝管中,12 h内用全血细胞分析仪测定外周白细胞、红细胞和血小板含量。取血并分离血清,参照试剂盒要求测定小鼠血清中的 SOD、CAT、GSH-Px、ALT、AST活力和MDA、GSH以及TG含量。
1.2.3 肝脏组织指标测定 取处死小鼠肝脏,漂洗并吸干水分,称重计算肝脏指数(肝脏指数(mg/g)=肝脏质量/体质量)。10%肝脏匀浆液低温离心10 min(10000 r/min),取澄清液参照试剂盒要求测定小鼠肝脏中的SOD、CAT、GSH-Px、ALT、AST活力和MDA、GSH以及TG含量。取小块肝脏组织,经过24 h以上的4%多聚甲醛溶液固定,洗涤脱水,浸蜡包埋,切片展开等步骤,最后将其染色(苏木精-伊红,Hematoxylin-eosin,HE),置于普通显微镜下观察,即得到清晰的肝脏组织结构。取1 mm3肝脏左叶中部组织,经2 h的2.5%戊二醛和2~3 h的1%锇酸固定,再经洗涤脱水,丙酮包埋剂浸透,固化等步骤制成切片,染色(3%醋酸铀-枸橼酸铅)后用透射电镜观察肝脏超微结构。
1.3 数据处理
采用SPSS 19.0统计系统对实验数据进行处理,通过单因素方差分析对各组数据间是否存在显著性进行分析验证,结果以平均值±SD表示。
2 结果与分析
2.1 RPLV对小鼠体重增长的影响
实验期间,每天对小鼠称重一次并记录,小鼠体重增长情况如表1所示:第30 d,RPLV高、低剂量组小鼠平均体重分别增长13.69%、11.36%,且与空白组、模型组相比差异不明显。实验过程中,5组小鼠的摄食、饮水、毛色光泽度、精神状态、活跃程度等方面表现均相似,健康无死亡情况,可初步判断RPLV对小鼠无毒性作用。

表1 RPLV对小鼠体重增长的影响(g, n=8)Table 1 Effect of RPLV on body weight increase of mice(g, n=8)
2.2 RPLV对小鼠造血能力的影响
过量饮酒会对体内细胞产生毒性,会使血液浓稠,流动性变差,进而导致血栓;同时酒精也会干扰细胞结构,使血液细胞膜溶解,导致细胞破裂,进而产生溶血现象。因此,过量饮酒会对体内血液细胞产生干扰,引起血液中红细胞、白细胞等的变化,导致疾病[13-14]。
由表2可知,模型组小鼠血液中红细胞、白细胞及血小板含量相较于空白组显著降低(P<0.01),说明造模成功。小鼠灌胃受试多糖后,剂量越高,WBC、RBC、PLT越高,两者呈一定的量效关系。RPLV高剂量组所测三个指标与阳性对照组水平接近,且相较于模型组,WBC增长了85.77%;RBC增长了63.58%;血小板增长了28.66%。表明RPLV可有效减轻酒精肝损伤,可明显恢复和改善肝损伤小鼠骨髓造血功能。
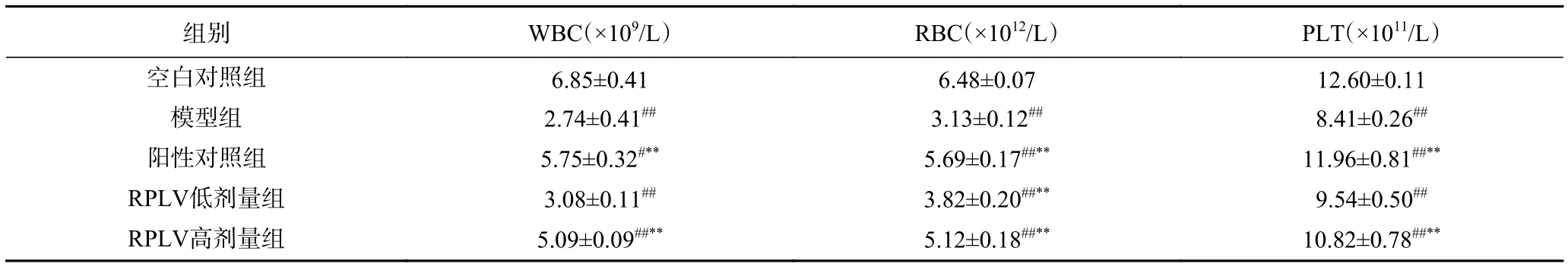
表2 RPLV对小鼠外周血白细胞、红细胞和血小板数量的影响(n=8)Table 2 Effect of RPLV on the number of peripheral white blood cell (WBC), red blood cell (RBC) and blood platelet (PLT) in mice(n=8)
2.3 RPLV对小鼠血液中SOD、MDA、CAT、GSHPx和GSH水平的影响
短时间内摄入过量酒精,导致机体酒精代谢过程中产生了大量性质活泼的超氧阴离子等活性氧成分,会加速体内细胞老化,导致机体产生过氧化的损伤。因此,可以通过测定抗氧化系统里SOD、CAT、GSH-Px、GSH指标的变化分析机体抗氧化能力的大小[15-16]。同时酒精在代谢过程中,也会诱发脂质过氧化反应,进而使体内细胞损伤并产生脂质氧化终产物(MDA)。因此也可通过测定反映机体脂质过氧化水平的MDA含量,间接反映出机体因过氧化造成的损伤情况[17]。
由表3可知,模型组血液中SOD、CAT、GSHPx活力和MDA、GSH含量与空白组有显著性差异(P<0.01),说明造模成功。小鼠灌胃受试样品后,SOD、CAT、GSH-Px活力与GSH含量随着受试样品浓度的增加不断增大,而MDA含量则不断降低,都呈现一定的量效关系。RPLV高剂量组所测结果与阳性组水平接近,且相较于模型组,SOD活力增长了29.26%;MDA含量降低了43.70%;CAT活力增长了48.95%;GSH-Px活力增长了14.53%;GSH含量增长了64.29%。表明RPLV可有效提高抗氧化酶或抗氧化因子的活性,清除酒精代谢过程中产生过多自由基,抑制体内有害反应,增强肝脏代谢脂质的能力,从而减轻肝脏损害程度。

表3 RPLV对小鼠血液中SOD、MDA、CAT、GSH-Px和GSH水平的影响(n=8)Table 3 Effect of RPLV on the SOD, MDA, CAT, GSH-Px and GSH level in blood of mice(n=8)
2.4 RPLV对小鼠血清中TG、ALT和AST水平的影响
由表4可知,实验第31 d,模型组血清中ALT、AST活力和TG含量相较于空白组显著升高(P<0.01)。杨梦等[18]研究表明:酒精建模后,模型组小鼠血清ALT、AST、TG 水平显著高于空白组(P<0.01),这与本实验结果一致,说明造模成功。RPLV各剂量组小鼠血清中AST活力和TG含量相较于模型组显著性降低(P<0.05或P<0.01);且血清中 ALT、AST、TG水平随着样品剂量的增加不断降低,呈一定的量效关系;RPLV高剂量组小鼠血清AST、ALT水平与阳性对照组接近,且血清中TG减少量高于阳性组。由此可见RPLV能有效减轻因酒精作用导致的ALT、AST、TG水平异常升高,对酒精性肝损伤有一定的保护效果。

表4 RPLV对小鼠血清中ALT、AST、TG水平的影响(n=8)Table 4 Effect of RPLV on ALT、AST level in serum of mice(n=8)
2.5 RPLV对小鼠肝脏指数的影响
肝脏遭受酒精损伤时,会呈现细胞肿大情况,同时在脂肪代谢过程中,还易出现代谢紊乱现象,使脂肪堆积在肝细胞中,造成肝脏整体质量和体积的增加,肝脏指数异常升高。因此,肝脏指数可用于反映肝脏受损情况。由表5可知,模型组肝脏指数相较于空白组显著升高(P<0.05),说明模型组小鼠肝脏受到了一定损伤。RPLV高、低剂量组相较于模型组肝脏指数降低,且高剂量组相较于模型组显著(P<0.05)降低。表明RPLV对酒精作用下的肝脏有一定的保护效果。

表5 RPLV对小鼠体重和肝脏指数的影响(n=8)Table 5 Effect of RPLV on body weight and liver index of mice(n=8)
2.6 RPLV对小鼠肝脏中SOD、MDA、CAT、GSHPx和GSH水平的影响
由表6可知,模型组小鼠肝脏中SOD、CAT、GSH-Px活力和MDA、GSH含量与空白组有极显著性差异(P<0.01),说明造模成功。小鼠灌胃RPLV后,SOD、CAT、GSH-Px活力与GSH含量随着样品浓度的增加不断增大,而MDA含量随着浓度的变大不断降低,两者都呈现一定的量效关系。RPLV高剂量组所测结果与阳性对照组水平相近,且相较于模型组,SOD活力增长20.40%;MDA含量降低39.95%;CAT活力增长46.69%;GSH-Px活力增长63.32%;GSH含量增长119.49%。表明RPLV具有一定的抗氧化作用,可有效提高小鼠肝脏的抗氧化酶或抗氧化因子的活性,减小代谢酒精过程中产生的氧化应激和脂质过氧化反应,对急性酒精性肝损伤有一定的保护作用。
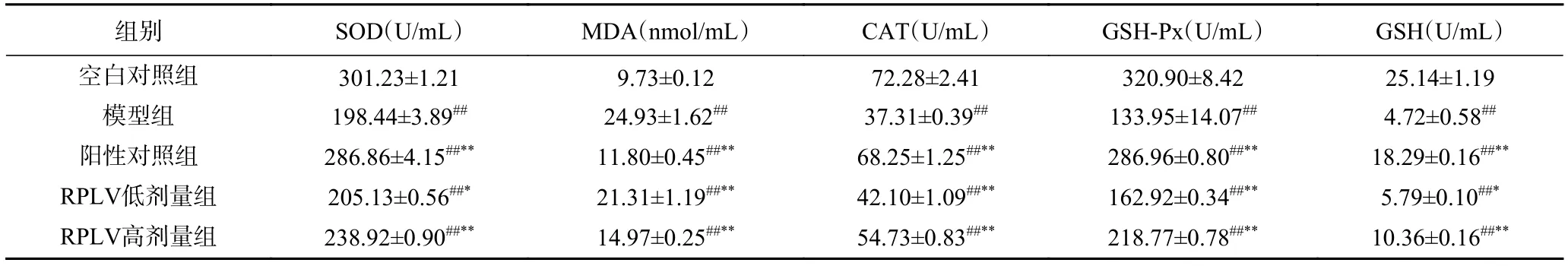
表6 RPLV对小鼠肝脏中SOD、MDA、CAT、GSH-Px和GSH水平的影响(n=8)Table 6 Effect of RPLV on the SOD, MDA, CAT, GSH-Px and GSH level in liver of mice(n=8)
2.7 RPLV对小鼠肝脏中TG、ALT和AST水平的影响
由表7可知,酒精造模后,模型组小鼠肝脏中ALT、AST、TG水平与空白对照组有显著性差异,即其酶活和含量远高于空白组水平(P<0.01)。RPLV高、低剂量组小鼠肝脏ALT、AST、TG水平随着剂量的增加而不断地降低,两者呈一定的量效关系;RPLV高剂量组小鼠肝脏ALT、AST活力与阳性对照组接近,且RPLV高剂量组相比于阳性对照组更能降低小鼠TG含量。表明RPLV能有效降低酒精性肝损伤组织中的ALT、AST、TG水平,对急性酒精性肝损伤有一定的改善作用。
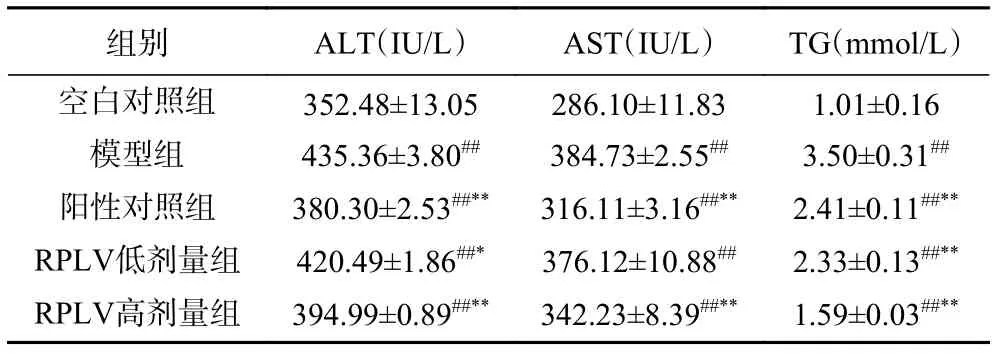
表7 RPLV对小鼠肝脏中ALT、AST、TG活力的影响(n=8)Table 7 Effect of RPLV on ALT, AST, TG activity in liver of mice(n=8)
2.8 RPLV对小鼠肝组织病理变化的影响
如图1所示,空白对照组小鼠肝细胞结构正常,形态规整,细胞核呈圆形,整体细胞染色均匀,间隔清晰,未见变性坏死细胞和炎细胞浸润现象。模型组小鼠肝组织出现严重病变,组织结构紊乱,中央静脉显著扩大且严重变形,肝细胞肿胀甚至发生崩解,出现成片坏死现象,细胞核碎裂、溶解严重,胞浆稀松,细胞间间隙模糊,可见小泡性脂变,且炎症细胞浸润现象严重。阳性对照组和RPLV各剂量组小鼠肝细胞组织损伤得到明显改善,细胞核破裂现象减少、肝细胞肿胀崩解程度减轻,炎性浸润和空泡变性等情况都有所减轻;且RPLV高剂量组肝组织受损情况远小于低剂量组,只出现轻微损伤,整体肝细胞完整,细胞核形状规则,胞浆丰富,中央静脉轻微肿胀,无细胞坏死及脂变现象。表明RPLV可有效改善急性酒精性肝损伤,且剂量越高,效果越佳。

图1 RPLV对小鼠肝组织病理切片的影响(100×)Fig.1 Effects of RPLV on pathological section in liver of mice(100×)
2.9 小鼠肝脏超微结构分析
由图2可知,空白组中肝细胞形态结构清晰完整。而模型组受损肝细胞可明显看出细胞核严重变形,核膜、核仁皱缩,形状不规则,染色质异常分布;且线粒体出现畸形,粗面内质网变形,核糖体脱落消失,细胞内出现大量空泡。相较于模型组,阳性组及RPLV高、低剂量组细胞受损情况改善明显;其中低剂量组还会出现细胞核形状不规则,核糖体脱落,内质网断裂等情况,但相比于模型组,线粒体形状相对规则,脂滴数目有所减少,细胞内空泡数量也有所减少;各高剂量组中,细胞核已近似圆形,核膜较完整细胞质均匀,只出现轻微内质网肿胀及核糖体脱落现象,视野内也未见脂滴。由小鼠肝脏细胞的超微结构再次验证,在急性酒精性损伤下的,RPLV能保护肝脏细胞,且保护效果与剂量呈正相关。

图2 RPLV对急性酒精肝损伤小鼠肝组织超微结构的影响Fig.2 Effects of RPLV on ultrastructure in liver of mice
3 结论与讨论
酒精性肝病作为全球最常见的慢性肝病,目前已经与吸烟、高血压并称为人体三大致死原因[19]。ALD的发病率随着饮酒人数的增加呈逐年上升趋势,临床药物如美他多辛、糖皮质激素等,虽有一定改善效果,但不适合长期服用,治疗效果有限。由于尚不明确ALD的发病机理,且有效的临床治疗方案也不明晰,因此,寻找天然、安全性高的药物治疗酒精性肝病具有广阔的发展前景[20-21]。
短期摄入大量酒精,由于机体无法及时清除代谢产生的过量自由基,就会扰乱机体抗氧化水平的平衡,从而导致主要抗氧化酶SOD、CAT、GSH-Px活性及抗氧化剂GSH含量出现异常;同时酒精代谢过程中发生的脂质过氧化,也会引起终产物MDA的变化[22-24]。过量饮酒还会导致肝脏无法及时分解酒精,主要存在于肝细胞中的转氨酶(ALT和AST)在肝受损后会因细胞膜和线粒体结构破坏,通透性改变,从细胞中逸出,再进入血液,此时血清中ALT、AST活力会显著升高[25-26]。因此,ALT、AST常用于评价肝组织的受损情况。血液和肝脏中TG含量的升高也是由于肝脏无法及时代谢酒精引起的脂肪代谢紊乱造成的[27-29]。
多糖作为毒副作用较小的天然产物,具有良好的抗氧化活性和调节脂质代谢能力,能够保护肝脏免受损害,是重要的抗酒精性损伤保健成分[30-31]。本实验选用多汁乳菇精多糖(RPLV)作为实验材料,建立酒精诱导急性脏器损伤小鼠模型,从体内生化指标、肝脏组织病理切片及细胞超微结构分析多汁乳菇精多糖对小鼠急性酒精性肝损伤的保护作用。结果表明:造模后,模型组小鼠肝脏及血液中的各项生理生化指标与空白对照组差异显著(P<0.01),表明小鼠灌胃酒精后,发生急性酒精性肝损伤,且肝脏组织产生明显的氧化应激,造模成功。与模型组相比,RPLV各剂量组小鼠肝脏和血液中的SOD、CAT、GSHPx活力和 GSH含量显著升高(P<0.01或P<0.05),MDA含量显著降低(P<0.01或P<0.05),说明多汁乳菇精多糖可以在急性酒精性肝损伤下有效维持体内的氧化平衡,抑制酒精代谢过程中的脂质过氧化;同时相对于模型组,各剂量组小鼠肝脏和血清中的AST活力及TG含量显著降低(P<0.01或P<0.05),表明RPLV可改善肝脏细胞的通透性,改善酒精代谢过程中的脂肪堆积,促使酒精快速代谢。观察病理组织切片和超微结构,受试样品RPLV可明显改善肝脏受损情况。因此,多汁乳菇多糖可有效保护酒精性肝损伤,且相较于其他人工合成的药物,具有较高的安全性,未来在保健食品以及医药领域具有广阔的发展前景。
