沙棘叶多糖的提取优化及对CT-26细胞增殖的影响
2021-12-16胡盼盼
胡盼盼
(吕梁学院生命科学系, 山西吕梁 033000)
沙棘(Hippophae rhamnoidesL.)是药食同源的植物之一[1],属于胡颓子科沙棘属乔木或灌木,在我国沙棘资源占世界沙棘资源的90%以上[2],多个地区均有分布,因此我国有“沙棘王国”之称[3]。目前沙棘的应用主要集中在沙棘果实[4],沙棘叶的研究较少,还未得到有效的开发和利用[5]。许多研究表明沙棘叶和沙棘果一样富含丰富的黄酮[6]、多糖[7]等化合物,具有抗突变、抗菌、抗氧化等生物活性,并且沙棘叶产量大、易收集、容易贮藏。因此,研究沙棘叶多糖的提取工艺及其生物活性具有重要的实际意义。
结直肠癌(Colorectal cancer)是主要发生在结肠和直肠中的一种发病率和死亡率都较高的恶性肿瘤[8],具有高复发率及高转移率等的特征[9-10]。数据统计其死亡率位于第二位,发病率位于全球癌症的第三位[11]。目前针对结肠癌的治疗手段主要手术及化疗,但会对患者造成巨大痛苦,因此寻找一种能抑制结直肠癌的发生,提高患者生存质量和减少患者痛苦的天然物质成为迫在眉睫需要解决的问题[12]。植物多糖被证实具有抗肿瘤活性,如Liang等[13]从灵芝提取得到多糖GLPs,研究表明GLPs可以显著的增加LoVo结肠癌细胞形态变化,细胞caspas-3,-8,-9的表达,促进细胞凋亡。Mao等[14]研究发现枸杞多糖(LBP)对SW480细胞和Caco-2均具有显著的抑制作用,并通过G0/G1细胞周期的阻滞发挥促凋亡作用。陈贵娥等[15]研究发现苹果多糖可以有效地抑制SW-620结肠癌细胞的侵袭与迁移,浓度依赖性地上调E-cadherin、下调N-cadherin的蛋白表达来发挥抑制作用。本论文采用正交设计试验优化吕梁沙棘叶多糖提取工艺,并分析其对结肠癌CT-26细胞的抑制作用,旨在为将来对沙棘叶多糖的结构解析以及生物活性的进一步研究提供理论依据,为综合开发利用吕梁市沙棘资源提供科学参考。
1 材料与方法
1.1 材料与仪器
沙棘叶 于每年九月份采摘自吕梁汾阳市城子药材种植有限公司;结肠癌CT-26细胞 通派上海生物科技有限公司;苯酚、浓硫酸、无水乙醇 均为分析纯,河南东科化工产品销售有限公司;RPMI1640培养基 Hyclone公司;PBS、DMSO、胰酶、戊二醛、胎牛血清、双抗、PI染液 上海碧云天生物有限公司。
VS-502FD型冻干机 河南海克尔仪器仪表有限公司;BPN-50CHUV型细胞培养箱 济南来宝医疗器械有限公司;InfiniteM200型酶标仪 瑞士TECAN公司;S-1-150S型高速离心机 德国Sigma公司;CT115C型灭菌锅 姜堰市新康医疗器有限公司;KQ2200B型超声波仪 上海仪天科学仪器有限公司。
1.2 实验方法
1.2.1 沙棘叶多糖提取工艺 采用超声波波辅助提取沙棘叶多糖。采摘形状完整、颜色均匀的新鲜沙棘叶到实验室,充分清洗干净后,放入50 ℃的恒温干燥箱干燥后粉碎,过30目筛。取沙棘叶粉100 g,加入500 mL水,超声波波萃取后进行浓缩,采用Sevag法去除蛋白,加入95%无水乙醇进行醇沉,离心得到沉淀,加入蒸馏水,采用苯酚-硫酸法[7](y=0.0531x-0.0029,R²=0.9987)测定沙棘叶多糖的得率,冷冻干燥得到沙棘叶粗多糖,最后取一定量的粗多糖配制成多糖溶液来测定其纯度。
1.2.2 单因素实验 超声波功率为300 W、超声波时间为20 min,超声波次数为1次时,选取60、70、80、90 ℃研究超声波温度对多糖得率的影响;超声波温度为80 ℃、超声波时间为20 min,超声波次数为1次时,选取200、300、400、500 W研究超声波功率对多糖得率的影响;超声波温度为80 ℃、超声波功率为400 W、超声波次数为1次时,选取10、20、30、40 min研究超声波时间对多糖得率的影响;超声波温度为80 ℃、超声波功率为400 W、超声波时间为30 min时,选取1、2、3、4次研究超声波次数对多糖得率的影响。
1.2.3 正交设计优化试验 根据单因素实验结果,4个因素:超声波温度(A)、超声波功率(B)、超声波时间(C)、超声波次数(D)各选择3个水平进行正交试验,以多糖得率为试验结果,设计了L9(34)的正交试验。因素水平见表1。

表1 正交试验因素水平设计Table 1 Design of orthogonal experimental factors
1.2.4 MTT试验 待CT-26细胞生长状态良好后消化收集并调整细胞浓度为105个/mL,每孔100 μL加入96孔板。将终浓度为0、250、500、1000、2000、2500 μg/mL的沙棘叶粗多糖加入96孔板中,各设置5个重复孔。5%CO2、37 ℃培养72 h后倒走旧液,加入PBS清洗两遍,然后每孔中加入100 μL的0.5 mg/mL MTT,继续37 ℃培养4 h,倒走MTT后每孔中加入150 μL二甲基亚砜(DMSO),振荡10 min后用酶标仪在490 nm下测定吸光值,计算细胞活力[16]。

1.2.5 透射电镜观察细胞形态 CT-26细胞经过沙棘叶多糖处理72 h后,胰酶消化后收集细胞至1.5 mL离心管,使用预冷PBS清洗两次,加入戊二醛,4 ℃温度下静置过夜,之后PBS清洗两次,之后交至哈尔滨医科大学电镜中心进行后续透射电镜实验。
1.2.6 细胞周期测定 将细胞以1×106个/mL接种于六孔培养板中培养,每孔2 mL。待细胞长满后加入终浓度为 2000 μg/mL的沙棘叶粗多糖,培养72 h后,胰酶消化细胞,和上清液中合并后离心(1000 r/min,5 min);用 4 ℃ 预冷 PBS 清洗三次后加入-20 ℃预冷的70%的乙醇1 mL,放于4 ℃过夜固定;离心后倒掉固定液,PBS清洗两次,离心后加入0.5 mL 的PI染液(含100 μg/mL RnaseA,100 μg/mL,0.2%Triton X-100),在避光环境下反应30 min之后通过流式细胞仪检测细胞周期分布。
1.2.7 反转录酶-聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR) 经过2000 μg/mL的沙棘叶粗多糖处理CT-26细胞72 h后,收集细胞,采用Trizol法提取细胞的总RNA,根据试剂盒说明书反转录成cDNA。再以cDNA为模板,进行扩增反应,以β-actin为内参,采用RT-PCR检测Bcl-2、Bax、caspase-3 mRNA的表达水平。
1.2.8 Western blot 经过 2000 μg/mL的沙棘叶多糖处理CT-26细胞72 h后,收集细胞,RIPA裂解细胞提取总蛋白,BCA试剂盒检测蛋白浓度。将样品进行SDS-PAGE电泳后进行转膜,脱脂奶粉封闭后孵育一抗,洗膜三次后孵育二抗,最后加入发光液进行曝光,并对条带进行灰度扫描。
1.3 数据处理
所有试验都重复三次,结果以平均值±标准差表示,使用GraphPad Prism 5软件进行one-way ANOVA分析并作图,P<0.05表示数据之间差异显著。不同字母表示差异显著,相同字母表示差异不显著。
2 结果与分析
2.1 超声波温度对沙棘叶多糖得率的影响
超声波温度对沙棘叶多糖得率的影响见图1,温度对沙棘叶多糖的得率具有一定影响。由图1可知,超声波温度在60 ℃时,多糖的得率较低,随着超声波温度的增加,多糖得率也不断增大,在80 ℃时,沙棘叶多糖得率最大(P<0.05),这可能是由于随着温度不断升高,沙棘叶溶解度升高,提取较为充分。因此正交设计试验超声波温度为70~90 ℃。

图1 超声波温度对多糖得率的影响Fig.1 Effect of ultrasonic temperature on polysaccharide yield
2.2 超声波功率对沙棘多糖得率的影响
超声波功率对沙棘叶多糖得率的影响见图2。由结果可知,沙棘叶多糖的得率随着超声波功率的增加,呈现先增加后减少的趋势。超声波功率为200 W时,多糖得率仅有4%;在400 W时,沙棘叶多糖的得率达到最大,显著高于其他功率组(P<0.05),之后得率反而减少,这可能是由于在一定功率范围内有利于细胞的破壁,而功率过大过小均可能由于破壁不充分或破坏多糖结构而导致多糖得率的减少[17]。因此设定超声波功率为300~500 W。

图2 超声波功率对多糖得率的影响Fig.2 Effect of ultrasonic power on polysaccharide yield
2.3 超声波时间对沙棘多糖得率的影响
超声波时间对沙棘叶多糖得率的影响见图3。由结果可知,超声波时间能够明显影响沙棘叶多糖的得率。处理时间20 min时,沙棘多糖得率最低,随着超声波时间的延长,沙棘叶多糖得率不断增加,超声波30 min的时候,多糖得率达到最大(P<0.05),并且继续延长超声波的时间,对多糖得率影响较小。这可能是由于超声波处理时间越长,对细胞壁的破碎程度越大,沙棘叶多糖得率也就越高,但是达到一定处理时间后,溶液渗透压达到平衡状态,多糖得率趋于平稳不再增加[18-19]。因此设定超声波时间为20~40 min。

图3 超声波时间对-多糖得率的影响Fig.3 Effect of ultrasonic time on polysaccharide yield
2.4 超声波次数对多糖得率的影响
超声波次数对沙棘叶多糖得率的影响见图4。结果可知,超声波处理一次后,沙棘叶多糖得率为6.31%,超声波处理两次后,多糖得率最大,显著高于提取 1、3、4 次组(P<0.05),但继续增加超声波次数,多糖得率没有明显的增加。因此设定超声波次数为1~3次。

图4 超声波次数对多糖得率的影响Fig.4 Effect of ultrasonic frequency on polysaccharide yield
2.5 正交设计试验
根据单因素实验结果进行了沙棘叶多糖提取工艺的正交优化。由表2可知,影响沙棘叶多糖得率的因素大小排序是:B(超声波功率)>C(超声波时间)>A(超声波温度)>D(超声波次数),最佳提取工艺是A1B2C2D2,即超声波温度是70 ℃、超声波功率是400 W,超声波时间为30 min,超声波次数为2次,在此条件下提取得到的沙棘叶多糖得率最多7.95%,之后根据最优提取条件进行三次重复试验,沙棘叶多糖得率为7.93%±0.07%,与优化试验数据接近,提取参数可靠。最终所得多糖纯度为79.34%±0.17%。

表2 正交试验设计及结果Table 2 Orthogonal experimental design and results
2.6 沙棘叶多糖对CT-26细胞的抑制作用
如图5所示,通过MTT法检测沙棘叶多糖对CT-26细胞的抑制作用。由图5可知,当多糖浓度为 250 μg/mL 的时候,抑制效果不显著(P>0.05),但随着沙棘叶多糖浓度的增加,抑制作用越来越明显,呈现浓度依赖性。当多糖浓度增加到2000 μg/mL时,抑制作用达到最大(P<0.05),继续增加到2500 μg/mL时抑制效果差异不显著(P>0.05),因此采用2000 μg/mL浓度做后续的研究。

图5 沙棘叶多糖对CT-26细胞的抑制作用Fig.5 Inhibitory effect of sea buckthorn polysaccharide on CT-26 cells
2.7 细胞形态变化
细胞凋亡指的是细胞程序性死亡,在此过程中细胞形态会发生明显的变化[20-21]。如图6所示,对照组细胞形态正常,各个结构正常,细胞表面绒毛正常,经过2000 μg/mL沙棘叶多糖处理后,细胞形态发生明显改变,细胞核固缩,细胞内细胞器排序紊乱,大量液泡产生,内质网肿胀且细胞表面出现明显的凋亡小体,由此说明沙棘叶多糖能够抑制CT-26细胞的生长,诱导其发生凋亡。

图6 透射电镜观察细胞变化Fig.6 Changes of cells observed by transmission electron microscope
2.8 沙棘叶多糖对细胞周期及凋亡率的影响
细胞周期分为分裂期(M期)、DNA合成前期(G0期)、DNA合成后期(G1期)和DNA合成期(S期)[22]。本试验检测2000 μg/mL的沙棘叶多糖处理CT-26细胞72 h后对细胞周期的影响,结果如图7所示。与对照组相比,多糖组细胞G1期减小,但差异不显著(P>0.05),G2期也明显的减小,差异也不显著(P>0.05),S 期细胞数量显著性增多(P<0.05),细胞凋亡数量显著增加(P<0.05),由此说明,沙棘叶多糖可以通过通过阻滞CT-26细胞的S期来抑制细胞的生长。

图7 沙棘叶多糖对CT-26细胞周期和凋亡率的影响Fig.7 Effect of polysaccharide from seabuckthorn leaves on cell cycle and apoptosis ratio of CT-26
2.9 沙棘叶多糖对凋亡相关基因的影响
将2000 μg/mL沙棘叶多糖加入CT-26细胞并处理72 h后,通过RT-PCR方法检测细胞中caspase-3、Bax、Bcl-2基因的表达变化。结果如图8所示,经过多糖处理后,caspase-3基因和Bax基因表达量显著增大(P<0.05),Bcl-2基因表达量显著减小(P<0.05)。
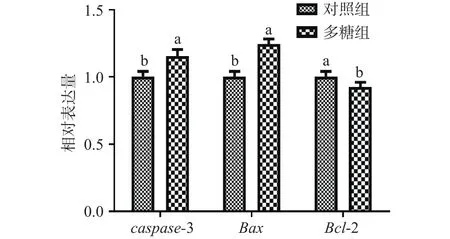
图8 CT-26细胞凋亡相关基因表达变化Fig.8 Effect of polysaccharide on apoptosis gene in CT-26 cell
2.10 沙棘叶对凋亡蛋白的影响
将2000 μg/mL的沙棘叶多糖加入CT-26细胞并处理72 h后,通过Western blot方法检测细胞中caspase-3、Bax、Bcl-2蛋白的表达变化。结果如图9所示,经过多糖处理后,Cleaved-caspase-3蛋白表达量显著增大(P<0.05),Bax蛋白表达量显著增大(P<0.05),Bcl-2蛋白表达量与基因表达结果不同,没有显著性差异(P>0.05)。Caspase是一类天冬氨酸特异性的半胱氨酸蛋白酶,在人类细胞中Caspase-3的超量表达和激活均会引起细胞凋亡,因此,又称死亡蛋白酶[23-24],Bcl-2家族蛋白也是细胞凋亡过程中重要的凋亡蛋白之一,其蛋白家族中的Bcl-2蛋白可以抑制细胞的凋亡,Bax蛋白具有促进凋亡的作用[25]。由此基因和蛋白结果证明,沙棘叶多糖确实能够显著促进CT-26细胞的凋亡。

图9 CT-26细胞凋亡蛋白表达变化Fig.9 Effect of polysaccharide on apoptosis protein in CT-26 cell
3 结 论
通过单因素实验和正交试验对超声波辅助提取沙棘叶多糖的工艺进行了优化,得到最终的优化条件是:超声波温度为70 ℃、超声波功率为400 W,超声波时间为30 min,超声波次数为2次。主次因素排序是:超声波功率>超声波时间>超声波温度>超声波次数,通过最优条件提取的沙棘叶多糖得率达到最大为7.93%±0.07%。
沙棘粗多糖对结肠癌CT-26细胞具有明显的抑制作用,通过MTT试验结果可知,将不同浓度的沙棘叶多糖加入CT-26细胞处理72 h后能够明显促进细胞的凋亡,抑制细胞增殖,当多糖浓度为2000 μg/mL时效果最佳,透射电镜观察细胞出现凋亡形态,通过流式细胞仪检测可知,2000 μg/mL沙棘叶多糖可通过阻滞CT-26细胞的S期来显著诱导细胞凋亡,由RT-PCR结果可知,沙棘叶多糖处理CT-26细胞后,能够显著增加细胞内caspase-3表达以及Bax/Bcl-2比值(P<0.05),由此阐明沙棘叶多糖对结肠癌CT-26细胞具有抑制作用。后续将对沙棘叶粗多糖进行分离纯化,并进一步解析多糖的结构的组成,制备沙棘纯多糖来深入研究其抗结肠癌的细胞信号通路,以期为沙棘叶在抗肿瘤领域的综合开发利用提供科学依据。
