miR-486对绵羊骨骼肌卫星细胞增殖及PI3k-Akt信号通路相关基因表达的影响
2021-12-15王世银张伟刘晓娜杨力伟邓双义
王世银 张伟 刘晓娜 杨力伟 邓双义
摘要:【目的】明確miR-486对绵羊骨骼肌卫星细胞增殖及PI3K-Akt信号通路相关基因表达的影响,为揭示miR-486对绵羊骨骼肌发育的调控机制打下基础。【方法】以巴什拜羊1日龄羔羊后肢骨骼肌卫星细胞为研究对象,通过转染miR-486 mimics和miR-486 inhibitor致使绵羊骨骼肌卫星细胞中miR-486水平上调或下调,探究miR-486对骨骼肌卫星细胞增殖速度及PI3K-Akt信号通路中PTEN、GSK3b、PRKCα、Raf-1、MAPK1、PKN1、Casp9和SGK1等8个相关基因表达变化的影响。【结果】空白对照及转染miR-486 mimics、miR-486 mimics negative control和miR-486 inhibitor negative control的绵羊骨骼肌卫星细胞均表现出典型的S形增殖曲线,但各处理间的细胞增殖速度存在明显差异。当绵羊骨骼肌卫星细胞中miR-486水平上调可促使细胞进入快速增殖状态,而miR-486水平下调可使细胞保持静止状态。实时荧光定量PCR检测结果表明,当绵羊骨骼肌卫星细胞中miR-486水平上调时,可引起PTEN、Raf-1和MAPK1基因相对表达量极显著下调(P<0.01,下同),PRKCα和PKN1基因相对表达量极显著上调,SGK1基因相对表达量显著上调(P<0.05);而GSK3β和Casp9基因相对表达量在不同处理组绵羊骨骼肌卫星细胞间的差异均不显著(P>0.05),可能在维持绵羊骨骼肌卫星细胞基本生命活动中发挥作用。【结论】miR-486通过调控PI3K-Akt信号通路相关基因的表达而参与绵羊骨骼肌卫星细胞生长发育及增殖,为深入研究miR-486对绵羊骨骼肌发育的调控机理及优质肉羊品种培育打下了理论基础。
关键词: 绵羊;miR-486;骨骼肌卫星细胞;PI3K-Akt信号通路;增殖;基因表达
中图分类号:S826.8 文献标志码: A 文章编号:2095-1191(2021)08-2276-08\
Effects of miR-486 on proliferation of sheep (Ovis aries) skeletal muscle satellite cells and expression of genes related
to PI3K-Akt signal pathway
WANG Shi-yin, ZHANG Wei*, LIU Xiao-na, YANG Li-wei, DENG Shuang-yi
(Xinjiang Agricultural Professional Technological College, Changji, Xinjiang 831100, China)
Abstract:【Objective】To investigate the effects of miR-486 on proliferation of sheep (Ovis aries) skeletal muscle sa-tellite cell and expression level of genes related to PI3K-Akt signal pathway, and finally lay the foundation for illumina-ting the regulatory mechanism of miR-486 on development of sheep skeletal muscle. 【Method】Here the skeletal muscle satellite cells of one day-old Bashby sheep were applied, and the proliferation of satellite cells and the expression levels of 8 key genes, PTEN, GSK3b, PRKCα, Raf-1, MAPK1, PKN1, Casp9 and SGK1 in PI3K-Akt signal pathway were detected when the level of miR-486 in cells were up- or down-regulated by transferring into miR-486 mimics and miR-486 inhibitor. 【Result】The result showed that the skeletal muscle satellite cells in blank control and treated by miR-486 mi-mics, miR-486 mimics negative control, and miR-486 inhibitor negative control all performed the typical S-shaped proli-feration curve, but thespeed of proliferation existed great differenceamong treatments. The proliferation of satellite cells was accelerated when the level of miR-486 was up-regulated, conversely when the level of miR-486 was down-regulated and the cells kept rest state. The results of real-time fluorescence quantitative PCR showed that the expression levels of PTEN, Raf-1, and MAPK1 were extremely significantly down-regulated (P<0.01, the same below), levels of PRKCα and PKN1 were extremely significantly up-regulated, and level of SGK1gene was also significantly up-regulated(P<0.05), when the level of miR-486 was up-regulated in satellite cells, but the relative expression levels of GSK3β and Casp9 gene did not show significantly different(P>0.05) no matter the level of miR-486 was up-regulated or down-regulated in satellite cells, maybe these two genes played important roles in essential activity of satellite cells. 【Conclusion】miR-486 can affect the proliferation of sheep skeletal muscle satellite cell by regulating the expression of genes in PI3K-Akt signal pathway, and provided a theoretical basis for further investigate the regulation mechanism of miR-486 on skeletal muscle development of sheep and breeding of high-quality mutton sheep breeds.
Key words: sheep; miR-486; skeletal muscle satellite cell; PI3K-Akt signal pathway; proliferation; gene expression
Foundation item: Xinjiang Natural Science Foundation (2017D01A51)
0 引言
【研究意義】提高产肉性能一直是绵羊育种的重要目标。在动物骨骼肌生长发育过程中,从胚胎期成肌细胞的迁移、增殖和分化,到出生后骨骼肌细胞的进一步生长发育及稳态维持,均受一个分子网络的精细调控(Puri and Sartorelli,2000),但目前对于这一网络调控的作用机制知之甚少。因此,深入研究并阐明绵羊骨骼肌发育的分子调控机制,寻找与绵羊骨骼肌发育密切相关的基因及信号通路,并应用于分子育种方案,能有效提高绵羊育种效率及促进优良肉羊品种培育。【前人研究进展】miRNA是一类由22个左右核苷酸构成的小分子非编码RNA,参与细胞增殖、凋亡、分化,以及机体发育、代谢和肿瘤转移等多种生物学过程的调控(Cheng et al.,2005;Croce and Calin,2005;Hwang and Mendel,2006;Tavazoie et al.,2008)。miRNA-148(miR-486)来源于Ankyrin-1基因(Ank-1)的第40个内含子,最早发现于人类胚胎肝组织中(Small et al.,2010)。PI3K-Akt信号通路参与肌肉生长发育、代谢调控及稳态维持等重要生物学过程的调控,在抗肌萎缩蛋白缺陷型肌肉和杜氏肌肉营养不良症等疾病中均能检测到PI3K-Akt信号通路相关基因的异常表达或蛋白的异常磷酸化(Small et al.,2010;Alexander et al.,2011)。已有研究表明,miR-486通过调控PI3K-Akt信号通路相关基因的表达,而在肌肉发育及杜氏肌肉营养不良症等疾病发生过程中发挥重要作用(Alexander et al.,2011;Hitachi et al.,2014)。骨骼肌卫星细胞来源于胚胎阶段的成肌细胞(Myoblast),对骨骼肌组织的损伤修复及稳态维持至关重要(Shahini et al.,2018)。骨骼肌卫星细胞附着在肌纤维肌膜与基底膜之间,保持静息状态,当骨骼肌组织受损时,卫星细胞被激活,并进入增殖和分化状态,最终形成新的肌纤维以修复受损的骨骼肌组织(解一凡等,2019;秦本源等,2020)。绵羊骨骼肌卫星细胞在体外易于培养和诱导分化,是研究骨骼肌生长发育调控机制的理想材料(张伟等,2019)。猪骨骼肌卫星细胞增殖能力强且具有多向分化潜能,可作为种子细胞用于未来组织工程研究(秦本源等,2020)。【本研究切入点】miR-486在绵羊骨骼肌和心肌中高表达,且在出生后绵羊骨骼肌中的表达量显著上调(张伟等,2018,2020),但在绵羊骨骼肌发育过程中miR-486是否是通过调控PI3K-Akt信号通路相关基因的表达而发挥其生物学功能仍有待进一步探究。【拟解决的关键问题】通过上调或下调绵羊骨骼肌卫星细胞中的miR-486,探究miR-486对绵羊骨骼肌卫星细胞增殖及PI3K-Akt信号通路相关基因表达的影响,以期为阐明miR-486对绵羊骨骼肌发育的调控机制打下基础。
1 材料与方法
1. 1 试验材料
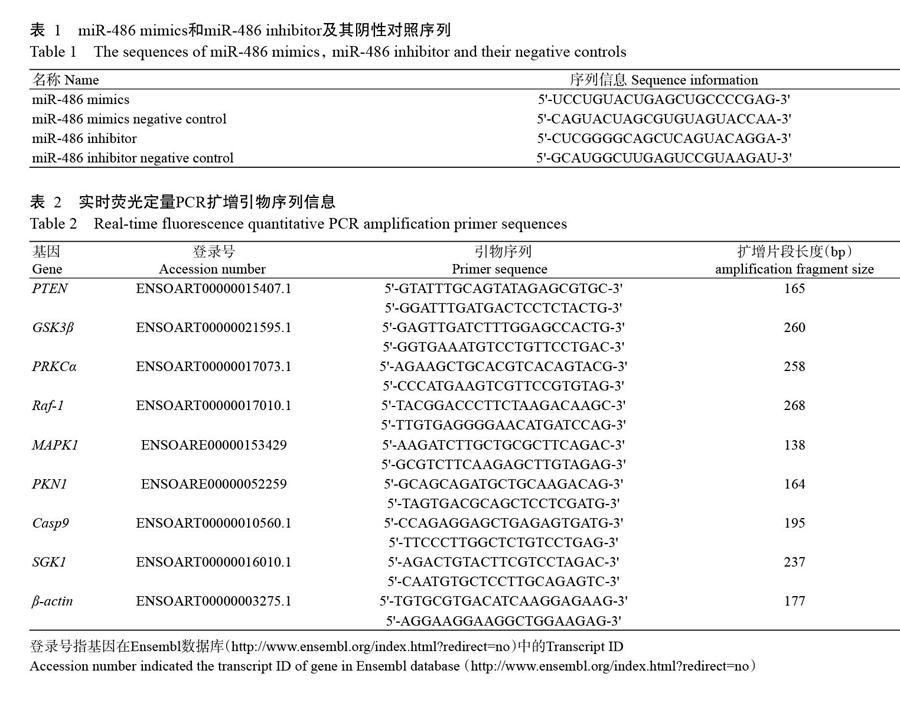
试验所用绵羊骨骼肌卫星细胞为省部共建绵羊遗传改良与健康养殖国家重点实验室使用巴什拜羊1日龄羔羊后肢骨骼肌组织通过原代培养获得,保存于液氮中。DMEM培养基、0.25%胰酶-EDTA和胎牛血清购自美国Gibco公司,青霉素+链霉素(双抗)购自美国Sigma公司,Lipofectamine 3000、TRIzol和反转录试剂购自美国Thermo公司,实时荧光定量PCR试剂盒购自TaKaRa公司,细胞培养皿和24孔板购自美国Corning公司,miR-486 mimics和miR-486 inhibitor及其阴性对照序列(表1)委托GenePharma公司合成,对应的扩增引物委托生工生物工程(上海)股份有限公司合成。
1. 2 试验方法
1. 2. 1 细胞培养 从液氮罐中取出1支绵羊骨骼肌卫星细胞冻存管,迅速置于50 ℃水浴锅中,待完全解冻后取出,擦干水,并以75%酒精消毒冻存管表面,然后转入6 cm培养皿中,加入完全培养基(89% DMEM+10%胎牛血清+1%双抗),然后置于5% CO2培养箱中进行扩大培养。
1. 2. 2 细胞转染 将绵羊骨骼肌卫星细胞按每孔约5000个细胞的密度接种至24孔板,使用完全培养基继续培养,待细胞良好贴壁生长后参照Lipofectamine 3000的操作说明将miR-486 mimics、miR-486 mimics negative control、miR-486 inhibitor和miR-486 inhibitor negative control分别转染绵羊骨骼肌卫星细胞,以不转染任何试剂的细胞组为空白对照。每处理转染8孔细胞,共计40孔细胞。
1. 2. 3 细胞增殖速度测定 上述转染细胞每组留1孔用于观察细胞的生长状态,其余各孔每隔24 h消化1孔,采用血球计数板进行计数,评估不同处理对绵羊骨骼肌卫星细胞增殖速度的影响。
1. 2. 4 细胞RNA提取及反转录 上述培养72 h的转染细胞待完成细胞计数后,参照TRIzol说明提取细胞总RNA,使用微量分光光度计(ND2000,美国Thermo公司)和1.0%琼脂糖凝胶电泳检测RNA质量。检测合格的RNA参照SuperScript IV VILO(美国Thermo公司)操作说明反转录合成cDNA,-20 ℃保存,用于相关基因表达的定量检测。
1. 2. 5 实时荧光定量PCR检测 选择PI3K-Akt信号通路关键基因PTEN(Phosphatase and tensin homolog)、GSK3b(Glycogen synthase kinase-3 beta)、PRKCα(Protein kinase C alpha)、Raf-1(Raf-1 proto-oncogene,serine/threonine kinase)、MAPK1(Mitogen-activated protein kinase 1)、 PKN1(Protein kinase N1)、Casp9(Caspase 9)和SGK1(Serum/glucocorticoid regulated kinase 1),检索Ensembl数据库,获取其mRNA序列,然后使用Oligo 6.0设计实时荧光定量PCR扩增引物(表2),以β-actin为内参基因,空白对照组细胞中相应基因的表达量为对照,对上述基因在不同处理组绵羊骨骼肌卫星细胞中的表达变化进行定量分析。上述基因在Ensembl数据库中的登录号及实时荧光定量PCR扩增引物见表2。实时荧光定量PCR反应体系20.0 μL:TB Green Premix Ex TaqⅡ(Tli RNaseH Plus)(2×)10.0 μL,上、下游引物(10 μmol/L)各0.8 μL,cDNA模板2.0 μL,ddH2O 6.4 μL。扩增程序:95 ℃預变性30 s;95 ℃ 10 s,58 ℃ 20 s,72 ℃ 20 s,进行40个循环。实时荧光定量PCR定量分析在Roche LightCycler 96(德国Germany公司)上完成,扩增反应结束后以0.1 ℃/s的速度进行熔解曲线分析。
1. 3 统计分析
PI3K-Akt号通路关键基因的相对表达量采用2-△△Ct法进行换算,并以SPSS 13.0进行单因素方差分析(One-way ANOVA)。各试验均重复3次。
2 结果与分析
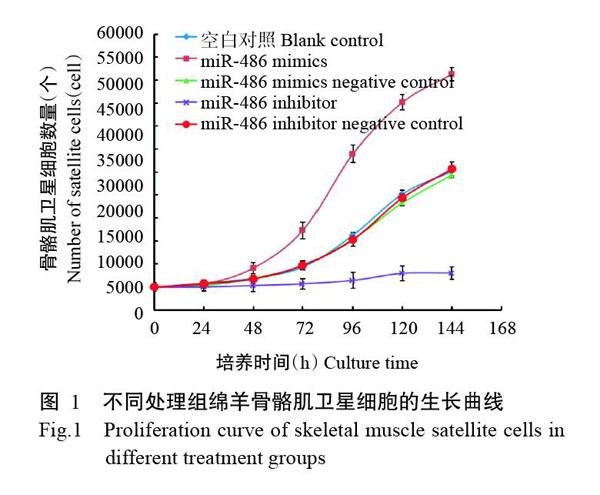
2. 1 miR-486对绵羊骨骼肌卫星细胞增殖的影响
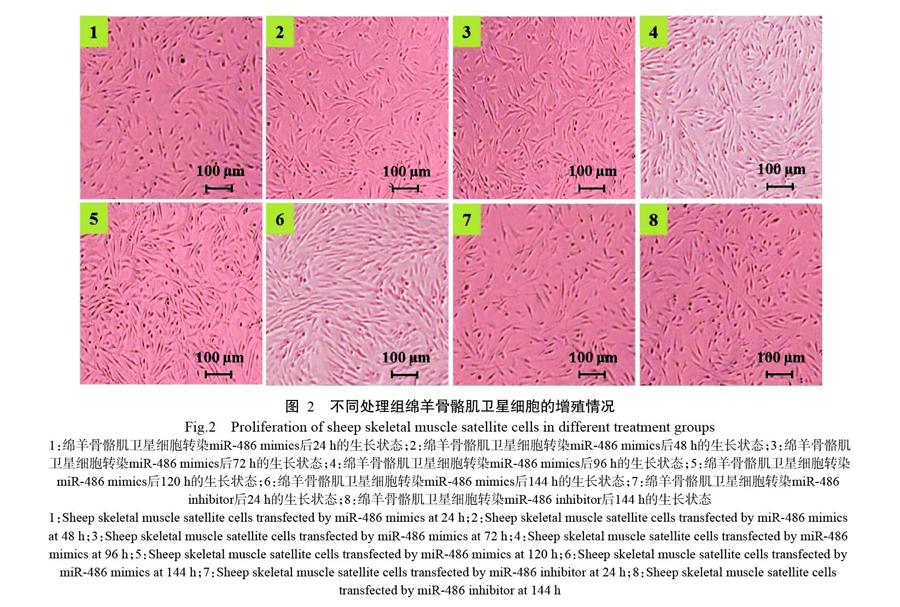
由图1可知,空白对照组及转染miR-486 mimics、miR-486 mimics negative control和miR-486 inhibitor negative control的绵羊骨骼肌卫星细胞表现出典型的S形增殖曲线,但各处理间的细胞增殖速度存在明显差异。转染miR-486 mimics能使绵羊骨骼肌卫星细胞中的miR-486水平上调,骨骼肌卫星细胞增殖速度加快,培养至48 h即开始进入对数生长阶段;而空白对照组及转染miR-486 mimics negative control和miR-486 inhibitor negative control的绵羊骨骼肌卫星细胞增殖速度未见明显变化;转染miR-486 inhibitor致使绵羊骨骼肌卫星细胞中的miR-486水平下调,骨骼肌卫星细胞增殖基本停滞(图2),提示miR-486在促进绵羊骨骼肌卫星细胞的增殖过程中发挥重要作用。
2. 2 PI3K-Akt信号通路相关基因的表达变化
PI3K-Akt信号通路相关基因实时荧光定量PCR检测的熔解曲线均为单峰,实时荧光定量PCR扩增产物经1.5%琼脂糖凝胶电泳检测,均获得明亮的单一条带,且条带大小与预期结果相符(图3),说明实时荧光定量PCR的反应效率和特异性均较高,检测结果可靠。
实时荧光定量PCR检测结果(图4)表明,PI3K-Akt信号通路相关基因在不同处理组绵羊骨骼肌卫星细胞中的相对表达量存在明显差异。其中,PTEN、Raf-1和MAPK1基因在转染miR-486 mimics绵羊骨骼肌卫星细胞中的相对表达量极显著低于其他处理组(P<0.01,下同),但在其他处理组间的差异不显著(P>0.05,下同);PRKCα和PKN1基因在转染miR-486 mimics绵羊骨骼肌卫星细胞中的相对表达量极显著高于其他处理组,但在其他处理组间的差异不显著;SGK1基因在转染miR-486 mimics绵羊骨骼肌卫星细胞中的相对表达量显著高于其他处理组(P<0.05,下同),但在其他处理组间的差异不显著;GSK3β和Casp9基因在不同处理组绵羊骨骼肌卫星细胞间的差异均不显著。
综合不同处理组绵羊骨骼肌卫星细胞的增殖情况可知,转染miR-486 mimics绵羊骨骼肌卫星细胞增殖速度的加快,可能与细胞中PTEN、Raf-1和MAPK1基因下调表达,以及PRKCα、PKN1和SGK1基因上调表达有关;而GSK3β和Casp9基因可能在维持绵羊骨骼肌卫星细胞基本生命活动中发挥作用,因此其相对表达量在不同处理组间无显著差异。
3 讨论
骨骼肌卫星细胞由胚胎期的成肌细胞分化而来,属于肌源性干细胞(Shahini et al.,2018)。在体内,当骨骼肌受高强度锻炼、损伤或其他刺激后,处于静止状态的骨骼肌卫星细胞被激活,通过增殖和分化成肌纤维以维持骨骼肌组织的进一步生长或完成受损组织修复(Griffin et al.,2010;Yin et al.,2013;郑琪等,2017)。在体外,骨骼肌卫星细胞不仅可被诱导分化为肌管,还能通过不同诱导方式使其分化为脂肪细胞、骨细胞及胰岛素生成细胞等(薛科等,2014;任宇等,2018;秦本源等,2020;张军芳等,2020)。可见,骨骼肌卫星细胞是体外研究细胞增殖和诱导分化调控机制的理想材料。本研究结果表明,上调绵羊骨骼肌卫星细胞中miR-486的水平可其进入快速分裂增殖状态,而骨骼肌卫星细胞中miR-486的水平下调后,即使在增殖培养基中其仍保持静止状态,故推测miR-486水平上调可激活骨骼肌卫星细胞,并促进其增殖。在杜氏肌肉营养不良症患者的肌组织中,肌纤维出现萎缩,处于静止状态的骨骼肌卫星细胞未被激活而直接进入增殖及分化状态,因此无法修复萎缩的肌组织(仝昕炜,2017)。已有研究表明,肌组织中miR-486的表达水平显著低于正常值,故推测骨骼肌卫星细胞无法被激活与miR-486表达水平下调有关(Small et al.,2010;Alexander et al.,2014),提示miR-486的表达对骨骼肌组织正常生长发育及稳态维持具有重要意义。
不同处理组绵羊骨骼肌卫星细胞中PI3K-Akt信号通路相关基因表达的实时荧光定量PCR检测结果表明,当绵羊骨骼肌卫星细胞中miR-486表达上调时,PTEN、Raf-1和MAPK1基因的相对表达量极显著下调,PRKCα和PKN1基因的相对表达量极显著上调,SGK1基因的相对表达量显著上调,而GSK3β和Casp9基因的相对表达量无显著变化,提示在绵羊骨骼肌卫星细胞中miR-486通过调控PI3K-Akt信号通路相关基因的表达而影响其生长发育。本课题组对绵羊骨骼肌中miR-486靶基因cDNA文库的研究表明,PI3K-Akt信号通路中的PTEN、Foxo1和PIK3R1基因直接受miR-486靶向调控,说明本研究检测到因miR-486表达上调引起的PI3K-Akt信号通路相关基因表达变化是通过PTEN和PIK3R1基因表达下调而引起,而在细胞水平上表现为骨骼肌卫星细胞进入快速增殖状态。此外,PI3K-Akt信号通路在骨骼肌稳态的维持中也发挥重要作用。Small等(2010)研究表明,miR-486可通过激活PI3K-Akt信号通路而参与小鼠肌肉的生长调控及结构稳定维持;Alexander等(2014)在杜氏肌肉营养不良症的动物模型中发现,当提高肌组织中的miR-486表达水平,可有效降低DOCK3和PTEN基因表达量,提高Akt磷酸化水平,最终促使肌肉营养不良的症状得到缓解;Yue等(2017)研究發现,在成年人骨骼肌卫星细胞中若敲除PTEN基因,骨骼肌卫星细胞将不经过增殖而直接转入成熟分化状态,导致骨骼肌卫星细胞数量消耗,这种情况若发生在体内则会影响骨骼肌损伤的修复和再生;石田培等(2020)对绵羊胚胎不同发育阶段骨骼肌中circRNA的转录组测序发现,大量差异表达基因富集于PI3K-Akt信号通路上。可见,在绵羊骨骼肌卫星细胞中miR-486通过调控PI3K-Akt信号通路相关基因表达而参与细胞的生长发育,骨骼肌卫星细胞中miR-486也可能通过调控PI3K-Akt信号通路中的其他基因而发挥作用,但具体作用机制有待进一步探究。
4 结论
miR-486通过调控PI3K-Akt信号通路相关基因的表达而参与绵羊骨骼肌卫星细胞生长发育及增殖,为深入研究miR-486对绵羊骨骼肌发育的调控机理及优质肉羊品种培育打下了理论基础。
参考文献:
秦本源,杨阳,张燕伟,刘敏,张万锋,王海珍,吴怡琦,张雪莲,蔡春波,高鹏飞,郭晓红,李步高,曹果清. 2020. 猪骨骼肌卫星细胞分离培养、鉴定及其生物学特性[J]. 中国农业科学,53(8):1664-1676. [Qin B Y,Yang Y,Zhang Y W,Liu M,Zhang W F,Wang H Z,Wu Y Q,Zhang X L,Cai C B,Gao P F,Guo X H,Li B G,Cao G Q. 2020. Isolation,culture,identification and biological characteristics of pig skeletal muscle satellite cells[J]. Scientia Agricultura Sinica,53(8):1664-1676.] doi:10.3864/j.issn.0578- 1752.2020.08.015.
任宇,梁红宇,楠吉桑漠,刘晓玲. 2018. 大鼠骨骼肌卫星细胞诱导分化为胰岛素生成细胞的研究[J]. 中华细胞与干细胞杂志,8(3):161-167. [Ren Y,Liang H Y,Nan J S M,Liu X L. 2018. Induced differentiation of rat skeletal muscle satellite cells into insulin producing cells[J]. China Journal of Cell & Stem Cell,8(3):161-167.] doi:10. 3877/cma.j.issn.2095-1221.2018.03.007.
石田培,王欣悦,侯浩宾,赵志达,尚明玉,张莉. 2020. 基于全转录组测序的绵羊胚胎不同发育阶段骨骼肌circRNA的分析与鉴定[J]. 中国农业科学,53(6):642-657. [Shi T P,Wang X Y,Hou H B,Zhao Z D,Shang M Y,Zhang L. 2020. Analysis and identification of circRNAs of ske-letal muscle at different stages of sheep embryos based on whole transcriptome sequencing[J]. Scientia Agricultura Sinica,53(6):642-657.] doi:10.3864/j.issn.0578-1752. 2020.03.015.
仝昕炜. 2017. 骨骼肌卫星细胞的研究进展[J]. 当代体育科技,7(4):22-23. [Tong X W. 2017. Research progress of skeletal muscle satellite cells[J]. Contemporary Sports Technology,7(4):22-23.] doi:10.16655/j.cnki.2095-2813. 2017.04.022.
解一凡,翟曼君,朱梦婷,牟健,赵宗胜. 2019. 哈萨克羊骨骼肌卫星细胞的分离培养及鉴定[J]. 畜牧与兽医,51(9):59-63. [Xie Y F,Zhai M J,Zhu M T,Mou J,Zhao Z S. 2019. Isolation,culture and identification of skeletal muscle satellite cells from Kazakh sheep[J]. Animal Husbandry & Veterinary Medicine,51(9):59-63.]
薛科,王林杰,陳利,王薏琳,仲涛,李利,张红平. 2014. 高糖诱导山羊骨骼肌卫星细胞成脂分化过程中相关基因表达的变化[J]. 畜牧兽医学报,45(5):706-713. [Xue K,Wang L J,Chen L,Wang Y L,Zhong T,Li L,Zhang H P. 2014. Adipogenic-related gene expressions in goat skeletal muscle satellite cells treated with high concentration glucose[J]. Acta Veterinaria et Zootechnica Sinica,45(5):706-713.] doi:10.11843/j.issn.0366-6964.2014. 05.005.
闫尊强,姜天团,孙文阳,王鹏飞,黄晓宇,杨巧丽,胡慧艳,李守湖,滚双宝. 2020. 环状RNA及其在猪上的研究进展[J]. 甘肃农业大学学报,55(6):1-9. [Yan Z Q,Jiang T T,Sun W Y,Wang P F,Huang X Y,Yang Q L,Hu H Y,Li S H,Gun S B. 2020. Circular RNA and its research progress in pig[J]. Journal of Gansu Agricultural University,55(6):1-9.] doi:10.13432/j.cnki.jgsau.2020.06.001.
张军芳,闫研,崔岩,孙斌,王英,孙建富,金鑫,严昌国,李香子. 2020. 不同种类脂肪酸对延边黄牛骨骼肌卫星细胞成脂转分化的影响[J]. 中国畜牧兽医,47(4):992-999. [Zhang J F,Yan Y,Cui Y,Sun B,Wang Y,Sun J F,Jin X,Yan C G,Li X Z. 2020. Effects of different fatty acids on adipogenic and transdifferentiation of skeletal muscle satellite cells in Yanbian yellow cattle[J]. China Animal Husbandry & Veterinary Medicine,47(4):992-999.] doi:10.16431/j.cnki.1671-7236.2020.04.003.
张伟,王世银,邓双义,杨力伟,刘晓娜,石国庆. 2019. 巴什拜羊骨骼肌卫星细胞分离培养及诱导分化[J]. 基因组学与应用生物学,38(1):82-88. [Zhang W,Wang S Y,Deng S Y,Yang L W,Liu X N,Shi G Q. 2019. Isolated culture and induced differentiation of Bashbay sheep (Ovis aries) skeletal muscle satellite cells[J]. Genetics and Applied Biology,38(1):82-88.] doi:10.13417/j.gab.038. 000082.
张伟,王世银,邓双义,杨力伟,石国庆,甘尚权. 2018. 巴什拜羊骨骼肌不同发育阶段差异表达miRNA研究[J]. 农业生物技术学报,26(1):104-112. [Zhang W,Wang S Y,Deng S Y,Yang L W,Shi G Q,Gan S Q. 2018. Research of differentially expressed miRNA of skeletal muscle during different development stages in Bashbay sheep (Ovis aries)[J]. Journal of Agircultural Biotechnology,26(1):104-112.] doi:10.3969/j.issn.1674-7968.2018.01. 011.
张伟,王世银,石国庆,邓双义,刘晓娜,杨力伟. 2020. 巴什拜羊miR-486多态性及其表达规律研究[J]. 农业生物技术学报,28(1):92-100. [Zhang W,Wang S Y,Shi G Q,Deng S Y,Liu X N,Yang L W. 2020. Polymorphism of miR-486 and its expression pattern in Bashby sheep(Ovis aries)[J]. Journal of Agircultural Biotechnology,28(1):92-100.] doi:10.3969/j.issn.1674-7968.2020.01. 009.
郑琪,睢梦华,朱龙,吴昊,丁建平,张运海,凌英会. 2017. 安淮山羊骨骼肌卫星细胞的分离培养与鉴定[J]. 安徽农业大学学报,44(2):198-202. [Zheng Q,Sui M H,Zhu L,Wu H,Ding J P,Zhang Y H,Ling Y H. 2017. Separation and identification of Anhuai goat skeletal muscle sa-tellite cells[J]. Journal of Anhui Agricultural University,44(2):198-202.] doi:10.13610/j.cnki.1672-352x.201704 19.026.
Alexander M S,Casar J C,Motohashi N,Vieira N M,Eisenberg I,Marshall J L,Gasperini M J,Lek A,Myers J A,Estrella E A,Kang P B,Shapiro F,Rahimov F,Kawahara G,Widrick J J,Kunkel L M. 2014. microRNA-486-dependent modulation of DOCK3/PTEN/AKT signaling pathways improves muscular dystrophy-associated symptoms[J]. The Journal of Clinical Investigation,124(6):2651-2667. doi:10.1172/JCI73579.
Alexander M S,Casar J C,Motohashi N,Myers J A,Eisenberg I,Gonzalez R T,Estrella E A,Kang P B,Kawahara G,Kunkel L M. 2011. Regulation of DMD pathology by an ankyrin-encoded miRNA[J]. Skeletal Muscle,1:27. doi:10.1186/2044-5040-1-27.
Cheng A M,Byrom M W,Shelton J,Ford L P. 2005. Antisense inhibition of human miRNAs and indications for an involvement of miRNA in cell growth and apoptosis[J]. Nucleic Acids Research,33(4):1290-1297. doi:10. 1093/nar/gki200.
Croce C M,Calin G A. 2005. miRNAs,cancer,and stem cell division[J]. Cell,122(1):6-7. doi:10.1016/j.cell.2005.06. 036.
Griffin C A,Apponi L H,Long K K,Pavlath G K. 2010. Chemokine expression and control of muscle cell migration during myogenesis[J]. Journal of Cell Science,123(18):3052-3060. doi:10.1242/jcs.066241.
Hitachi K,Nakatani M,Tsuchida K. 2014. Myostatin signa-ling regulates Akt activity via the regulation of miR-486 expression[J]. The International Journal of Biochemistry & Cell Biology,47:93-103. doi:10.1016/j.biocel.2013.12. 003.
Hwang H W,Mendel J T. 2006. microRNAs in cell proliferation,cell death,and tumorigenesis[J]. British Journal of Cancer,94(6):776-780. doi:10.1038/sj.bjc.6603023.
Puri P L,Sartorelli V. 2000. Regulation of muscle regulatory factors by DNA-binding,interacting proteins,and post-transcriptional modifications[J]. Journal of Cell Physio-logy,185(2):155-173. doi:10.1002/1097-4652(200011)185:2<155::AID-JCP1>3.0.CO; 2-Z.
Shahini A,Vydiam K,Choudhury D,Rajabian N,Nguyen T,Lei P,Andreadis S T. 2018. Efficient and high yield isolation of myoblasts from skeletal muscle[J]. Stem Cell Research,30:122-129. doi:10.1016/j.scr.2018.05.017.
Small E M,O′Rourke J R,Moresi V,Sutherland L B,McAnally J,Gerard R D,Richardson J A,Olson E N. 2010. Regulation of PI3-kinase/Akt signaling by muscle-enriched microRNA-486[J]. Proceedings of the National Academy of Sciences of the United States of America,107(9):4218-4223. doi:10.1073/pnas.1000300107.
Tavazoie S F,Alarcón C,Oskarsson T,Padua D,Wang Q Q,Bos P D,Gerald W L,Massagué J. 2008. Endogenous human microRNAs that suppress breast cancer metastasis[J]. Nature,451(7175):147-152. doi:10.1038/nature06 487.
Yin H,Price F,Rudnicki M A. 2013. Satellite cells and the muscle stem cell niche[J]. Physiological Reviews,93(1):23-67. doi:10.1152/physrev.00043.2011.
Yue F,Bi P P,Wang C,Shan T Z,Nie Y H,Ratliff T L,Gavin T P,Kuang S H. 2017. Pten is necessary for the quiescence and maintenance of adult muscle stem cells[J]. Nature Communications,8:14328. doi:10.1038/nco mms14328.
(責任编辑 兰宗宝)
收稿日期:2020-07-15
基金项目:新疆自然科学基金项目(2017D01A51)
通讯作者:张伟(1978-),https://orcid.org/0000-0003-1007-1681,博士,副教授,主要从事畜禽功能基因研究工作,E-mail:zhangweigsau@163.com
第一作者:王世银(1979-),https://orcid.org/0000-0003-3460-7671,副教授,主要从事动物遗传育种研究工作,E-mail:wangshiyin xjnzy@163.com
