怀玉山三叶青黄酮醇合酶基因克隆和表达分析
2021-12-15洪森荣陈正梦戴慧珍邓曼蕾
洪森荣 陈正梦 戴慧珍 邓曼蕾


摘要:【目的】對怀玉山三叶青黄酮醇合酶基因进行克隆和表达分析,为进一步揭示怀玉山三叶青黄酮醇合酶的生物学功能奠定基础。【方法】怀玉山三叶青黄酮醇合酶基因的核心片段通过其转录组数据库进行筛选,怀玉山三叶青黄酮醇合酶基因利用逆转录PCR进行克隆,序列分析采用生物信息学进行分析,器官表达采用实时荧光定量PCR(qRT-PCR)进行比较。【结果】怀玉山三叶青黄酮醇合酶基因cDNA总长度为987 bp,G+C含量为47.92%。怀玉山三叶青黄酮醇合酶由329个氨基酸组成,分子量37578.03 Da,理论等电点5.39,为亲水性蛋白;其二级结构中α-螺旋、β-折叠和无规则卷曲的比例分别占27.66%、21.88%和50.46%。怀玉山三叶青黄酮醇合酶主要存在内质网中,在进化上与山甜菜(Nekemias grossedentata)、河岸葡萄(Vitis riparia)和葡萄(Vitis vinifera)的亲缘关系较近,尤其是与山甜菜(N. grossedentata)黄酮醇合酶在进化上具有最高的亲缘关系。qRT-PCR分析结果表明,怀玉山三叶青黄酮醇合酶基因的表达在2个栽培种中存在器官特异性表达,怀玉2号在根中的相对表达量最高,怀玉1号在茎中的相对表达量最高。【结论】怀玉山三叶青黄酮醇合酶具有典型黄酮醇合酶的结构特征,氨基酸序列及核酸序列与同源物种相似度高,在进化上高度保守,且怀玉山三叶青黄酮醇合酶基因的表达存在组织器官差异性。
关键词: 怀玉山三叶青;黄酮醇合酶;基因克隆;表达分析
中图分类号: S687.301 文献标志码: A 文章编号:2095-1191(2021)08-2061-08
Cloning and expression analysis of flavonol synthase gene of Tetrastigma hemsleyanum Diels et Gilg in Huaiyushan
HONG Sen-rong1,2,3,4, CHEN Zheng-meng1, DAI Hui-zhen1, DENG Man-lei1
(1College of Life Sciences, Shangrao Normal University, Shangrao, Jiangxi 334001, China; 2Shangrao Key Laboratory of Protection and Utilization of Medicinal and Edible Homologous Plant Resources, Shangrao, Jiangxi 334001, China; 3Shangrao Tetrastigma hemsleyanum Diels et Gilg Conservation and Utilization Technology Innovation Center, Shangrao, Jiangxi 334001, China; 4Shangrao Agricultural Technology Innovation Research Institute,
Shangrao, Jiangxi 334001, China)
Abstract:【Objective】In order to provide theoretical basis for revealing the biological function of flavonol synthase of Tetrastigma hemsleyanum Diels et Gilg in Huaiyushan, the flavonol synthase gene of T. hemsleyanum Diels et Gilg in Huaiyushan was cloned and analyzed by expression. 【Method】The core fragment of flavonol synthase gene was screened from the transcriptome database of plantlets of T. hemsleyanum Diels et Gilg in Huaiyushan. The flavonol synthase gene of T. hemsleyanum Diels et Gilg in Huaiyushan was cloned by reverse transcription PCR(RT-PCR) technique, sequenced by bioinformatics method and analyzed in organ expression by real-time fluorescence quantitative PCR. 【Result】The total length of flavonol synthase gene cDNA of T. hemsleyanum Diels et Gilg in Huaiyushan was 987 bp and the content of G+C was 47.92%. The flavonol synthase of T. hemsleyanum Diels et Gilg in Huaiyushan was made up of 329 amino acids with molecular weight of 37578.03 Da and isoelectric point of 5.39, which was hydrophilic protein. The secondary structure was composed of α-helix(27.66%), β-lamella(21.88%), irregular curl(50.46%). The flavonol synthase of T. hemsleyanum Diels et Gilg in Huaiyushan mainly existed in the endoplasmic reticulum. The evolution of flavonol synthase of T. hemsleyanum Diels et Gilg in Huaiyushan was closely related to Nekemias grossedentata, Vitis riparia and V. vinifera, especially to flavonol synthase of N. grossedentata, they had the highest phylogenetic relationship. The results of qRT-PCR showed that the expression of flavonol synthase gene was organ specific in the two cultivars of T. hemsleyanum Diels et Gilg in Huaiyushan. Huaiyu No.2 had the highest expression in the root and Huaiyu No.1 had the highest expression in the stem. 【Conclusion】The flavonol synthase of T. hemsleyanum Diels et Gilg in Huaiyushan has typical structural characteristics of flavonol synthase. Its amino acid sequence and nucleic acid sequence are highly similar to homologous species and highly conserved in evolution. There are tissue organ differences in the expression of flavonol synthase gene of T. hemsleyanum Diels et Gilg in Huaiyushan.
Key words: Tetrastigma hemsleyanum Diels et Gilg in Huaiyushan;flavonol synthase;gene cloning;expression ana-lysis
Foundation item: National Natural Science Foundation of China(31960079); General Project of Key Research and Development Plan of Jiangxi Department of Science and Technology(20192BBGL70050, 20202BBG73010); Science and Technology Research Project of Jiangxi Department of Education(GJJ201704)
0 引言
【研究意义】三叶青是我国特有珍稀濒危药用植物,属葡萄科崖爬藤属藤本植物,学名为三叶崖爬藤(Tetrastigma hemsleyanum Diels et Gilg)(Zhu et al.,2020)。三叶青全株均可药用,以地下块根和果实药用效果最佳,主要分布于浙江、江西、福建、湖北、广东、广西、四川、贵州和云南等地(Wang et al.,2015),主要含有黄酮类、甾醇类、有机酸类和多糖等成分,具有抗菌、抗肿瘤、抗病毒、抗炎保肝、镇痛解热、消肿抑瘤及促进细胞凋亡等功能(Ji et al.,2019),被誉为安全有效、无毒、无副作用及无抗药性的植物抗生素(林国卫等,2020)。其中黄酮类化合物是一大类天然产物,在自然界中最常见的黄酮类化合物主要有黄酮和黄酮醇。黄酮醇(Flavonol)是以糖基化的形式存在于植物中的无色多酚类次级代谢产物,具有抵御紫外线伤害、抗寒抗旱、抗氧化、抗衰老、抗炎和降糖降脂等作用(Peng et al.,2019)。黄酮醇合酶(Flavonol synthase,FLS)属于类黄酮代谢的节点酶,可将二氢槲皮素和二氢山奈酚等二氢黄酮醇催化合成槲皮素和山奈酚等黄酮醇,不仅直接影响黄酮醇的合成,对其他黄酮类化合物的积累及植物生理特征也有很重要的影响(Lukacin et al.,2003)。怀玉山三叶青是上饶市玉山县国家地理标志农产品,其保健与药用价值高。因此,对怀玉山三叶青的黄酮醇合酶基因进行克隆和序列分析,对认识黄酮类化合物生物代谢途径及进一步分析黄酮类化合物的生物合成具有重要意义。【前人研究进展】关于黄酮醇合酶研究的报道较多,蒋洁等(2013)克隆金荞麦黄酮醇合酶(FdFLS)基因的编码序列,研究了该基因的序列、原核表达和活性,可深入了解金荞麦黄酮类物质生物合成的分子途径;柳爱玲等(2013)克隆甜樱桃黄酮醇合酶基因,并进行原核表达和组织时空表达分析,显示黄酮醇合酶基因可能与黄酮醇参与花粉萌发及利于授粉有关;沈笑飞等(2014)克隆黑果枸杞和宁夏枸杞中的黄酮醇合酶基因,并分析其在2种枸杞果实4个发育时期中的表达模式差异;杨文婷等(2015)克隆红花黄酮醇合酶基因的全长cDNA,植物表达载体成功构建,有助于进一步了解黄酮化合物的合成机制;赵欢欢等(2016)和李青青等(2018)对苦荞黄酮醇合酶基因FtFLS4和FtFLS2进行克隆,并研究了p ET47b-FtFLS2的重组表达及多克隆抗体制备,为从蛋白表达水平上分析FtFLS4和FtFLS2与苦养黄酮类化合物累积的关系奠定基础;鞠志刚等(2018)对黔产艾纳香黄酮醇合酶基因进行克隆,并对其进行了生物信息学分析,为黄酮醇类化合物的生物合成提供理论基础;邹庆军等(2018)研究杭菊黄酮醇合酶基因的原核表达和重组蛋白体外活性,为从分子水平调控杭菊黄酮醇成分代谢及体外催化合成黄酮醇提供新思路;李海鸿等(2019)对葡萄风信子黄酮醇合酶基因进行克隆和表达分析,为开展单子叶植物花色育种提供理论依据。【本研究切入点】目前,对三叶青的研究主要集中在化学成分(付立忠等,2019)、组织培养(洪春桃等,2019)、种植栽培(徐惠龙等,2020)及药理临床(林钰久等,2021)等方面,关于三叶青黄酮醇合酶方面的研究尚未见报道。【拟解决的关键问题】怀玉山三叶青黄酮醇合酶基因通過逆转录技术进行克隆,序列和组织表达分别利用生物信息学方法和实时荧光定量PCR(qRT-PCR)进行分析和比较,为进一步揭示怀玉山三叶青黄酮醇合酶的生物学功能奠定基础,也为怀玉山三叶青黄酮醇成分代谢的分子调控以及其体外催化合成黄酮醇提供新视野。
1 材料与方法
1. 1 试验材料
怀玉山三叶青栽培种怀玉1号和怀玉2号试管苗由上饶市红日农业开发有限公司提供。怀玉1号特点:形成块根早,个头偏小,块根纺锤形,叶薄而小。怀玉2号特点:形成块根稍晚,个头偏大,块根长柱状,叶厚且大。
1. 2 试验方法
1. 2. 1 总RNA提取和cDNA第一链合成 于2020年4月用TRIzol试剂按RNA提取说明书提取总RNA(怀玉1号和怀玉2号试管苗),采用紫外分光光度计及1%琼脂糖凝胶电泳检测两者RNA浓度及其完整性。以提取的RNA为模板,按照M-MLV cDNA第一链合成试剂盒说明合成cDNA第一链。逆转录引物用Oligo(dT)18 Primer:5'-GGCCACGCGTCGAC TA GTACTTTTTTTTTTTTTTTTTT-3',具体步骤按RNA逆转录说明进行操作。
1. 2. 2 黄酮醇合酶基因克隆 利用转录组组装的Unigene序列信息,运用Primer Premier 5.0设计引物(F:5'-ATGCAGATTGAGAGAGTGCAAGCCA-3';R:5'-CTTATTAAATTTGCGGTGGCGGAAC-3')。PCR扩增程序:95 ℃预变性2 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,进行35个循环;72 ℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳检测后,将含有目的基因的条带切胶回收后与pMD19-T载体连接并用热激法转化到感受态细胞E.coli DH5α,经鉴定正确的阳性转化子提取质粒送至生工生物工程(上海)股份有限公司测序。
1. 2. 3 黄酮醇合酶基因的生物信息学分析 氨基酸序列:利用BioEdit 7.2.1对基因序列进行翻译。酶理化性质预测:在线工具ExPASy ProtParam Tool。酶疏/亲水性预测:ProtScale程序。酶二级结构预测:GOR IV。酶三级结构预测:SWISS-MOLD。基因表达部位预测:WoLFPsort在线软件。氨基酸序列比对分析:DNAMAN和BioEdit软件。系统发育进化树构建:MEGA 5.0的邻接法。
1. 2. 4 黄酮醇合酶基因的组织表达分析 提取怀玉1号和怀玉2号试管苗根、茎、叶的RNA(各500 ng),然后进行反转录合成cDNA。qRT-PCR内参基因为GAPDH,荧光染料为SYBR Green I。黄酮醇合酶基因引物设计为F:5'-ATATGTACCCACCATGCC CACA-3';R:5'-CGGCGATCCAGTTATCGTCTT-3'。内参基因GAPDH引物设计为F:5'-CCATTACTGCT ACCCAAAAAACT-3';R:5'-GTGAGGTCAACCA CCGACACATC-3'。qRT-PCR反应体系20 μL,扩增程序如下:95 ℃预变性10 min;95 ℃ 10 s,60 ℃ 34 s,95 ℃ 15 s,进行40个循环。基因相对表达量计算:2-△△Ct法。qRT-PCR试验重复3次。基因表达水平表示为平均值±标准差,黄酮醇合酶基因组织表达的差异显著性采用SPSS 19.0的单因素方差分析(One-way ANOVA)检验。
2 结果与分析
2. 1 怀玉山三叶青黄酮醇合酶基因cDNA序列
怀玉山三叶青黄酮醇合酶基因经PCR扩增(图1),其cDNA总长度为987 bp(图2),其G+C含量为47.92%(图3)。
2. 2 怀玉山三叶青黄酮醇合酶氨基酸序列
ProtParam预测结果显示怀玉山三叶青黄酮醇合酶氨基酸序列见图4。怀玉山三叶青黄酮醇合酶由329个氨基酸组成,分子量37578.03 Da,理化等电点5.39,为亲水性蛋白。各氨基酸的Ala(A)数目和比例分别为17和5.2%,Arg(R)数目和比例分别为10和3.0%,Asn(N)数目和比例分别为17和5.2%,Asp(D)数目和比例分别为14和4.3%,Cys(C)数目和比例分别为3和0.9%,Gln(Q)数目和比例分别为10和3.0%,Glu(E)数目和比例分别为34和10.3%,Gly(G)数目和比例分别为19和5.8%,His(H)数目和比例分别为10和3.0%,Ile(I)数目和比例分别为16和4.9%,Leu(L)数目和比例分别为35和10.6%,Lys(K)数目和比例分别为26和7.9%,Met(M)数目和比例分别为8和2.4%,Phe(F)数目和比例分别为15和4.6%,Pro(P)数目和比例分别为24和7.3%,Ser(S)数目和比例分别为17和5.2%,Thr(T)数目和比例分別为14和4.3%,Trp(W)数目和比例分别为7和2.1%,Tyr(Y)数目和比例分别为10和3.0%,Val(V)数目和比例分别为23和7.0%。带负电残基总数(Asp+Glu)为48,正电荷残基总数(Arg+Lys)为36。怀玉山三叶青黄酮醇合酶失稳指数(II)计算为44.57,为不稳定蛋白。
2. 3 怀玉山三叶青黄酮醇合酶亲/疏水性分析
从图5可知,高峰值(正值)的区域表示疏水的区域,而负值的低谷区域是亲水区域;亲/疏水性预测结果表明,最大疏水值为2.5左右,在该多肽中说明该处的疏水性最强,亲水峰最大值为-3.5左右;整个蛋白表现出高度的亲水性,说明该蛋白为亲水性蛋白。
2. 4 怀玉山三叶青黄酮醇合酶二级结构分析
怀玉山三叶青黄酮醇合酶二级结构(图6)预测结果显示,其二级结构由α-螺旋Alpha helix(Hh,27.66%)、β-折叠Extended strand(Ee,21.88%)、无规则卷曲Random coil(Cc,50.46%)构成。从分布位点上来看,C端和N端含无规则卷曲、β-折叠和α-螺旋,无规则卷曲、β-折叠和α-螺旋则散布于整个蛋白结构中(图7)。
2. 5 怀玉山三叶青黄酮醇合酶三级结构分析
由图8可知,怀玉山三叶青黄酮醇合酶的三级结构为单体(SWISS-MODEL预测)。
2. 6 怀玉山三叶青黄酮醇合酶亚细胞定位
采用WoLFPsort在线软件对怀玉山三叶青黄酮醇合酶基因的表达部位进行预测,结果(图9)显示,基因定位于内质网的数量为5.5,定位于内质网质膜的数量为4.0,定位于细胞外的数量为3.0,定位于细胞质的数量为2.0,定位于线粒体中的数量为2.0,定位于质膜的数量是1.5。表明怀玉山三叶青黄酮醇合酶基因主要存在于内质网。
2. 7 怀玉山三叶青黄酮醇合酶系统进化分析
由构建的系统发育进化树(图10)可知,怀玉山三叶青与山甜菜(Nekemias grossedentata)、河岸葡萄(Vitis riparia)、葡萄(Vitis vinifera)在一个大分支下,说明怀玉山三叶青黄酮醇合酶在进化上与山甜菜(N. grossedentata)黄酮醇合酶、河岸葡萄(V. ripa-ria)黄酮醇合酶/黄烷3-羟化酶样、葡萄(V. vinifera)假设蛋白VITISV-029566、葡萄(V. vinifera)黄酮醇合酶/黄烷3-羟化酶的亲缘关系较近,特别与山甜菜(N. grossedentata)黄酮醇合酶具有较高的亲缘关系。
2. 8 怀玉山三叶青黄酮醇合酶同源蛋白序列比对分析
怀玉山三叶青黄酮醇合酶同源蛋白序列比对分析结果见图11,该蛋白家族的保守结构域用※号表示。怀玉山三叶青黄酮醇合酶同源蛋白的序列与山甜菜(N. grossedentata)黄酮醇合酶(AGO02176.1)的序列除几个位点有变动外,其余位点氨基酸序列一致,进一步验证怀玉山三叶青黄酮醇合酶与山甜菜(N. grossedentata)黄酮醇合酶具有较高的亲缘关系。
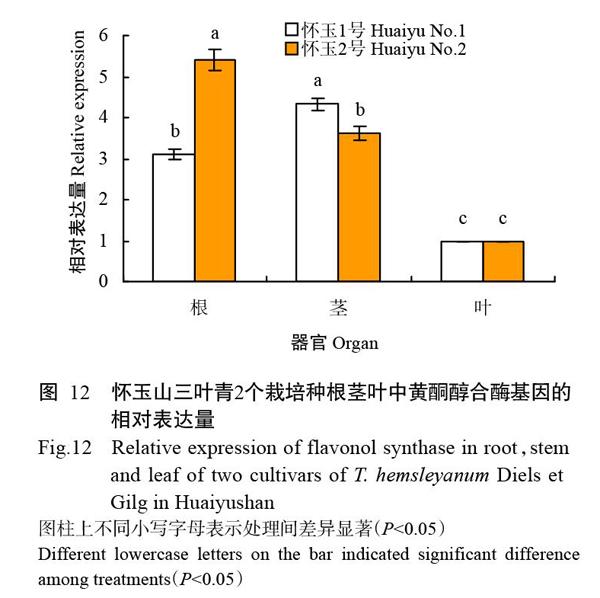
2. 9 怀玉山三叶青2个栽培种不同器官中黄酮醇合酶基因的表达分析
以怀玉山三叶青的GAPDH为内参基因,利用qRT-PCR分析怀玉山三叶青黄酮醇合酶基因在怀玉山三叶青2个栽培种不同器官中的表达情况。从图12可知,怀玉山三叶青黄酮醇合酶基因在根茎叶中均有表达,因此,怀玉山三叶青的根茎叶均可检测到总黄酮;但在不同器官的表达情况差异显著(P<0.05,下同),其中对于怀玉2号,怀玉山三叶青黄酮醇合酶基因在其根中的相对表达量最高,而对于怀玉1号,怀玉山三叶青黄酮醇合酶基因在其茎中的相对表达量最高。
3 讨论
黄酮醇是植物内在品质和道地性形成的重要物质基础,是植物较为重要的次生代谢物质。作为黄酮化合物合成途径中的关键酶,催化二氢黄酮醇合成黄酮醇,黄酮醇合酶已在多种植物中被克隆和表达分析(Owens et al.,2008)。在本研究中,利用转录组数据首次成功克隆获得怀玉山三叶青黄酮醇合酶基因,通过系统进化树分析和同源蛋白序列比对分析发现,怀玉山三叶青黄酮醇合酶基因氨基酸序列较保守,同时怀玉山三叶青与山甜菜(N. grossedentata)黄酮醇合酶、河岸葡萄(V. riparia)黄酮醇合酶/黄烷3-羟化酶样、葡萄(V. vinifera)黄酮醇合酶/黄烷3-羟化酶等共用一个节点,具有较高的同源性,表明怀玉山三叶青的黄酮醇合酶在进化上与山甜菜、河岸葡萄和葡萄关系密切。
三叶青被誉为天然广谱的植物抗生素,含有黄酮类物质具有抗肿瘤活性,可促进机体免疫,还可调节细胞内相关细胞因子的分泌,能起到抑瘤抗癌的作用(Peng et al.,2019)。黄酮醇合酶基因以二氢黄酮醇为底物,最后经过一系列反应形成杨梅素、山奈酚和槲皮素等黄酮醇,对植物中黄酮类物质的累积具有重要作用(Moriguchi et al.,2002),因此可采用调控黄酮醇合酶表达量的方法影响三叶青地下块根的品质。本研究结果表明,黄酮醇合酶基因在怀玉山三叶青2个栽培种中的表达一般存在器官特异性,说明黄酮醇合酶在怀玉山三叶青2个栽培种黄酮代谢途径中扮演着不同的角色,与柳爱玲等(2013)、赵欢欢等(2016)、李海鸿等(2019)在荞黄酮醇合酶上的研究结果相似,为深入研究怀玉山三叶青黄酮醇合酶基因的调控模式提供了分子依据。
4 结论
怀玉山三叶青黄酮醇合酶具有典型黄酮醇合酶的结构特征,氨基酸序列及核酸序列与同源物种相似度高,在进化上高度保守,且怀玉山三叶青黄酮醇合酶基因的表达存在组织器官差异性。
参考文献:
付立忠,赵利梅,吕惠卿,程俊文,卢廷高. 2019. 钾对三叶青生物量及其茎叶化学成分、抗氧化活性的影响[J]. 中药材,42(12):2751-2754. [Fu L Z,Zhao L M,Lü H Q,Cheng J W,Lu T G. 2019. Effects of potassium on biomass,chemical composition and antioxidant activity of Tetrastigma hemsleyanum[J]. Journal of Chinese Medicinal Materials,42(12):2751-2754.] doi:10.13863/j.issn 1001-4454.2019.12.003.
洪春桃,沈登锋,魏斌,章建红. 2019. 几种三叶青组织培养快繁体系的比较及其优化[J]. 浙江农业科学,60(10):1846-1849.[Hong C T,Shen D F,Wei B,Zhang J H. 2019. Comparison and optimization of several micropropagation systems for tissue culture of Tetrastigma hemsleyanum[J]. Journal of Zhejiang Agricultural Sciences,60(10):1846-1849.] doi:10.16178/j.issn.0528-9017.2019 1047.
蒋洁,白悦辰,李成磊,陈惠,吴琦. 2013. 金荞麦黄酮醇合酶基因的克隆及在大肠杆菌中的表达[J]. 中草药,44(14):1974-1978. [Jiang J,Bai Y C,Li C L,Chen H,Wu Q. 2013. Cloning of flavonol synthase gene from Fago-pyum dibotrys and its expression in Escherichia coli[J]. Chinese Traditional and Herbal Drugs,44(14): 1974-1978.] doi:10.7501/j.issn.0253-2670.2013.14.020.
鞠志剛,孙世宇,申鹏,杨芳芳,缪艳燕,陈晓兰. 2018. 黔产艾纳香黄酮醇合酶基因的克隆及其生物信息学分析[J].分子植物育种,16(21):7004-7008.[Ju Z G,Sun S Y,Shen P,Yang F F,Miu Y Y,Chen X L. 2018. Cloning and bioinformatics analysis of FLS in Blumea balsami-fera from Guizhou[J]. Molecular Plant Breeding,16(21): 7004-7008.] doi:10.13271/j.mpb.016.007004.
李海鸿,刘雅莉,刘红利,娄倩. 2019. 葡萄风信子黄酮醇合酶基因克隆和表达分析[J]. 西北林学院学报,34(2):116-121.[Li H H,Liu Y L,Liu H L,Lou Q. 2019. Cloning and expression analysis of FLS gene in Muscari armeniacum[J]. Journal of Northwest Forestry University,34(2):116-121.] doi:10.3969/j.issn.1001-7461.2019.02.18.
李青青,张润敏,石冠蓝,姚攀锋,王晓丽,李成磊. 2018. 苦荞黄酮醇合酶基因 FtFLS4 的克隆及其在大肠杆菌的表达[J].四川农业大学学报,36(5):611-617.[Li Q Q,Zhang R M,Shi G L,Yao P D,Wang X L,Li C L. 2018. Cloning of flavonolsynthase gene FtFLS4 from tartary buckwheat and expression in E. coli[J]. Journal of Sichuan Agricultural University, 36(5): 611-617.] doi:10.16036/j.issn.1000-2650.2018.05.007.
林国卫,闻静,石光禹,潘彬彬,陈丽丽,丁欢欢,蔡红,陈荣华,洪森荣. 2020. 侵染怀玉山三叶青的病毒RT-PCR鉴定[J]. 分子植物育种,18(3):968-975.[Lin G W,Wen J,Shi G Y,Pan B B,Chen L L,Ding H H,Cai H,Chen R H,Hong S R. 2020. Identification of viruses infecting Huaiyushan Tetrastigma hemsleyanum Diels et Gilg by RT-PCR[J]. Molecular Plant Breeding,18(3):968-975.] doi:10.13271/j.mpb.018.000968.
林鈺久,柴树人,龙坤兰,陈骏,石冀敏,徐静静. 2021. 三叶青黄酮对荷Lewis肺癌小鼠免疫功能及肿瘤组织凋亡相关蛋白的影响[J]. 天然产物研究与开发,33(1):8-15.[Lin Y J,Cai S R,Long K L,Chen J,Shi J M,Xu J J. 2021. Effects of Tetrastigma hemsleyanum Diels et Gilg flavone on immune function and apoptosis-related proteins in tumor tissues of Lewis lung cancer mice[J]. Natu-ral Product Research and Development,33(1): 8-15.] doi:10.16333/j.1001-6880.2021.1.002.
柳爱玲,沈欣杰,刘芸,袁华招,张晓明,李天红. 2013. 甜樱桃黄酮醇合酶基因的克隆及其表达分析[J]. 中国农业大学学报,18(2):56-63.[Liu A L,Shen X J,Liu Y,Yuan H Z,Zhang X M,Li T H. 2013. Cloning and expression analysis of PacFLS in sweet cherry(Prunus avium L.)[J]. Journal of China Agricultural University,18(2):56-63.]
沈笑飞,刘永亮,王瑛,曾少华. 2014. 黑果枸杞和宁夏枸杞中黄酮醇合酶基因的克隆及表达分析[J]. 基因组学与应用生物学,33(3):591-597. [Shen X F,Liu Y L,Wang Y,Zeng S H. 2014. Molecular cloning and expression analysis of flavonol synthase in Lycium ruthenicum Murr. and Lycium barbarum L.[J]. Genomics and Applied Biology,33(3): 591-597.] doi:10.13417/j.gab.033.000591.
徐惠龙,刘江明,范小芳,许文,范世明. 2020. 不同光照强度对三叶青生长发育及其总黄酮的影响[J]. 中国现代中药,22(11):1866-1870. [Xu H L,Liu J M,Fan X F,Xu W,Fan S M. 2020. Effects of different light intensity on growth and total flavonoids of Tetrastigma hemsleyanum[J]. Modern Chinese Medicine,22(11):1866-1870.] doi: 10.13313/j.issn.1673-4890.20200211007.
杨文婷,刘秀明,万秋,姚娜,王南,张雪萌,焦重达,李海燕,李校堃. 2015. 红花黄酮醇合酶基因的全长cDNA克隆及植物表达载体的构建[J]. 中国中药杂志,40(4):634-638.[Yang W T,Liu X M,Wan Q,Yao N,Wang N,Zhang X M,Jiao Z D,Li H Y,Li X K. 2015. Full-length cDNA cloning of flavonol synthase genes of Carthamus tinctorius and construction plant expression vector[J]. China Journal of Chinese Materia Medica,40(4): 634-638.] doi:10. 4268/cjcmm20150412.
赵欢欢,张钟仁,李学俊,陈鹏. 2016. 苦荞黄酮醇合酶FtFLS2的重组表达及多克隆抗体制备[J]. 核农学报,30(2):240-245. [Zhao H H,Zhang Z R,Li X J,Chen P. 2016. Prokaryotic expression of tartary buckwheat flavonol synthase FtFLS2 and preparation of its polyclonal antibody[J]. Journal of Nuclear Agricultural Sciences,30(2): 240-245.] doi:10.11869/j.issn.100-8551.2016.02.0240.
邹庆军,汪涛,郭巧生,张文燕,王蕊,王宇晖,肖有梅. 2018. 杭菊黄酮醇合酶基因的原核表达与重组蛋白体外活性研究[J]. 中国中药杂志,43(17):3471-3476.[Zou Q J,Wang T,Guo Q S,Zhang W Y,Wang R,Wang Y H,Xiao Y M. 2018. Prokaryotic expression and in vitro enzyme activity analysis of flavonol synthase in Chrysanthemum morifolium cv. ‘Hangju[J]. China Journal of Chinese Materia Medica,43(17): 3471-3476.] doi:10.19540/ j.cnki.cjcmm.20180510.007.
Ji W W,Peng X,Lou T L,Wang J,Qiu W Y. 2019. Total flavonoids from Tetrastigma hemsleyanum ameliorates inflammatory stress in concanavalin A-induced autoimmune hepatitis mice by regulating Treg/Th17 immune homeostasis[J]. Inflammopharmacology,27(6):1297-1307. doi:10.1007/s10787-019-00599-0.
Lukacin R,Wellmann F,Britsch L,Martens S,Matern U. 2003. Flavonol synthase from Citrus unshiu is a bifunctional dioxygenase[J]. Phytochemistry,62(3): 287-292. doi:10.1016/S0031-9422(02)00567-8.
Moriguchi T,Kita M,Ogawa K,Tomono Y,Endo T,Omura M. 2002. Flavonol synthase gene expression during citrus fruit development[J]. Physiologia Plantarum,114(2): 251-258. doi:10.1034/j.1399-3054.2002.1140211.x.
Owens D K,Alerding A B,Crosby K C,Bandara A B,Westwood J H,Winkel B S J. 2008. Functional analysis of a predicted flavonol synthase gene family in Arabidopsis[J]. Plant Physiology,147(3): 1046-1061. doi:10.1104/pp.108.117457.
Peng X,Wu H,Chen H J,Zhang Y J,Qiu D,Zhang Z Y. 2019. Transcriptome profiling reveals candidate flavonol-related genes of Tetrastigma hemsleyanum under cold stress[J]. BMC Genomics,20(1):687. doi:10.1186/s12864-019- 6045-y.
Wang Y H,Jiang W M,Comes H P,Hu F S,Qiu Y X,Fu C X. 2015. Molecular phylogeography and ecological niche modelling of a widespread herbaceous climber,Tetrastigma hemsleyanum(Vitaceae): Insights into Plio-Pleistocene range dynamics of evergreen forest in subtropical China[J]. New Phytologist,206(2): 852-867. doi:10.1111/nph. 13261.
Zhu R Y,Xu X F,Ying J L,Cao G,Wu X. 2020. The phytochemistry,pharmacology,and quality control of Tetrastigma hemsleyanum Diels & Gilg in China: A review[J]. Frontiers in Pharmacology,11:550497. doi:10.3389/fphar. 2020.550497.
(責任编辑 邓慧灵)
收稿日期:2021-02-04
基金项目:国家自然科学基金项目(31960079);江西省科技厅重点研发计划一般项目(20192BBGL70050,20202BBG73010);江西省教育厅科学技术研究项目(GJJ201704)
第一作者:洪森荣(1974-),https://orcid.org/0000-0002-9219-8303,教授,主要从事植物生物技术研究工作,E-mail:hongsenrong@163.com
