我国伦理委员会管理制度调研与结果分析
2021-12-14张彦彦李长青姚佩颖肖瑶陈江鹏吕心欢杨建红
张彦彦,李长青,姚佩颖,肖瑶,陈江鹏,吕心欢,杨建红*
(1.沈阳药科大学亦弘商学院,北京100055;2.精鼎医药研究开发有限公司,上海200120;3.缔脉生物医药科技(上海)有限公司,上海201210)
从各国的监管经验来看,伦理委员会在临床试验管理中发挥着重要的作用。伦理委员会从其建立,历经演变和发展,都承袭相同的职责——保护受试者权益和安全。截至目前,这一重要职责在各国法律中均已明确定位。
自1988年7月中国协和医科大学(现为中国医学科学院北京协和医学院)发布《医院伦理学委员会及其在我国建立的设想》开始[1],经过30多年的不断完善,我国伦理委员会的立法体系、机构设置、审查程序和监督管理等方面都在不断趋于完善和成熟。但面对药品全球同步研发的大趋势,多中心临床试验的剧增,伦理委员会面临着“审查效率”和“审查质量”的双重压力。如何在保障伦理审查质量的同时保护好受试者权益,结合目前临床试验发展的现状,进一步提高伦理审查的效率,需要不断探索和完善。为理清我国伦理委员会管理制度的现状及存在的问题,本文在前期文献研究的基础上,开展本次问卷调查,并对调查结果进行分析。
1 资料与方法
本研究采用自行设计的调查问卷。首先对4位来自伦理委员会、机构研究者、申办方、新药研发合同外包服务机构(contract research organization,CRO)的资深专家进行访谈,明确了我国伦理委员会管理制度研究的重点及关键问题;其次依据专家访谈的结果汇总,本研究围绕关于伦理委员会法律法规层级的设置、伦理审查原则、伦理审查独立性、伦理审查标准、伦理审查能力、伦理审查效率、区域伦理委员会、伦理审查顺序、创新药的伦理审查以及伦理委员会的监管等10个方面问题进行了问卷设计。
本次调研对象主要针对临床试验相关方,包括:监管机构、临床研究机构管理者、研究者、伦理委员会成员、申办者、CRO等。调查方法为问卷调查法,通过问卷星发放电子版问卷,发放问卷 240份,共回收有效问卷240份。
2 调查结果
2.1 调研对象的基本信息
2.1.1 调研对象工作领域分布及平均工作年限 调研对象情况如表1所示,除监管机构(A)和临床研究机构管理者(B)外,在调研中进一步区分了不同临床试验各相关方的类别,比如申办者(E)和CRO(F)划分为内(外)资企业,根据主持开展的临床研究类型区分了不同类型研究者(D),根据职务区分了伦理委员会成员(C)等。在调研对象中数量最多的前5类人群分别为:内资企业的申办者、临床研究机构管理者、内资的CRO企业、外资的申办者以及伦理委员会委员,此5类人群占总问卷回收量的60%。同时,具有5年以上工作经验的临床试验相关方占全部调研对象的73%。
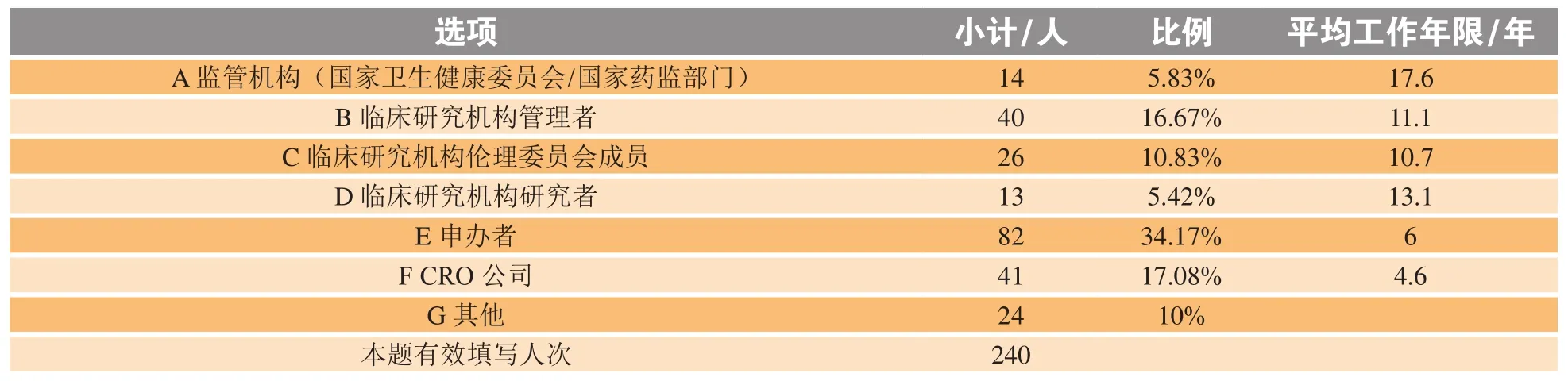
表1 调研对象工作领域分布及平均工作年限Table 1 Job distribution and average working years of survey respondents
2.1.2 调研对象了解国内外伦理委员会管理制度的情况 调研结果显示,93%以上的调研对象均了解我国伦理委员会管理制度,其中分别有24.58%和15%的调研对象主要了解美国和欧盟的伦理委员会管理制度(见表2)。综上,超过90%的调研对象了解我国伦理委员会管理制度,本次的问卷结果具有一定的可靠性。

表2 调研对象了解国内(外)伦理委员会管理制度的情况Table 2 Respondents’knowledge of the management systems of Ethics Committee at home and abroad
2.2 调研的关键问题
2.2.1 伦理委员会的监管问题 1)伦理委员会管理制度的法律法规包含层级设置调研结果如图1所示,对于伦理委员会管理制度的法律法规应包含的层级,首先业界对于《药品注册管理办法》[2]以及《药物临床试验质量管理规范》[3]寄予厚望,高达98.33%的被调研人员选择了包含此层级。目前《药品注册管理办法》[2]中在“临床试验”的相关章节明确了“伦理审查”是药物临床试验开展的必要条件。《药物临床试验质量管理规范》是临床试验实施重要的规范,最新出台的2020年版《药物临床试验质量管理规范》[3]中对伦理委员会有单独章节的规定,相较于《药品注册管理办法》更加细化,对伦理审查工作更具有指导意义。

图1 关于伦理委员会管理制度的法律法规包含层级设置问卷调研结果分析Figure 1 Results of questionnaire survey on the legal and regulatory levels of management systems of Ethics Committees
其次,85%的被调研人员认为《中华人民共和国药品管理法》应对伦理委员会管理制度进行明确。2019年新版《中华人民共和国药品管理法》[4]中在“药品研制和注册”章节,增加的新条款中进一步强调了开展临床试验必须通过伦理审查,并且对伦理委员会开展伦理审查的原则和职责做了阐述。在法律层面上进一步提高了伦理委员会在药品临床试验中的重要作用及定位。同时,80.42%的被调研人员希望国家药品监督管理局颁布伦理委员会管理制度相关的技术指南。
2)关于伦理审查的监管部门的调研结果如图2所示,针对“临床试验的伦理审查是否有必要由药品监管部门进行统一监管”这一问题,约85.83%的被调研人员认为非常和比较必要。基于我国目前药物临床试验管理以及伦理委员会多为机构伦理委员会的现实情况,由药监部门统一负责伦理委员会的监管,从操作上很难实现。该题目支持“统一监管”的比例较高,体现了被调研人员对伦理委员会监管的一致性和有序性的期待。

图2 药物临床试验的伦理审查是否有必要由药品监管部门进行统一监管问卷调研结果分布Figure 2 Results of questionaire survey on whether ethical review of drug clinical trials should be conducted by the drug regulatory authority
3)针对“药品监管部门对药物临床试验伦理审查的监管内容”问题,调研结果如图3所示,选择药品监管机构应当对伦理委员会的首次伦理审查、日常工作、过程审查、试验结束审查等进行监管的比例依次为83.33%,70.83%,63.75%及61.25%。在分层分析中(见表3),监管机构人员、机构管理者和伦理委员会成员这3类人群,均认为对伦理委员会的日常监管应排在首位。目前药物临床试验的首次伦理审查是伦理委员会的重要职责及工作内容,药监部门基于对药物临床试验项目的监管,对伦理委员会的监管大多集中在此。对伦理委员会日常工作的监管目前更多由国家卫生健康委员会承担。
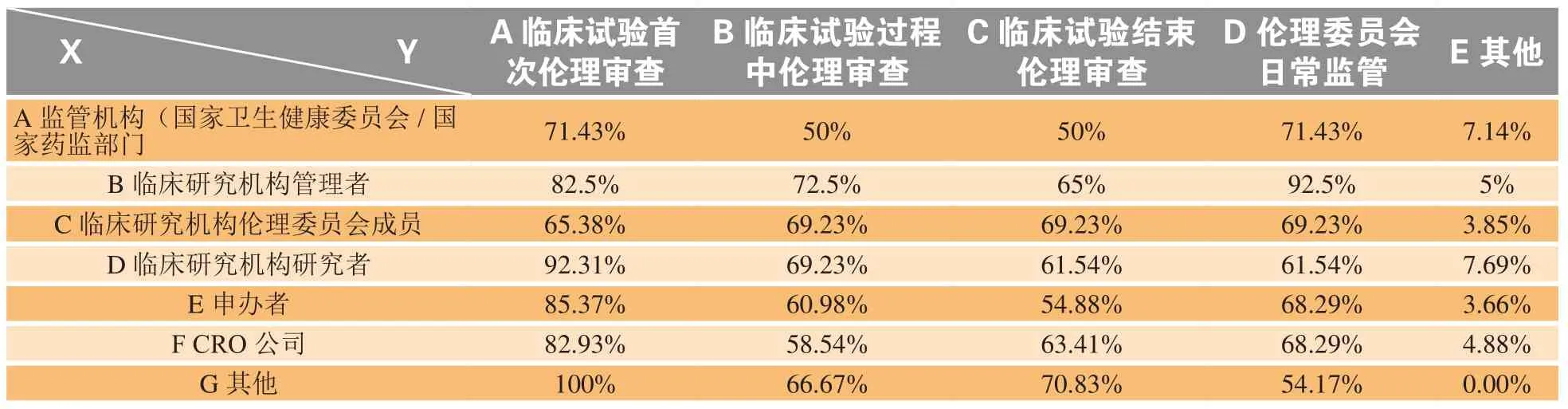
表3 关于药品监管部门对药物临床试验伦理审查的监管内容调研分层分析Table 3 A hierarchical analysis of the regulated items by drug regulatory authority in the ethical review of drug clinical trials

图3 药品监管部门对药物临床试验伦理审查的监管内容问卷调研结果分析Figure 3 Results of the questionnaire survey of drug regulatory authority over the regulated items in drug clinical trial ethics review
2.2.2 影响伦理审查的“质量”因素 1)伦理审查的原则,国家卫生健康委员会颁布的2016版《涉及人的生物医学研究伦理审查办法》[5](以下简称《办法》)中规定的伦理审查原则为:知情同意原则、控制风险原则、免费和补偿原则、保护隐私原则、依法赔偿原则和特殊保护原则,共计6条。关于伦理审查原则的调研结果如图4所示,现《办法》中的6条原则均依次排在前8位,在一定程度上说明了我国目前确定的伦理审查原则符合当前伦理审查工作的实际情况和需求,具有科学性与合理性。现有《办法》中未包含的“审查的独立性和公正性”在调研结果中排第3位,说明当下业界对伦理审查“独立性和公正性”的重视和关注。“独立性和公正性”是国际上的伦理原则之一(如《贝尔蒙报告》[6]),这一原则在新版《中华人民共和国药品管理法》[2]中已经得以体现。现有《办法》中未包含的“尊重权利和福利”的原则在调研结果中排在第5位,这一原则也是国际医学科学组织理事会(Council for International Organizations of Medical Sciences,CIOMS)的伦理原则之一。
2)伦理审查独立性:①关于我国伦理审查独立性现状的调研结果如图5所示,约65%的被调研人员认为我国伦理委员会充分做到和基本做到了审查独立性;近35%的被调研人员认为距离审查独立性有一定差距、有较大差距以及没有做到审查独立性。
从分层分析来看,各类人群对此题的选择比例分布与整体分布基本相似,说明并没有因为身份不同而对审查独立性的评价不同。
通过本题的调研结果看出,仍有近35%的被调研人员认为距离审查独立性有一定差距、有较大差距以及没有做到审查独立性。结合“伦理审查原则”题目中“审查独立性和公正性”的高比例,进一步印证了审查独立性在伦理审查中的重要性。
②关于如何保障我国伦理审查的独立性调研结果如图6所示,被调研人员整体上认为加大公开透明力度,对伦理委员会组成成员、审查程序、审查结果公开;加强伦理委员会组成成员的构成管理;通过组织独立性来实现审查独立性;加强伦理委员会利益冲突管理等都是保证伦理审查的独立性的重要措施。其中“加大公开透明力度”的比例最高,达86.67%。

图6 关于如何保障我国伦理审查独立性问卷结果分析Figure 6 Results of the questionnaire on how to guarantee the independence of ethical review in China
在伦理委员会成员中的调研结果稍有区别(见图7),92.31%的伦理委员会成员认为组织独立性更加有利于保证审查的独立性,其次依次为加强成员构成管理、加强利益冲突管理,反而加大公开透明力度的比例较低。

图7 伦理委员会成员关于如何保障我国伦理审查独立性问题的问卷结果分析Figure 7 Results of the questionnaire for Ethics Committee members on how to ensure the independence of ethical review in China
与伦理委员会成员的结果相比,监管机构人员/申办者/CRO/临床机构管理者/研究者则均认为加大公开透明力度是最有利的措施。
3)伦理审查标准:①关于我国伦理审查标准一致性现状的调研结果如图8所示,“非常一致”和“比较一致”总和为28%,基本一致的有41%,“不太一致”和“非常不一致”达31%。
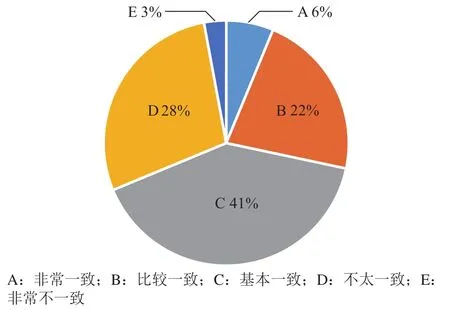
图8 关于我国伦理审查标准是否一致问题问卷结果分析Figure 8 Results of questionnaire survey on the consistency of the Chinese ethical review standards
②关于如何提高我国伦理审查标准的一致性调研结果如图9所示,在法律法规、指导原则中进一步细化伦理审查的标准、通过行业的力量形成审查的共识以及加强审查能力建设均对保证伦理审查标准的一致性发挥积极作用。

图9 关于如何提高我国伦理审查标准一致性的问卷结果分析Figure 9 Results of the questionnaire on how to improve the consistency of China's ethical review standards
其中监管机构人员更倾向于从法律法规的层面明确伦理审查标准,伦理委员会成员则认为通过行业共识更有用,但均认为同时加强伦理委员会审查能力也十分重要。从申办者和CRO的角度,相比于通过提升审查能力的间接手段更倾向于通过法律法规和行业共识细化和明确审查标准的直接手段。
4)伦理审查能力:①关于我国伦理审查能力的现状的调研结果如图10所示,“非常均衡”和“比较均衡”占比为21%,认为“基本均衡”者26%,认为“比较不均衡”和“非常不均衡”达到53%。若此题为评分题,则整体对审查能力的评价是偏“不均衡”的,即低于中位数。

图10 关于我国各临床机构伦理委员会的审查能力是否均衡的问卷结果分析Figure 10 Results of the questionnaire on whether the review capabilities of the Ethics committee of various clinical institutions in China are balanced
②关于如何提高我国伦理审查能力的调研结果如图11所示,法律法规层面对伦理委员会成员的能力提出明确要求是最为直接的方式,也是被调研人员最希望的方式。其次分别为:从法律法规层面对培训提出明确要求、通过第三方行业认证以及建立投诉机制。通过鼓励开展国际多中心试验,给伦理委员会带来挑战的同时,也促进其学习和成长,需要一定的时间过程。其中有4人给出了其他意见包括:鼓励进行行业讨论与交流、建立相关处罚机制、提高伦理审查收费的合理性、提高伦理委员的专业素养和水平。

图11 关于如何提高我国伦理审查能力的问卷结果分析Figure 11 Results of the questionnaire on how to improve China's ethical review ability
针对如何提高我国伦理审查能力的分层分析中(见表4),监管部门人员认为建立投诉机制比其他做法更为有力,比例最高,达85.71%;与监管部门人员的看法类似,申办者和CRO公司人员也认为建立投诉机制的重要性不亚于在法律法规层面的进一步规范;机构管理者则更希望通过对伦理委员会成员培训的方法来促进审查能力的提升。

表4 针对如何提高我国伦理审查能力分层分析Table 4 A hierarchical analysis of how to improve the ability of ethical review in China
5)创新药的伦理审查针对同类首创药(first in class)的首次伦理审查,关于是否有必要建立伦理委员会与药品审评部门的联合审查机制的问题,调研结果如图12所示:近86%的被调研人员认为是非常必要和比较必要的,通过建立伦理委员会与药品审评部门的联合审查机制,以实时互通伦理审查及药品审评的信息,进而提高伦理审查及药品审评的质量和效率。
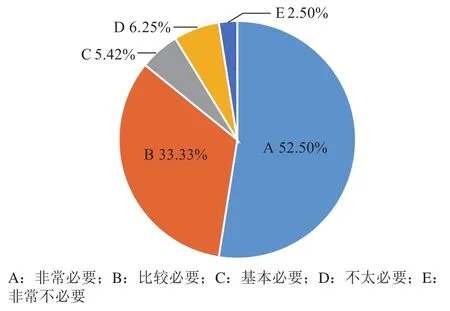
图12 关于是否有必要建立伦理委员会与药品审评部门的联合审查机制问卷结果分析Figure 12 Results of the questionnaire on whether it is necessary to establish a mechanism of joint review by the Ethics Committee and the drug review department
在分层分析中(见表5),针对是否有必要建立伦理委员会与药品审评部门的联合审查机制问题,被调研对象选择“非常必要”和“比较必要”的比例有一定的差异:监管部门人员约为57%,临床研究机构管理者、临床研究机构伦理委员会成员及申办者三者均在85%左右,CRO公司约为90%,临床机构的研究者则为100%。对于首创药,研究机构特别是研究者更加希望建立联合审查机制,通过及时获知审评部门的审评信息,进而控制创新药风险。
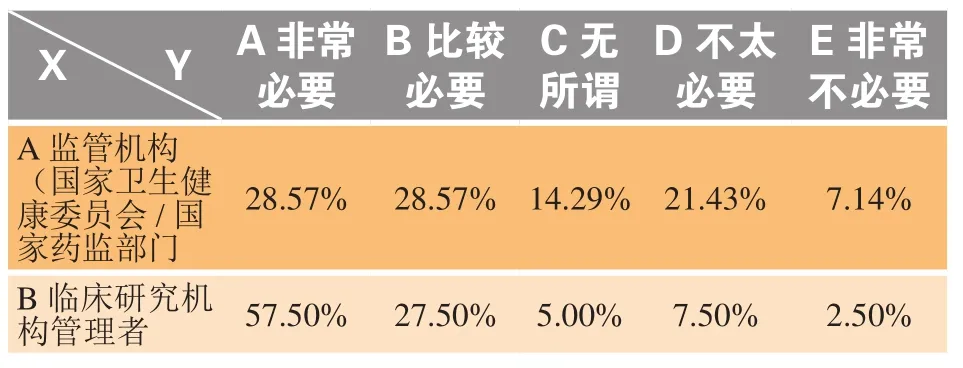
表5 关于是否有必要建立伦理委员会与药品审评部门的联合审查机制的分层分析Table 5 A hierarchical analysis on whether it is necessary to establish a mechanism of joint review by the Ethics Committee and the drug review department
2.2.3 影响伦理审查的“效率”因素 1)关于伦理审查效率的现状的调研结果如图13所示,认为存在问题的人员比例近91%(包含认为存在十分突出问题、存在比较突出问题以及存在一些问题)。
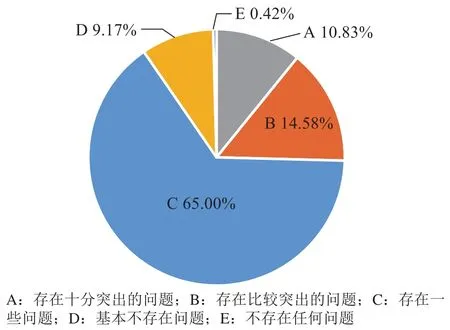
图13 关于我国多中心临床试验的伦理审查效率方面是否存在问题的问卷结果分析Figure 13 Results of questionnaires on the efficiency of ethical review of multi-center clinical trials in China

续表5
2)关于如何提高多中心临床试验的伦理审查效率,从上题可知,被调研人员认为我国伦理审查效率存在比较突出的问题。“伦理审查效率”并非某个机构伦理委员会的问题,而是多中心临床试验中,各参与机构伦理重复审查带来的效率问题。针对“如何提高多中心临床试验的伦理审查效率”问题的调研结果如图14所示,其中,85.42%的被调研人员希望通过建立多种协作互认的方式提高多中心临床试验中的伦理审查效率;实现多中心临床试验的伦理审查协作互认方式,与组长单位审查能力的权威性和可信度有关,这一选项的比例达到了79.17%;其次,76.67%的被调研人员希望在区域范围内通过互认实现伦理审查效率的提升;61.67%的被调研人员希望通过制定申办者与机构的合同模板,加快合同签署流程。其他的建议包括完备伦理审查的递交方案等资料;各伦理委员会对外公布本委员会的伦理审查实施细则或者审查要点指南,便于申办者做好准备、签订多中心临床试验伦理审查的协作分工协议等。

图14 关于如何提高多中心临床试验的伦理审查效率问卷结果分析Figure 14 Results of a questionnaire on how to improve the efficiency of ethical review of multi-center clinical trials in China
3)区域伦理委员会的职责及组建单位 ①关于区域伦理委员会的职责的调研结果如图15所示,被调研人员对于区域伦理委员会承担“组长单位”角色,起到提高伦理审查效率的作用,抱有很大期待,83.75%的被调研人员选择了此项。其次希望区域伦理委员会能够向区域内的机构伦理委员会提供咨询、培训等服务占83.33%,组织建立区域内伦理审查工作规范和技术标准占80.83%,接受申办者/CRO的伦理咨询/伦理审查的委托占80.42%,接受不具备伦理审查条件的机构委托的伦理审查占72.08%。

图15 关于我国区域伦理委员应承担职责问卷结果分析Figure 15 Results of the questionnaire on the responsibilities of China's regional Ethics Committee
②区域伦理委员会的组建单位的调研结果如图16所示,79.17%的被调研人员认为区域伦理委员会的组建单位应当是具备资质的现有机构伦理委员会,63.33%的被调研人员希望国家卫生管理部门统一建立区域伦理委员会,62.92%的被调研人员认为可通过独立第三方成立非商业性区域伦理委员,还有30.83%的被调研人员认为可通过独立第三方成立商业性的区域伦理委员会。
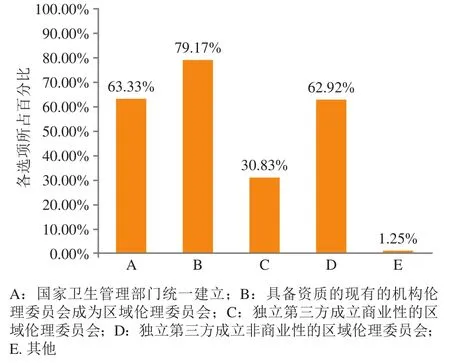
图16 关于我国区域伦理委员会组建单位问卷结果分析Figure 16 Results of the questionnaire on institutions establishing regional Ethics Committees in China
2.2.4 首次伦理审查与临床试验申请审评的顺序 调研结果如图17所示,关于伦理审查与临床试验申请审评的顺序问题,56.25%的被调研人员认为平行审查(伦理审查与药品审评平行开展,2个批件都获得之后方可实施临床试验)更加合理。

图17 关于首次伦理审查与临床试验申请审评的顺序问卷结果分析Figure 17 Results of the questionnaire on the sequence of the first ethical review and clinical trial application review
3 结语与展望
我国的伦理委员会从1988年起至今,在保障受试者的权益方面发挥了重要的作用,其立法体系、机构设置、审查程序和监督管理等方面都在不断趋于完善和成熟,但是面对创新研发的新需求,仍存在着不少问题需要进一步完善。
基于我国伦理委员会管理制度的现状,本研究主要围绕“伦理委员会法律法规层级的设置、伦理审查原则、伦理审查独立性、伦理审查标准、伦理审查能力、伦理审查效率、区域伦理委员会、伦理审查顺序、创新药的伦理审查以及伦理委员会的监管”10个方面展开问卷调研,通过问卷调研的分析结果可以看出,被调研人员普遍认为我国“以药品注册为目的”的伦理审查在伦理审查原则、伦理审查独立性、伦理审查标准、伦理审查能力、审查效率以及伦理委员会的监管等方面均存在不同程度的问题,需要进一步改进和完善;基于此调研分析结果,本研究后续将从我国伦理委员会的伦理审查质量、审查效率、首次伦理审查与临床审评的顺序、创新药的伦理审查和伦理委员会的监管等方面进一步提出完善建议。
致谢:本文来自亦弘商学院组织开展的“我国伦理委员会管理制度研究”课题。本调研问卷是在对4位业界资深专家进行访谈的基础上,进一步研究制定。在此,特别感谢参与专家访谈的各位专家:陈锐博士,北京协和医院临床药理研究中心I期病房负责人;赵耐青教授,缔脉生物医药(上海)有限公司首席科学家,生物统计副总裁,复旦大学生物统计学教授,博士生导师(已退休);王筱宏女士,北京大学第三医院伦理委员会副主任委员;黄毅慧女士,江苏恒瑞医药股份有限公司临床运营副总经理。同时,由衷感谢研究期间课题支持单位及业界专家同仁给予的大力支持。
