骨与软组织肿瘤二代测序中国专家共识(2021年版)
2021-12-01中国抗癌协会肉瘤专业委员会
中国抗癌协会肉瘤专业委员会
骨与软组织肿瘤属于罕见肿瘤,恶性骨肿瘤仅占所有恶性肿瘤的0.2%,软组织肉瘤在成人恶性实体瘤中所占比例也不足1%[1-3]。由于该病亚型众多,且肉瘤性病变恶性程度高、预后差,给临床诊治带来巨大挑战[4-6]。近年来,骨与软组织肿瘤的分子遗传学发展十分迅速,不仅在临床病理诊断中起着非常重要的作用,而且在协助临床制定治疗策略和预测生物学行为等方面也具有重要价值[6-7]。随着新的分子检测手段的开展和应用,基于特定基因异常的新病种也在不断涌现,以往一些分化不明或未分化的肿瘤经过分子检测也得到了重新认识,骨与软组织肿瘤分类的基础正在从形态学分类转向分子分类。
二代基因测序(next-generation sequencing,NGS)能一次对几十万至几百万条DNA 序列片段/读长进行测序分析,从而识别基因变异,目前已广泛应用于肿瘤的分子诊断、靶向基因筛选以及表观遗传学分析等领域。近年来,国内外已发表了多个NGS 检测技术指南,如《二代测序诊断指南》《基于二代测序的肿瘤panels 验证指南》等,但上述指南通常以检验科室的技术参数标准为主,尚缺乏可指导NGS 检测在骨与软组织肿瘤临床诊疗路径中的应用共识。因此,由中国抗癌协会肉瘤专业委员会牵头,组织行业内资深专家共同商讨并撰写了本共识,旨在规范NGS 检测在骨与软组织肿瘤领域内的应用,更好地服务于临床诊治,使患者受益。
1 骨与软组织肿瘤的诊断
骨与软组织肿瘤的病理诊断目前仍基于传统的形态学观察,辅以免疫组织化学(immunohistochemistry,IHC)标记。近年来,广泛开展的荧光原位杂交(fluorescencein situhybridization,FISH)和基因突变检测(一代测序)为骨与软组织肿瘤的病理诊断提供了极大帮助,部分通过细胞和分子遗传学研究发现的基因变异也已成为广泛应用的分子诊断指标,如采用FISH 检测滑膜肉瘤中的SS18基因易位、尤文肉瘤中的EWSR1基因易位以及高分化和去分化脂肪肉瘤中的MDM2、CDK4基因扩增等;采用一代测序检测胃肠道间质瘤中的KIT/PDGFRA基因突变、侵袭性纤维瘤病中的CTNNB1基因突变、梭形细胞/硬化性横纹肌肉瘤中的MYOD1基因突变以及骨巨细胞瘤中的H3F3A基因突变等[6,8-9]。随着分子检测技术的不断开展和推广,以NGS 为代表的新型检测技术在骨与软组织肿瘤的诊治和预后判断中将会发挥越来越重要的作用[10]。
共识1:推荐常规病理学检查不能明确诊断的骨与软组织肿瘤患者进行NGS 检测
临床实践中,部分骨与软组织肿瘤难以通过IHC、FISH 等常规病理检查确诊,此时需要借助NGS 检测来鉴别是否存在分子遗传学异常,从而辅助病理诊断。如既往诊断的骨与软组织小圆细胞未分化肉瘤中一些类型经NGS 检测发现分别存在CIC基因重排、BCOR-CCNB基因融合以及BCOR-内部串联重复(internal tandem duplications,ITD)突变,根据相对特异性的分子遗传学改变,正式命名为CIC重排肉瘤和伴有BCOR遗传学改变肉瘤[11-12]。一些共表达CD34和S-100 蛋白的梭形细胞肿瘤,因形态和免疫表型有重叠,通过常规病理学手段难以做出十分明确的诊断,但通过NGS 检测发现这些非常相似的肿瘤分别发生了NTRK1/2/3、BRAF、RAF1和RET等基因重排[13],可采用基因名称进行命名诊断,如NTRK重排梭形细胞肿瘤、BRAF重排梭形细胞肿瘤、RAF1重排梭形细胞肿瘤或RET重排梭形细胞肿瘤等。此外,对于基因突变不明的病例,NGS 检测效率明显优于多个探针的FISH 检测。推荐采用NGS 检测辅助病理诊断的骨与软组织肿瘤类型见表1,其中一些病变类型为新近报道的病种,如GLI1遗传学改变的恶性上皮样肿瘤[14],有待更多的病例积累。

表1 常规病理学手段难以明确诊断需要进行NGS 检测的骨与软组织肿瘤
需要说明的是,尽管NGS 检测基本涵盖所有的分子改变,但并非所有的辅助病理诊断和适合靶向治疗的骨与软组织肿瘤均需要进行NGS 检测。一些肿瘤类型中的分子异常可通过常规的分子检测进行诊断,如骨巨细胞瘤中的H3F3A基因突变、胃肠道间质瘤中的KIT、PDGFRA基因突变和侵袭性纤维瘤病中的CTNNB1基因突变等目前仍以一代测序为主;非典型性脂肪瘤样肿瘤/高分化脂肪肉瘤/去分化脂肪肉瘤中的MDM2、CDK4基因扩增和炎性肌纤维母细胞瘤中的ALK基因重排可通过FISH 检测进行辅助诊断和指导靶向治疗。此外,对于一些通过常规光镜观察或IHC 检测可确诊的肿瘤类型,虽涉及有靶标的分子改变,但无需再进行分子检测,如隆突性皮肤纤维肉瘤和腺泡状软组织肉瘤可通过常规病理确诊,无需进行PDGFB、TFE3基因重排加以验证;TFE3IHC 标记阴性(排除TFE3重排型)的血管周上皮样细胞肿瘤(perivascular epithelioid cell tumors,PEComa)无需进行TSC1/2基因突变检测;形态典型的上皮样肉瘤在INI1(SMARCB1)IHC 标记获得确诊后无需进行SMARCB1基因突变或缺失检测。
共识2:推荐常规分子学检测结果为阴性的骨与软组织肿瘤患者使用(DNA+RNA)NGS 技术或平台进行复检
传统基因检测方法因实用性高和单次检测成本较低而广泛应用于临床,但也存在一些技术缺陷和临床应用局限(表2)[15-16]。相比之下,NGS 检测在技术和临床诊疗中具有一定优势:1)可以同时涵盖数百个基因,检测范围更广;2)同时检测所有位点的多种变异类型,避免遗漏某些变异类型,可为初诊患者提供完整的精准分型及治疗策略指导;3)可以评估肿瘤突变负荷(tumor mutation burden,TMB)和微卫星不稳定性(microsatellite instability,MSI)等免疫治疗相关的分子标志物[17-18];4)避免单基因检测带来的样本耗竭和时间延误,可以快速地为后续评估提供依据。因此,建议传统检测为阴性的样本使用NGS 复检。当患者出现疾病进展时,可再次进行全面的基因检测,有助于发现潜在的耐药机制和新的标靶,为下一步治疗方案的选择提供依据。
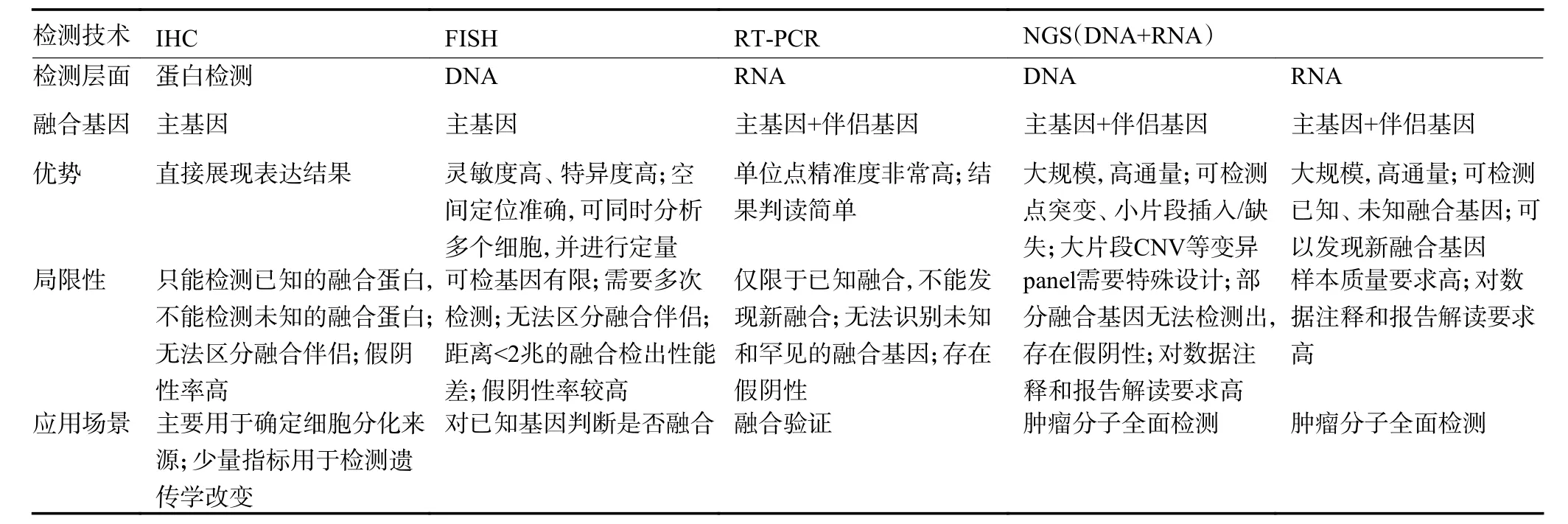
表2 临床检测技术的全面对比
基因融合是骨与软组织肿瘤常见的变异形式。在目前报道的近10 000 个基因融合中,约90%通过NGS 方法鉴定,包括DNA 测序(DNA-seq)和RNA测序(RNA-seq)。越来越多的研究表明,RNA-seq 是DNA-seq 的补充,能检测到DNA-seq 未检测到的融合[19]。原因可能在于:1)基因内含子序列冗长和存在重复序列,DNA 探针难以全面覆盖;2)携带融合变异的肿瘤细胞占比低,低于检测DNA 的灵敏度;3)复杂的转录或转录后的剪接加工过程可能会影响基因组融合/重排的真实性[20-22]。因此,推荐使用DNA-seq 联合RNA-seq 的技术进行复检。
共识3:推荐常规分子学检测与NGS 检测有差异的骨与软组织肿瘤患者,考虑第3 种检测进行验证
在分子病理学诊断过程中,会出现常规分子学检测与NGS 检测结果不一致的情况,如FISH 检测某种基因重排阴性但经NGS 检测发现有涉及该基因的融合基因,或涉及其他少见的融合基因亚型;FISH 检测某基因重排阳性但NGS 未检出相对应的融合基因,此时可采用逆转录聚合酶链反应(reverse transcriptionpolymerase chain reaction,RT-PCR)等第3 种检测技术进行验证,或送至其他权威机构进行复检,比对检测结果,以达到精准诊断的目的。
2 骨与软组织肿瘤的治疗
2.1 靶向治疗
共识4:推荐考虑接受特异性靶向治疗的骨与软组织肿瘤患者,通过NGS 技术或平台验证靶向药物相关的基因或潜在基因
恶性骨与软组织肿瘤化疗进展后治疗手段较局限,近年来靶向药物的疗效逐步在肉瘤的临床试验与实践中得到了验证,部分药物获批适应证,部分药物被指南推荐,部分药物仍在临床试验阶段。靶向治疗通常用于不可切除或晚期骨与软组织肿瘤的二线治疗,但特定的靶向药物可以考虑用于特定类型不可切除或晚期骨与软组织肿瘤的一线治疗。目前,可以使进展期患者获益的靶向药物见表3[23-31]。

表3 靶向药物临床试验结果分析
鉴于肉瘤病理的复杂性,临床在使用此类特异性的靶向药物之前有必要行NGS 检测进行靶点基因验证,如NTRK 抑制剂被批准应用于NTRK基因融合的肉瘤[23,32];EZH2 抑制剂被批准应用于上皮样肉瘤,在其他INI1基因缺失的肉瘤临床试验中也取得一定疗效[25,33];CDK4/6 抑制剂在去分化脂肪肉瘤临床试验中取得了一定疗效[26-27];ALK 抑制剂可用于ALK融合阳性的炎性肌纤维母细胞瘤[28];PDGFR 抑制剂对隆突性皮肤纤维肉瘤有效[34]。
此外,抗血管多靶点类药物的靶点主要为血管内皮生长因子受体(vascular endothelial growth factor receptor,VEGFR)及其他酪氨酸激酶。在骨与软组织肿瘤中,如安罗替尼已获得中国国家药品监督管理局(NMPA)批准,帕唑帕尼获得美国食品药品监督管理局(FDA)批准,瑞戈非尼用于非特异性组织学亚型软组织肉瘤(非脂肪肉瘤)获得《NCCN 软组织肉瘤临床实践指南》推荐[6];重组人血管内皮抑制素获得《2018CSCO 经典型骨肉瘤诊疗指南》推荐。目前尚未有直接证据显示VEGFR 等基因状态与治疗效果有明确的关系,故采用此类治疗方案可以不进行NGS检测。
对于无有效或者更好治疗手段的进展期肉瘤患者,可尝试通过NGS 检测寻找潜在的药物靶点,在取得患者明确知情同意后,可以采用药品说明书中未明确但具有循证医学证据对靶点阳性的患者进行治疗。
2.2 免疫治疗
共识5:推荐进展期骨与软组织肿瘤患者,分别采用IHC 和NGS 检测程序性死亡因子配体1(programmed death-ligand 1,PD-L1)、MSI、TMB 等免疫治疗相关分子标志物,根据结果辅助免疫治疗
随着免疫检查点抑制剂在多种肿瘤中被证实有效,免疫治疗在软组织肉瘤中的应用也日益得到重视。一项关于晚期骨与软组织肉瘤的亚型扩展试验发现,帕博利珠单抗治疗未分化多形性肉瘤和去分化脂肪肉瘤的ORR 分别达到23%和10%,提示帕博利珠单抗在未分化多形性肉瘤治疗方面具有一定临床疗效[35]。纳武利尤单抗单用治疗转移性肉瘤的ORR 仅为5%,但联用伊匹单抗后ORR 增至16%,提示纳武利尤单抗联合伊匹单抗可能在某些肉瘤亚型治疗方面具有一定潜力[36]。而寻找合适的分子标志物有助于指导分子亚型分类,筛选优势人群,从而使肉瘤免疫治疗更加精准。
目前,临床常用的免疫检查点抑制剂生物标志物包括PD-L1 高表达、错配修复基因缺陷(mismatch repair-deficient,dMMR)/微卫星高度不稳定性(microsatellite instability-high,MSI-H)和高肿瘤突变负荷(tumor mutation burden-high,TMB-H)。PD-L1 仅在部分肿瘤适应证中作为使用特定药物的临床分子标志物,在SARC-028 研究中,PD-L1 的表达与PD-1 单抗治疗软组织肉瘤的疗效之间也没有明确的关系[35,37]。dMMR/MSI-H、TMB-H 是获得FDA 批准、不限组织学类型的免疫治疗生物标志物[38-40],具有此类改变的患者将有可能从免疫治疗中获益。骨与软组织肿瘤中位TMB 偏低(<5 mutations/mb)[41],但仍有约5% 肉瘤患者具有高TMB(TMB ≥10 mutations/mb),且分布于多个亚型中[42]。MSI-H 在肉瘤患者中的发生频率非常低(0.78%)[43],对肉瘤免疫治疗的指导意义尚需大规模、前瞻性的研究证实。结合临床实际情况,对进展期骨与软组织肿瘤患者,可采用NGS 大panel(>300 基因)检测MSI、TMB 等免疫治疗相关的分子标志物,部分患者可参考检测结果选择免疫治疗。难以获取即时标本的进展期患者,应慎重选择既往样本的检测结果作为参考。
2.3 临床试验
共识6:推荐既往治疗失败且无有效替代方案的骨与软组织肿瘤患者进行NGS 检测,以寻找匹配的临床试验机会
目前,靶向或免疫治疗在骨与软组织肿瘤中的应用较为有限。除骨巨细胞瘤、胃肠道间质瘤和炎性肌纤维母细胞瘤等,其余多数肿瘤的靶向或免疫治疗仍处于临床试验阶段。对于无标准治疗的进展期肉瘤患者,可尝试通过NGS 检测寻找潜在的药物靶点,靶点阳性但无相应药物适应证的患者可能获得参加临床试验的机会。目前,正在进行临床试验的药物包括MDM2 抑制剂(milademetan)、CDK4/6 抑制剂(palbociclib、abemaciclib)、mTOR 抑制剂(sirolimus)、PARP 抑制剂(olaparib、niraparib、talazoparib)、EZH2 抑制剂(tazemetostat)等。随着新的临床试验不断开展,患者可能得到更多的治疗机会。
3 NGS 检测样本类型和流程规范
共识7:骨与软组织肿瘤的NGS 样本采集应符合规范要求
NGS 分析的样本类型可优选新鲜组织样本,也可选用甲醛固定-石蜡包埋(formalin-fixed paraffinembedded,FFPE)样本等[44]。
手术和活检的新鲜组织:手术采集的组织质量应≥50 mg,穿刺样本≥2 条,长度≥0.5 cm。新鲜样本理想保存方式为术后30 min 内,迅速置于液氮中保存,或采用磷酸盐缓冲溶液或生理盐水清洗干净后,置于-80℃冰箱保存。也可组织离体后30 min 内浸入足量的10%中性福尔马林保存液中固定(组织与浸泡液体大小比例为1∶10),避免使用酸性及含有重金属离子的固定液,72 h 内寄送至检测实验室。可采用冷冻切片染色评估样本中的肿瘤细胞含量。送检新鲜组织必须确保足够病理诊断,应在明确需求下进行NGS检测。
FFPE 样本:按病理规范要求取材,NGS 检测前应先进行苏木精-伊红染色,评估肿瘤细胞的含量。一般情况下,适合NGS 检测的组织肿瘤细胞含量应>20%,坏死细胞含量<10%。组织样本量应满足NGS 检测的基本需求,一般石蜡切检规格建议厚度5~10 μm,每片组织面积>5 mm×5 mm,以保证获得足够的DNA 或RNA,但具体条件可依据不同检测项目而定。酸脱钙处理过的石蜡组织样本不建议进行NGS 检测,如含骨组织制备的石蜡组织样本。骨肿瘤的过度酸处理会造成组织和细胞抗原成分的破坏和丢失,影响IHC 染色效果[45],同时对核酸总量及完整性造成不同程度的影响[46]。建议该类样本脱钙处理前,采集周围不需要进行脱钙处理的疑似肿瘤组织;对需要进行脱钙处理的肿瘤组织,可分别采用常规脱钙(用于常规病理诊断)和乙二胺四乙酸(EDTA)处理(备用分子检测)两种手段同时进行。
样本质量对检测结果和分析至关重要,样本运送过程要确保各类样本运送安全、无污染、无降解[47]。
共识8:骨与软组织肿瘤的NGS 生物信息学分析应符合规范要求,配备完善的标准分析及质量控制流程
NGS 数据的生物信息分析应包括原始测序数据的质控(如涵盖Q30 等FASTQ 质量参数),数据过滤及质控(引物序列去除、接头序列去除、低质量序列去除等,重要参考指标包括过滤后数据Q30),序列比对及质控(DNA、RNA 需分别选用合适的比对软件和参考基因组,质控指标包括比对至参考基因组的比例等),样本测序质控(DNA 应包含panel 的覆盖深度、靶向区域覆盖度、插入片段长度等重要参数,RNA 应包含靶向区域测序reads 总量等重要参数),以及变异的鉴定分析、注释和筛选。针对不同类型的变异,如DNA层面的碱基替换、插入/缺失、拷贝数变异、MSI、TMB 及RNA 层面的基因融合、外显子跳读等,采用特定的生物信息学方法进行分析,并通过适量例数的标准品和临床样本进行能力验证,应符合国家卫生健康委临床检验中心的高通量测序检验生物信息学分析能力要求,保证分析流程的准确性和稳定性。送检样本及全部测序和分析报告流程应符合《临床分子病理实验室二代基因测序检测专家共识》《二代测序技术在肿瘤精准医学诊疗中的应用专家共识》等共识的基本要求[44,47-50]。
NGS 检测也存在一定局限性:1)NGS 检测在某些特殊序列区域检出敏感性下降或存在假阳性的可能;2)在DNA 层面拷贝数变异检出水平有限,在RNA 层面受RNA 质量影响较大,且扩增法测序容易污染等。此外,临床工作中也应特别注意NGS panel 的检测范围。
共识9:推荐有美国病理学家协会(CAP)/美国临床实验室改进法案修正案(CLIA)/中国合格评定国家认可委员会(CNAS)认证或认可的实验室进行NGS检测
NGS 实验室建设应符合《NGS 实验室建设标准与要求》的相关规定,以“工作有序、互不干扰、防止污染、报告及时”为基本原则进行实验室分区[44]。NGS检测的实验室建议包括8 大实验区域,分别为试剂准备区、标本与文库制备区、DNA 打断区、杂交捕获区(扩增一区)、文库扩增区(扩增二区)、文库检测区、测序区、电泳区。实验室应做好分析前(标本采集、运送和保存、处理及病理质控)、分析中(室内质控)、分析后(结果报告解释及临床应用)全流程的质量控制。
推荐实验室获得CAP、CLIA 或CNAS 认证资质。NGS 临床实验室应每年参加由病理质控中心、国家卫生健康委临床检验中心、欧洲分子基因诊断质量联盟等权威机构组织的基因检测能力评估,以证实实验室质量管理体系符合标准。
4 NGS 检测报告的临床解读
共识10:倡导各单位组建分子肿瘤专家委员会(molecular tumor boards,MTB),依据国内外专家共识及解读流程,正确解读NGS 检测结果,制定精准诊疗方案
1 份标准的肿瘤NGS 基因检测报告分为4 个部分内容:1)基本信息,包含患者姓名、样本类型、病理信息、临床信息、检测项目和日期等;2)基因检测结果,清晰呈现本次检测结果,便于阅读;3)变异注释和临床解读,对变异形式进行致病性或功能影响分析,说明其与病理诊断、预后判断和治疗的关系,根据指南与共识列出可能的临床治疗方案与用药指导建议;4)附录,包含质控信息、检测方法、检测范围、检测试剂、检测局限性、基因列表和参考文献等。
与传统检测技术相比,NGS 检测复杂性较高,且报告信息庞杂,给临床数据解读造成一定困难。应依据美国分子病理学会、美国临床肿瘤学会、CAP 共识Standards and Guidelines for the Interpretation and Reporting of Sequence Variants in Cancer、《临床分子病理实验室二代基因测序检测专家共识》以及美国医学遗传学和基因组学学院推荐的胚系突变解读流程[51-52],从体细胞变异分级注释及临床解读、胚系突变分级注释及临床解读、可报告范围和质量控制等方面梳理NGS 报告的核心解读逻辑,以提升临床专家NGS报告解读能力,快速抓取关键信息,使患者临床获益,同时尽可能地避免过度解读对临床造成的潜在影响。
为更好地解决NGS 检测结果难题,可以组建由肿瘤、病理、分子生物、生物信息等多个领域专家组成的MTB,以讨论分子生物学相关证据,优化患者的个体化诊疗方案,从而建立基于分子标志物检测的临床治疗路径。骨与软组织肿瘤由于其复杂多样的类型、治疗的多样性以及患者对保留功能和生存质量的需求,使得多学科综合治疗的需求更为迫切。骨与软组织肿瘤-MTB 应基于入组患者的病理学和基因突变信息、肿瘤标本的病理学特征、先前的治疗方案,以及跟踪情况制定具体的治疗推荐和方案,应包括与患者基因突变信息匹配的获批药物、跨适应证用药和相应临床研究等,为患者带来临床生存获益。相信未来在NGS和MTB 的普及下,精准的检测和全面的临床讨论将为骨与软组织肿瘤患者带来新希望(表4)。

表4 骨与软组织肿瘤二代测序中国专家共识要点

表4 骨与软组织肿瘤二代测序中国专家共识要点 (续表4)
5 结语与展望
与其他实体肿瘤相比,骨与软组织肿瘤的诊断和治疗更具挑战性,且药物开发进展缓慢,复发难治性骨与软组织肿瘤的药物选择更为有限,大多数尚处于临床试验阶段。NGS 技术的规范应用将为骨与软组织肿瘤患者个体精准诊疗奠定基础。相信随着科学技术的进一步发展,相关管理监督机制的日臻完善,NGS的临床实践将会越来越规范化,也将在骨与软组织肿瘤临床诊疗中发挥更加重要的作用。
专家共识委员会
指导专家组成员
蔡建强 中国医学科学院肿瘤医院
蔡郑东 上海市第一人民医院
郭 卫 北京大学人民医院
黎志宏 中南大学湘雅二医院
林建华 福建医科大学第一医院
李建民 山东大学齐鲁医院
牛晓辉 北京积水潭医院
沈靖南 中山大学附属第一医院
吴苏稼 东部战区总医院
肖建如 海军军医大学第二附属医院
叶招明 浙江大学医学院附属第二医院
张伟滨 上海交通大学医学院附属瑞金医院
执笔人
华莹奇 上海市第一人民医院
王 坚 复旦大学附属肿瘤医院
陈 静 华中科技大学同济医学院附属协和医院
刘巍峰 北京积水潭医院
周宇红 复旦大学附属中山医院
杨吉龙 天津医科大学肿瘤医院
徐海荣 北京积水潭医院
张红英 四川大学华西医院
张 星 中山大学肿瘤防治中心
共同制定专家组成员(按姓氏汉语拼音排序)
陈 勇 复旦大学附属肿瘤医院
胡 勇 安徽医科大学第一附属医院
黄 钢 湖南省肿瘤医院
江仁兵 新疆医科大学附属肿瘤医院
李茹恬 南京鼓楼医院
商冠宁 中国医科大学附属盛京医院
宋 超 转化医学与创新药物国家重点实验室
田 征 新疆医科大学第一附属医院
王 芬 中山大学附属第一医院
王守丰 南京鼓楼医院
王志才 江苏省肿瘤医院
韦永中 江苏省人民医院
吴勇军 湘潭市第一人民医院
严望军 复旦大学附属肿瘤医院
杨团民 西安市红会医院
喻 林 复旦大学附属肿瘤医院
岳 斌 青岛大学附属医院
张红梅 第四军医大学西京医院
张 鹏 河南省肿瘤医院
张晓晶 辽宁省肿瘤医院
周晓燕 复旦大学附属肿瘤医院
邹昌业 中山大学附属第一医院
审核小组
中国抗癌协会肉瘤专业委员会放化疗学组
中国抗癌协会肉瘤专业委员会病理学组
中国抗癌协会肉瘤专业委员会基础研究与转化学组
