珊瑚姜油对黑素瘤WM35细胞增殖及凋亡的影响
2021-11-30罗娇卢玲罗竹林张晓英曹煜
罗娇 卢玲 罗竹林 张晓英 曹煜



【摘要】目的 研究珊瑚姜油(Zingiber corallinum oil,ZCO)对人黑色素瘤WM35细胞增殖及凋亡的影响,并探讨其作用机制。方法 不同浓度(2.5-40mg/L)ZCO体外作用于人黑素瘤WM35细胞。采用CCK-8法检测细胞活力; 免疫荧光染色观察细胞形态变化;比色法测Caspase-3酶活性;RT-qPCR检测Bax/BcL-2 表达水平;流式细胞仪检测细胞凋亡及周期。结果 ZCO以时间-剂量依赖性方式抑制黑素瘤WM35细胞株增殖,镜下可见典型细胞凋亡形态,Caspase-3酶活性呈剂量依赖性增加。随着ZCO药物浓度增加,Bax mRNA表达上调,而BcL-2 mRNA表达下调,细胞周期被阻滞在G1期,G2/M期及S期细胞数减少。结论 ZCO对人黑素瘤WM35细胞增殖具有抑制作用,其机制可能与上调Bax及下调BcL-2表达有关,并使细胞周期阻滞在G1期,同时,Caspase-3作为凋亡途径的终末关键酶也参与其中。
【关键词】珊瑚姜油;WM35;增殖;凋亡
【中图分类号】R453 【文献标识码】A 【文章编号】2026-5328(2021)07-009-03
黑色素瘤(melanoma)又称为恶性黑色素瘤,是一种能产生黑色素的高度恶性肿瘤,其特点为恶性程度高,转移发生早,死亡率高[1]。近年来,黑素瘤发病率呈逐年上升趋势,但目前的治疗方法在提高病人的生存率上作用有限。珊瑚姜是中国的传统苗药之一,通过超临界二氧化碳法从珊瑚姜中提取ZCO,近几年研究显示,ZCO具有抗细菌、真菌、杀虫、抗氧化等活性[2,3]。吴春维等人发现ZCO对HeLa细胞具有抑制其增殖并促凋亡作用,但是ZCO是否会影响黑素瘤WM35细胞的增殖和凋亡仍不清楚。本实验主要研究ZCO对WM35细胞增殖的抑制及凋亡的影响,探讨其作用机制,为ZCO治疗人黑色素瘤提供实验依据和理论基础。
1 材料与方法
1.1实验材料及试剂 ZCO(贵阳舒美达药厂)DMSO溶解后过滤除菌备用;WM35细胞(上海一研生物科技有限公司),CCK-8(日本同仁化学)、青链霉素双抗、RPMI1640(贵州泰思腾生物科技有限公司),胎牛血清(杭州四季青有限公司),AnnexinⅤ-FITC/PI凋亡试剂盒及周期试剂盒(上海贝博生物),caspase-3检测试剂盒(南京建成生物工程研究所),Bax/BcL-2引物(上海生工生物工程有限公司)。
1.2方法
1.2.1细胞培养 WM35细胞用RPMI1640完全培养基培养(含10%胎牛血清+1%青链霉素双抗), 置于37℃,5%CO2的培养箱中培养,0.25 %胰酶消化传代,取对数生长期的细胞进行实验。
1.2.2细胞毒性检测 离心收集对数生长期细胞,参考涂云华等人方法[4],调整细胞密度为1.2×105个/ml后接种于96孔板,0.05ml/孔,培养24h后,实验组加入ZCO,补足培养基至总体积为0.1ml/孔,使药物终浓度分别为2.5、5、10、20、40mg/L;设对照组,每一浓度均设6个复孔,CO2培养箱中继续培养24h、48h及72h,培养结束的1.5h前,每孔加入10L CCK-8溶液,继续培养,酶标仪测定波长为450nm时吸光度(OD)值。
1.2.3细胞形态观察 调整细胞密度为1.1×104个/ml,接种至6孔板,培养12小时后,加入ZCO,使其终浓度为2.5、10、40mg/L,设空白对照,培养48h后,经过AO/EB染色,倒置显微镜观察细胞形态。
1.2.4Caspase-3酶活性 离心收集细胞,每两百万细胞加入50ul裂解液的比例加入裂解液,12000g离心15min,吸取上清,按试剂盒步骤加入试剂,37℃孵育4h,酶标仪检测(波长为405nm)吸光度。Caspase-3活化程度=实验组A405/正常对照A405。
1.2.5RT-PCR测Bcl-2/Bax mRNA表达水平 Trizol提取WM35细胞总RNA,逆转录成cDNA,实验方法参考涂云华等人[12]。引物设计:Bax(sense5'-TCAGGATGCGTCCACCAAGAA -3',antisense5'-TGTCCACGGCGGCAATCA -3')及BcL-2(sense5'-ATGGGATCGTTGCCTTATGC -3',antisense5'-TCAGTCTACTTCCTCTGTGGATGTTG -3'),内参:GAPDH(sense5'-TGGACCTGACCTGCCGT-3',antisense5'-AGGAGTGGGTGTCGCTGTTGA-3'),按照SYBR Green/ROX qPCR Master Mix步驟操作。反应条件: ①BcL-2: 95℃预变性10min, 95℃变性15s,60℃退火30s, 72℃ 延伸30s, 40个循环, 最后延伸72℃10min;②Bax: 58℃退火。计算值=2-[(药物组目的基因CT值-药物组管家基因CT值)-(细胞对照组目的基因CT值-细胞对照组管家基因CT值)]。
1.2.6细胞凋亡及周期检测 取对数生长期细胞,调整细胞密度为1.5×105/ml,药物浓度设置同1.2.3,培养48h后,调整细胞密度为2.5×106/ml,参考Wu J等人实验方法[5],细胞固定,AnnexinV-FITC/PI染色后按周期试剂盒染色,BD FACSCalibur流式细胞仪测定细胞凋亡及周期。
1.3统计学处理 采用Graphpad prism 7.0进行统计分析,结果以均数±标准差表示,组间比较采用单因素方差分析,以P<0.05为有统计学差异。
2 结果
2.1细胞毒性检测 随着ZCO浓度增加,WM35细胞OD值逐渐降低,其作用方式呈时间-剂量依赖性,尤其对培养48h的WM35细胞增殖速度减慢最为明显。
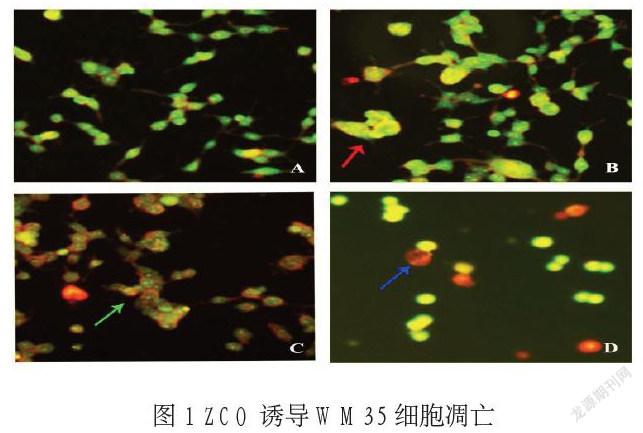
2.2细胞形态 正常黑素瘤WM35细胞贴壁生长,呈多角形及不规则形(如图A)。ZCO处理后,细胞生长变慢,胞质间隙增大;AO/EB染色后,随浓度升高,黄绿色荧光逐渐减少,而红色荧光逐渐增多,细胞变成圆形或椭圆形;可见数量不等的漂浮细胞及细胞碎片(如图B、C、D)。
A正常对照组;B,C,D分别为2.5、10、40mg/L的ZCO处理WM35细胞(×100)
2.3 Caspase-3酶活性 运用0-40mg/L的ZCO作用于WM35细胞,结果显示:随着药物浓度增加,Caspase-3酶活性随之增强,当药物浓度达到40mg/L时,酶活性达到最大(p<0.05)。
2.4Bax/BcL-2 mRNA表达 低浓度至高浓度ZCO作用WM35细胞48h,Bax/BcL-2 mRNA比值升高,其作用方式呈剂量依赖性。
* vs对照组,P<0.05
2.5细胞凋亡 ZCO作用WM35细胞48h后,细胞出现不同程度的凋亡,由低浓度至高浓度,凋亡逐渐增加,尤其以早期凋亡较为明显。
A为对照组,B、C、D药物浓度分别为2.5、10、40mg/L
2.6细胞周期变化 ZCO作用WM35细胞48h,随药物浓度增加,G2期细胞逐渐减少,细胞被阻滞在G2期。
3 讨论
珊瑚姜可作药和食两用,具有广泛的药理活性,且毒性小等优点,在治疗肿瘤方面的研究报道较少。
本实验采用不同剂量的ZCO作用于WM35细胞,结果显示, ZCO对WM35细胞的生长具有抑制作用, 随着药物浓度的增加, 抑制作用明显增强,呈现时间-剂量依赖性,且当药物作用48h,抑制作用最为明显。吖啶橙透过正常细胞膜,使细胞核呈绿色或黄绿色荧光,其使凋亡细胞染上致密浓染的黄绿色荧光或黄绿色碎片颗粒;而坏死细胞黄色荧光减弱甚至消失[6]。本实验中,ZCO由低浓度至高浓度,黄绿色荧光逐渐减少,而红色荧光逐渐增多,细胞呈圆形或椭圆形,可见数量不等的漂浮细胞与细胞碎片。流式细胞仪检测结果显示,随药物浓度增加凋亡程度逐渐明显。
Caspase-3最主要的底物是多聚聚合酶PARP(poly(ADP-ribose) polymerase),该酶与DNA修复、基因完整性监护有关[7]。在细胞凋亡启动时,116kD的PARP在Asp216-Gly217之间被Caspase-3剪切成31kD和85kD两个片段,使PARP中与DNA结合的两个锌指结构与羧基端的催化区域分离,不能发挥正常功能[8]。本实验结果显示,随着药物浓度增加,Caspase-3酶活性逐渐增强,呈时间-剂量依耐性,从而证实了Caspase-3参与ZCO诱导细胞凋亡过程。
細胞凋亡的两个进化保守信号转导途径中,BcL-2家族成员的构成比例是凋亡调控的关键因素,尤其是BcL-2/Bax比率是启动细胞凋亡的“分子开关”[9]。本实验中,随着药物浓度增加, Bax/BcL-2的比值逐渐增加,说明ZCO通过使凋亡相关基因Bax表达上调,使BcL-2表达下调而使肿瘤细胞发生凋亡。
细胞周期是指从一次细胞分裂形成子细胞开始到下一次细胞分裂形成子细胞为止所经历的过程,分为间期与分裂期两个阶段,间期又分为三期即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期),当细胞周期发生紊乱时,细胞出现恶性增殖,导致肿瘤的发生。本实验显示,随着ZCO浓度增加,G2期细胞数减少,细胞周期阻滞在G2期,防止其向G2/M期转换,阻断了细胞的有丝分裂,从而对WM35细胞起到增殖抑制作用。
总之, ZCO可抑制WM35细胞增殖,其机制是通过激活凋亡途径关键酶,使凋亡相关基因Bax表达上调,Bcl-2表达下调,细胞周期阻滞在G2期,最终阻止肿瘤细胞的增殖与分化。
参考文献:
[1] Lens M B, Dawes M. Global perspectives of contemporary epidemiological trends of cutaneous malignant melanoma[J]. British Journal of Dermatology,2004,150(2):179-185.
[2] Dank G, Rassnick K M, Sokolovsky Y, et al. Use of adjuvant carboplatin for treatment of dogs with oral malignant melanoma following surgical excision.[J]. Veterinary & Comparative Oncology,2014,12(1):78-84.
[3] Yang Z, Luo S, Peng Q, et al. GC-MS Analysis of the Essential Oil of Coral Ginger (Zingiber corallinum Hance) Rrhizome Obtained by Supercritical Fluid Extraction and Steam Distillation Extraction[J]. Chromatographia,2009,69(7-8):785-790.
[4] 涂云华,康颖倩,周英,等. 姜黄挥发油对THP-1细胞增殖及凋亡的影响[J]. 山东大学学报(医学版),2015,05期(5):46-51.
[5] Wu J, Nie X. Effect of Oxymatrine on Cell Proliferation,Apoptosis,Cell Cycle and ERK1 Expression of the Fibroblasts Derived from Hypertrophic Scar and Keloids[J]. Chinese Journal of Minimally Invasive Surgery,2011,11(3):259-263.
[6] Cao X, Wang A H, Jiao R Z, et al. Surfactin Induces Apoptosis and G2/M Arrest in Human Breast Cancer MCF-7 Cells Through Cell Cycle Factor Regulation[J]. Cell Biochemistry & Biophysics,2009,55(3):163-171.
[7] Pierre Olivier H, Raphaël D, Christiane D, et al. Ursolic acid induces apoptosis through mitochondrial intrinsic pathway and caspase-3 activation in M4Beu melanoma cells[J]. International Journal of Cancer,2005,114(1):1-11.
[8] Fossey S L, Bear M D, Lin J, et al. The novel curcumin analog FLLL32 decreases STAT3 DNA binding activity and expression, and induces apoptosis in osteosarcoma cell lines[J]. Bmc Cancer,2011,11(7):1240.
[9] 王衛东,陈正堂. Bcl-2/Bax比率与细胞“命运”[J]. 中国肿瘤生物治疗杂志,2007,04期:393-396.
基金项目:贵阳市科技局科技创新平台项目[筑科合同(2012303)号];
作者简介:罗娇(1988-),女,硕士研究生,主管药师,药物的基础研究及合理运用。
