国外短缺药品定义及对我国的启示
2021-11-28陈琳宁丁锦希姚雪芳高雪
陈琳宁 丁锦希 姚雪芳 高雪


摘 要:[目的]研究国外短缺药品定义的信息过滤等作用,为完善我国药品供应保障体系提供参考。[方法]研究域外15个短缺药品定义,结合供应保障系统分析内涵,并勾画了定义在药品供应保障系统中的联动角色。[结果]国外短缺药品定义主要包括供不应求、获批上市、短缺时间、临床必需、不可替代性四项内涵,我国短缺药品定义已基本包括以上内涵,但在信息过滤方面还有可完善之处。[结论]建议在短缺药品定义中明确短缺时间,强化各地政府管理职责,加强短缺信息互通。
关键词:短缺药品;药品供应保障;定义与内涵
中图分类号:F74 文献标识码:Adoi:10.19311/j.cnki.1672-3198.2021.36.014
《“健康中国2030”规划纲要》中提出“强化短缺药品供应保障和预警,完善药品储备制度和应急供应机制”。近年来,国家高度重视短缺药品供应保障工作,推进多项短缺政策,并取得了积极成效。2020年4月,国家卫生健康委发布《关于印发国家短缺药品清单管理办法(试行)的通知》,首次明确界定了我国短缺药品定义,是完善我国短缺药品供应保障体系的重大发展。
为深入理解我国短缺药品定义的作用,本文通过查询域外短缺药品的定义,分析其内涵和实操价值,为我国短缺药品供应保障系统提出完善建议。
1 短缺药品内涵界定的必要性
准确识别短缺药品,可以将不同短缺情形与对应的保障措施联动。2016年,世界卫生组织(WHO)发现,定义混淆是降低短缺药品报告精准性的重要原因,各国的短缺药品定义有所不同,给综合研究及大数据分析带来困难。有文献提出,由于报告者对短缺药品的定义理解不同,上报信息的真实性、准确性需要核査研判,增加了信息处理部门对“真假短缺”的识别难度。清晰的短缺药品定义有助于多源信息平台发挥作用,排除干扰信息,找准短缺原因和施策对象,促进短缺解决。
2国外短缺药品内涵分析
2.1 国际组织
为设定具有参考价值、可联动防控措施的短缺药品定义,WHO分析了全球56个短缺药品定义,最后得出结论,药品从生产到患者手中涉及多方,在供应链中不同位置的理解也不同,决定从供应端和需求端两侧来描述短缺药品。
上述强调了药品“供不应求”的前提是已上市状态,与研发药品区分,与产品供给相对应,类似于其他商品“缺货”的定义。由于这种区分有利于药品研发注册和生产销售职责分属两个或多个部门的协作运行,大部分国家也有此规定。
2.2 典型国家监管部门及法律
目前,对短缺药品有清晰界定的国家主要是美国、欧洲等国家,具体如表2所示。
2.2.1 美国短缺药品定义
美国短缺药品定义明确了“不可替代或不可完全替代”“临床必需”的内涵,FDA首先将药品属性限定为医疗必需品:用于治疗或预防严重疾病的药品;进而要求药品不可替代,或无充足替代品。WHO提出短缺药品的必需性应由当地卫生系统认定,在FDA所给定义中体现为,仅当临床不可替代的医疗必需品短缺时国家会积极处理,使机构在能力和资源有限时,集中力量解决影响范围更广、更紧急、公共健康风险更大的药品短缺。值得注意的是,严格限制短缺药品界定,将使大部分的药品缺货由市场来消化,带来一定健康风险。
此外,FDA会处理未在美国上市,但为医学必需品且已在国外销售多年的药品短缺问题。同样的,法国ANSM为满足本国没有上市药物的需求,会通过合法程序进口相关药物。因此,与国际组织不同,FDA和ANSM认为临床必需药品不能满足国内需求,就应被视为短缺药品。
2.2.2 欧洲国家短缺药品定义
欧洲部分国家强调了短缺药品应是“不可替代或不可完全替代”,如法国和德国,大多数国家则认定可替代的缺貨药品也是短缺药品。2018年欧盟调查显示,18个成员国会提供短缺药品的可替代信息,一是替代品可能影响患者治疗进程、效果、增加用药风险等,Becker等指出,使用替代药物治疗会增加34.8%的风险药毒性;二是会增加医务人员的工作量,Pauwels调研发现,药剂师每周平均有12.8小时花在跟踪短缺药品,寻找和购买替代药物上;三是可能加重卫生支出负担,为购买短缺药品的替代制剂,美国每年花费约2.16亿美元。因此,尽管有替代制剂,缺货药品仍需要恢复供应,也应视为短缺药品处理。
欧洲多个短缺药品定义有界定“短缺时间”。EMA将少于14天的供应延迟为缺货,药品连续缺货14天后才是短缺状态。德国和比利时均规定连续缺货14天的药品才能被界定为短缺药品。这个时间在法律中更加理论化,法国法律中为3天,比利时法律中为4天。欧洲药品法建立了药品停产报告制,要求药品短缺两个月前上报信息,给予监管机构应对药品短缺的主动权,具体到国家,挪威强制要求报告时间为2个月,希腊为3个月,意大利为2至4个月。
2.2.3 其他国家短缺药品定义
澳大利亚的短缺药品界定时间为6个月,药品停产报告时间为12个月。加拿大强制要求在药品停产前6个月报告,授权人在获批上市连续12个月未销售药品时需要通知授权部门,并在开始销售时报告。有类似规定的是希腊,为了使患者、医务人员等相关者清楚目前本国市场上有哪些药品,授权人需要告知药品的实际销售时间。
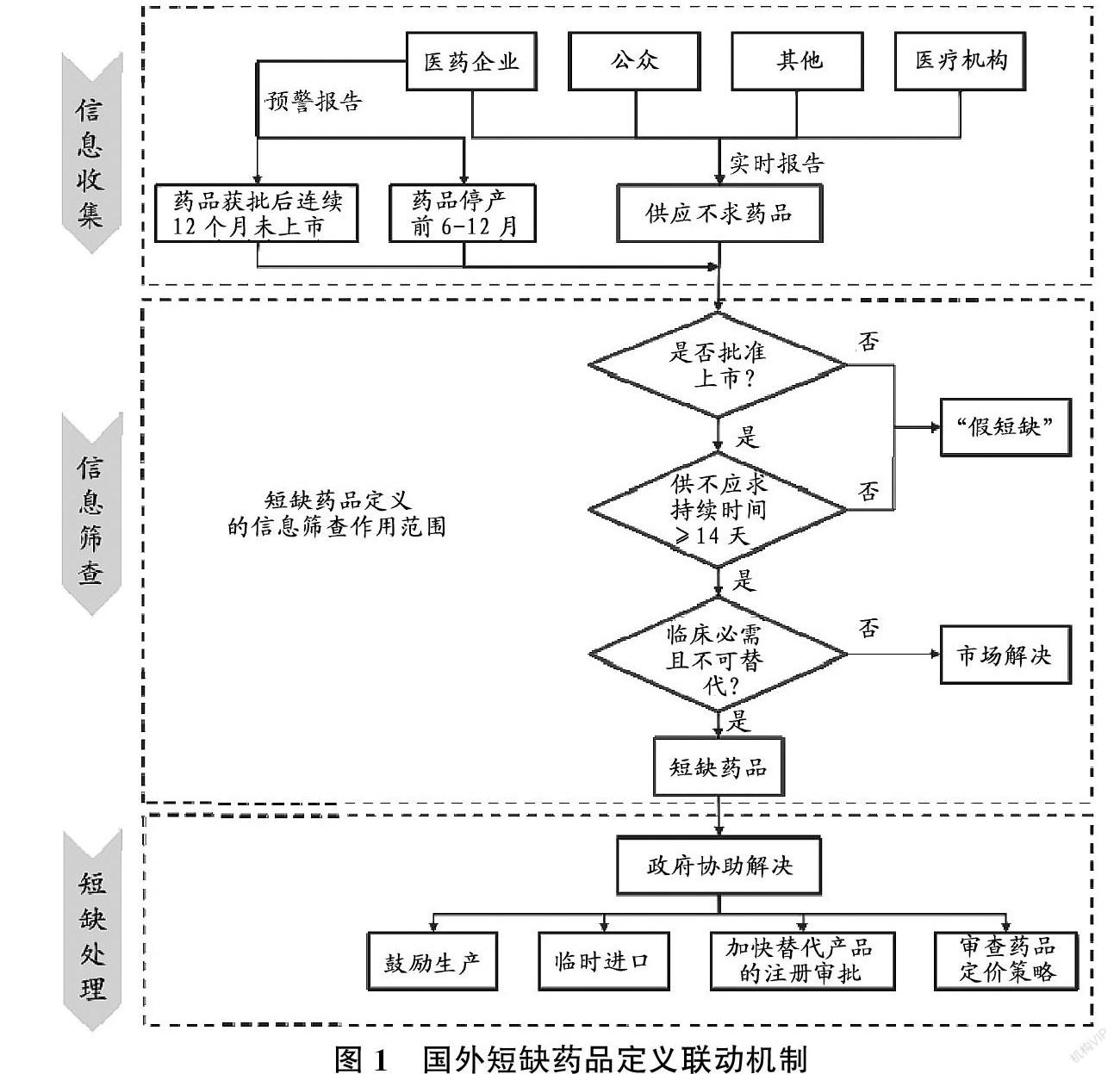
2.3 国外短缺药品定义联动机制
根据前述分析,可知国外短缺药品定义包括“供不应求”一项核心内涵,和“获批上市”“短缺时间”“临床必需”“不可替代或不可完全替代”四项辅助内涵,用于筛查短缺信息,搭建起明确的“信息收集-信息筛查-短缺处理”短缺药品供应保障框架。
(1)信息收集:预警报告(停产报告)和实时报告结合,确保潜在和正发生的药品短缺都有报告渠道。(2)信息筛查:本国上市药品在已缺货一段时间、临床必需且不可替代时被界定为短缺药品,政府主导解决。(3)短缺处理:包括鼓励生产、临时进口、加快可替代品的注册审批等。此外,短缺药品信息通常定期向社会公布,如德国会列表发布短缺药品清单,包括商品名、活性成分、短缺程度(时间和地域)、短缺原因、预计解决时间、可替代制剂等。
3 我国短缺药品定义
3.1 我国短缺药品定义内涵
《公立医疗卫生机构短缺药品管理指南(2018年版)》中规定指南适用范围是“临床必需且不可替代或者不可完全替代,因生产、流通、使用环节及其它因素导致的,在一定区域内不能满足临床当前或者预期用量需求,存在短缺风险的药品”。此定义包含供不应求、临床必需、不可替代性三项要素,并初步具有地域管理意识。2019年《医疗机构短缺药品分类分级与替代使用技术指南》中要求医疗机构将内部短缺药品按照6个月、3个月、1个月的短缺时间节点,分为一、二、三级,根据分级与可替代性,采取不同的信息报送、库存管理、采购策略。
2020年4月,《关于印发国家短缺药品清单管理办法(试行)的通知》中指出短缺药品,是经我国药品监督管理部门批准上市,临床必需且不可替代或者不可完全替代,在一定时间或一定区域内供应不足或不稳定的药品,进一步提出了地域区分短缺的概念。此外,《药品生产监督管理辦法》中要求列入国家实施停产报告的短缺药品,在计划停产6个月前报告。至此,我国在关于短缺药品政策中对短缺药品定义的全部内涵已均有提及。
3.2 我国短缺药品定义联动机制
前述文件中“一定时间或一定区域内”的表述不具备信息筛查功能,而时间分类局限于医疗机构,因此,目前国家层面短缺药品定义的内涵包括:供不应求、获批上市、临床必需、不可替代或不可完全替代四项。
在政策层面,我国短缺药品供应保障框架大致符合国际的共性操作。(1)信息收集:一方面以省为单位设置药品短缺监测哨点、建立医疗机构短缺药品信息直报系统,另一方面着手搭建国家短缺药品多源信息采集平台,实施停产报告制度。(2)信息筛查:已批准上市,临床必需且不可替代或者不可完全替代的药品供不应求时,即可被界定为短缺药品。在医疗机构内部,应根据短缺时间分级应对。(3)短缺处理:医疗机构可自主通过遴选替代、另寻采购渠道等方式缓解药品缺货;当医疗机构无法解决时,各省将调动药品储备、开展药价调查;若药品在多地缺货,持续时间长或反复,将被纳入国家短缺药品清单,或国家临床必需易短缺药品重点监测基础清单,在国家层面统筹解决。
4 国外短缺药品内涵及对我国的启示
我国对短缺药品的界定起步较晚,但已有重大发展,例如2018-2019年先后公示了二批临床急需境外新药,使其区别于上市后药品短缺,明确了解决此类药品需求的途径。但对比国外短缺药品定义的联动框架,我国短缺药品定义在信息筛查方面还有可细化完善之处。
4.1 明确“短缺时间”内涵
国家短缺药品多源信息采集平台需要更为明确的上报时间,使不同的报告人正确提供“真短缺”信息。了解短缺时间也是解决短缺的重要途径,如1个月的短缺,多是配送延迟、需求上涨引起,可通过调拨和增产解决;而长期、反复的短缺,可能更多归结于价格和利润的问题,需要政府主导保障。
4.2 强化各地政府管理职责
我国幅员辽阔,各地采购政策和用药习惯不同,药品短缺有明显的地域区别。因此小区域的药品短缺,本地负责处理速度更快,亦便于各地探索新的供应保障措施。我国“短缺药品信息直报系统”也以行政区域为划分,由辖区卫生健康部门管理。而针对长期,反复短缺的药品,再由国家层面统筹处理。
4.3 加强药品短缺信息互通
多源信息采集平台应接受来自生产企业、分销商、医疗机构、零售药店、患者等各方的报告,改变临床“末端发现”机制导致的被动应对。同时,有必要及时公开短缺信息,各方信息互通能降低大面积短缺的发生,加快短缺解决。
参考文献
[1]world Health Organization.Meeting report: Technical definitions of shortages and stockouts of medicines and vaccines[J].Geneva: World Health Organization,2016.
[2]黄润青,黄宁,郅元媛,等.我国短缺药品监测预警体系中的利益相关者分析[J].中国卫生政策研究,2018,11(09):49-52.
[3]How does FDA address shortages of medically necessary drugs that have not received FDA approval?[EB/OL].(2019-05-08)https://www.fda.gov/drugs/drug-shortages/frequently-asked-questions-about-drug-shortages.
[4]Gestion des ruptures de stock de medicaments intérêt thérapeutique majeur par lANSM[EB/OL].(2019-05-08)https://ansm.sante.fr/S-informer/Informations-de-securite-Ruptures-de-stock-des-medicaments.
[5]蔡文芳,杨才君,沈倩,等.国内外药品短缺问题研究进展[J].中国药事,2016,30(12):1190-1199.
[6]Pauwels K,Simoens S,Casteels M,et al.Insights into European drug shortages: a survey of hospital pharmacists[J].PloS one,2015,10(3).
