小檗碱对大鼠急性放射性肠炎的疗效及机制研究
2021-11-26王遥高颖陈海若井海亮李卓虹
王遥,高颖,陈海若,井海亮,李卓虹
成都中医药大学附属医院肿瘤科,成都 610072
放射性肠炎继发于小肠和(或)大肠辐射损伤,常见于胃肠道肿瘤、妇科肿瘤和泌尿系恶性肿瘤的放射治疗(简称放疗)中,以腹痛、肠出血、肠梗阻、肠穿孔、瘘管、吸收不良、直肠疼痛、继发于溃疡的直肠出血为主要临床表现[1],最常见的症状为伴或不伴有疼痛的腹泻。据报道,90%接受盆腔放疗的患者排便习惯会发生永久性改变[2],多达3/4的患者在接受盆腔放疗时会发生急性不良反应,常发生于放疗过程中或90 d内[3],而5%~55%的患者会发生慢性放射性肠炎。放疗相关毒性的防治和管理已成为临床亟待解决的难题。目前,放射性肠炎的治疗措施包括药物治疗、内镜治疗、高压氧治疗、手术治疗等,但缺乏临床研究数据证实其确切的疗效,且在预防放射性肠炎和治疗慢性症状方面效果不明显。因此,探索新的治疗药物和方式具有重要意义[3]。
黄连为毛莫科植物,其根茎为中药要药,性寒、味苦,具有清热燥湿、泻火解毒等功效。黄连的作用主要与根茎内含有的生物碱有关。小檗碱(Berberine)是从中草药黄连等小檗属植物中分离出的一种异喹啉生物碱,是黄连活性成分中最有价值的单体[4],具有多种药理作用,如抑制细菌和毒素[5]、抑制肠道分泌和蠕动、保护肠上皮屏障等,是治疗炎症性肠病的候选药物[6-7],但有关其治疗放射性肠炎的研究较少。有研究发现,小檗碱能够提高放化疗的疗效;临床研究发现,中药复方中应用黄连能明显减轻腹泻、便血、里急后重等症状。本研究旨在探讨小檗碱对大鼠急性放射性肠炎的疗效及可能机制,以期为放射性肠炎的治疗提供新的选择,也为小檗碱治疗放射性肠炎的机制研究提供参考。
1 材料与方法
1.1 主要试剂及仪器 HE染液套装(G1005)、Masson染液套装(G1006)购自武汉谷歌生物科技有限公司;超氧化物歧化酶(superoxide dismutase,SOD,E-BC-K020-M)、丙二醛(malondialdehyde,MDA,E-BC-K025-M)购自武汉伊莱瑞特生物科技股份有限公司;白细胞介素-6(interleukin-6,IL-6,EK206/3-96)、IL-1β(EK201B/3-96)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α,70-EK282/3-96)酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)试剂盒购自杭州联科生物技术有限公司;脂多糖(lipopolysaccharide,LPS,ml02242)ELISA试剂盒购自上海酶联生物科技有限公司;RNA提取液(Trizol,15596018)购自美国Invitrogen公司;人尿粪隐血测试盒(C027-1-1)购自南京建成生物工程研究所;小檗碱(2021003125)购自成都瑞芬思生物科技有限公司;地塞米松(LOT20235135)购自北京索莱宝科技有限公司;RPMI Medium 1640 basic(C11875500BT)购自美国Gibco公司;青链霉素双抗溶液(SV30010)购自美国Hyclone公司;反转录试剂盒(BL699A)购自合肥志宏生物技术有限公司;SYBR Green qPCR Mix试剂盒(BL698A)购自合肥志宏生物技术有限公司。台式高速冷冻离心机(Neofuge 15R)购自香港力康生物医疗科技控股有限公司;超声细胞粉碎机(JY92-Iin)购自宁波新芝生物科技有限公司;涡旋混合器(MX-F)购自美国赛洛杰克公司;全自动研磨仪(KH-Ⅲ)、匀浆仪(KZ-Ⅱ)购自武汉赛维尔生物科技有限公司;酶标检测仪(Epoch)购自美国BioTek公司;台式高速冷冻型微型离心机(D3024R)购自美国SCILOGEX公司;全自动医用PCR分析系统(SLAN-96S)购自上海宏石医疗科技有限公司;K2800核酸分析仪(K2800)购自北京凯奥科技发展有限公司;标准试剂型纯水仪(FBZ2001-up-p)购自青岛富勒姆科技有限公司;正置光学显微镜(Nikon Eclipse E100)购自日本尼康公司。
1.2 动物实验
1.2.1 实验动物及分组 健康成年SPF级雄性SD大鼠32只,体重200~220 g,由成都达硕科技生物有限公司提供[实验动物使用许可证号:SYXK(川)2020-199]。按照随机数字表法分为空白对照组、模型组、小檗碱组和地塞米松组,每组8只,随机编号称重。实验过程符合国家和单位有关实验动物的管理和使用规定。
1.2.2 急性放射性肠炎大鼠模型制备 各组大鼠照射前禁食12 h,使用10%水合氯醛腹腔麻醉,仰卧位固定,空白对照组给予伪照射,余各组给予全腹部(从剑突至耻骨联合)单次照射,其他部位用铅板屏蔽,源波距50 cm,皮下距点1.5 cm,照射时间3 min,总照射剂量12 Gy,所有电离辐射照射均在成都友谊医院放射医学研究所进行。照射后大鼠出现摄食、饮水量减少,体重下降,精神萎靡,蜷缩少动、稀便及血便,表明造模成功。地塞米松组给予地塞米松0.12 mg/(kg.d)灌胃,小檗碱组给予小檗碱50 mg/(kg.d)灌胃,空白对照组与模型组大鼠给予相同体积生理盐水灌胃。各组于照射后3 h开始行胃管灌胃,1次/d,连续7 d。末次给药后12 h腹主动脉取血保存血清,处死大鼠,取肠组织保存备用。
1.2.3 大鼠排便情况及体重测量 观察并记录给药期间各组大鼠的体重及排便情况,分别在实验第0、3、7天称取体重,运用人尿粪隐血试剂盒检测大便隐血情况,并按以下标准进行评分。阴性:3 min不显蓝绿色,评分为0分;弱阳性:30~60 s显蓝色,评分为1分;阳性:立即显蓝绿色,评分为2分;强阳性:肉眼可观察到血便,立即显深蓝色,评分为3分。
1.2.4 HE染色观察肠组织病理学变化 取2 cm结肠或直肠组织,用10%多聚甲醛溶液固定,4 ℃预冷的生理盐水洗净血液,石蜡包埋、切片,行HE染色,使用CaseViewer 2.2在不同倍数下观察肠组织病理变化,计数每个肠道截面的隐窝数量。
1.2.5 Masson染色观察肠组织胶原纤维沉积情况
将肠组织切片脱蜡,重铬酸钾染色水洗,铁苏木精染色水洗,磷钼酸浸染后直接入苯胺蓝染液染色,切片用1%冰醋酸分化,无水乙醇脱水后透明封片,使用显微镜镜检,采集图像分析。
1.2.6 ELISA检测肠组织LPS、TNF-α、IL-6、IL-1β含量 取肠组织,用9倍匀浆介质研磨,将研磨液以3000~4000 r/min离心10 min,离心半径为6 cm,取上清制备成10%组织匀浆,采用ELISA试剂盒检测LPS、TNF-α、IL-6、IL-1β含量,按照试剂盒说明书步骤操作。
1.2.7 肠组织SOD活性、MDA含量检测 取肠组织,用高速分散器匀浆,制备成10%组织匀浆,采用SOD、MDA试剂盒测定SOD活性(WST-1法)、MDA含量(TBA法),按照试剂盒说明书步骤操作。
1.3 细胞实验
1.3.1 含药血清制备 将各组大鼠腹主动脉血清样本静置4 h,低温离心(4 ℃,3000 r/min,离心半径6 cm),取血清,56 ℃水浴30 min灭活补体,0.22 μm滤膜过滤后密封分装,–20 ℃冻存备用。
1.3.2 细胞培养及处理 IEC-6细胞来源于ATCC CRL-1592,由上海酶研生物科技有限公司提供。将复苏的IEC-6细胞用含90% RPMI Medium 1640 basic、10% FBS、1%青链霉素双抗溶液的培养基于37 ℃、5% CO2、饱和湿度条件下培养,待细胞密度达到80%时进行传代,取对数生长期细胞进行实验。将细胞进行等量载体孵育后分为空白对照组、模型组、小檗碱组、地塞米松组。空白对照组仅接受伪照射;余各组接受12 Gy60Co γ射线照射3 min。各组细胞分别按照含药血清:培养基为1:10的比例加入对应的含药血清,并于24、48 h测量细胞色素C Bax、Bcl-2、caspase-3 mRNA表达水平。
1.3.3 实时荧光定量PCR(quantitative Real-time PCR,qPCR)检测各组细胞色素C、Bax、Bcl-2、caspase-3 mRNA表达水平 参照RNA提取试剂盒说明书提取各组RNA,利用反转录试剂盒分别将2 μg总RNA反转录为cDNA。利用SYBR Green qPCR Mix试剂盒检测细胞色素C、Bax、Bcl-2、caspase-3 mRNA表达水平,按照试剂盒说明书步骤操作。实验重复3次。引物由上海生工生物工程股份有限公司合成,引物序列如表1所示。

表1 qPCR引物序列Tab.1 Primer sequence for qPCR
1.4 统计学处理 采用GraphPad Prism软件进行统计分析。定量数据以表示,多组间比较采用单因素方差分析(ANOVA),进一步两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠排便及体重变化情况 空白对照组大鼠大便正常,大便含血得分为0分。造模各组大鼠均出现不同程度的稀便或血便,模型组大鼠血便最严重,造模后即出现黏液便、稀烂血便,人尿粪隐血试剂盒检测显示大便含血得分为(1.88±0.30)分;地塞米松组血便较轻,人尿粪隐血试剂盒检测显示大便含血得分为(1.00±0.27)分;小檗碱组血便最轻,人尿粪隐血试剂盒检测显示大便含血得分为(0.75±0.25)分。各组大鼠第0天体重差异无统计学意义(P<0.05)。模型组大鼠第3、7天出现体重下降(P<0.05);地塞米松组第7天体重较模型组明显下降(P<0.05);小檗碱组第3、7天体重高于地塞米松组和模型组(P<0.05)(表2)。
表2 各组大鼠体重变化情况(g,±s,n=8)Tab.2 Changes in body weight of rats in each group (g, ±s,n=8)
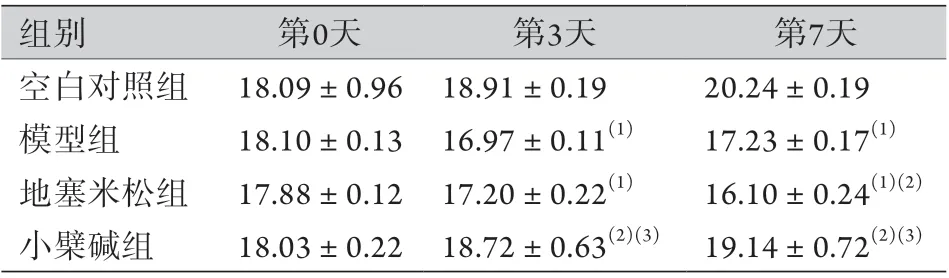
表2 各组大鼠体重变化情况(g,±s,n=8)Tab.2 Changes in body weight of rats in each group (g, ±s,n=8)
组别 第0天 第3天 第7天空白对照组 18.09±0.96 18.91±0.19 20.24±0.19模型组 18.10±0.13 16.97±0.11(1) 17.23±0.17(1)地塞米松组 17.88±0.12 17.20±0.22(1) 16.10±0.24(1)(2)小檗碱组 18.03±0.22 18.72±0.63(2)(3) 19.14±0.72(2)(3)
2.2 各组大鼠肠组织病理学变化 HE染色结果显示,空白对照组大鼠肠道黏膜完整,各层结构清晰,未见充血水肿;模型组出现不同程度的肠道结构破坏,可见黏膜上皮细胞坏死脱落、隐窝受损、糜烂形成;地塞米松组肠腔内见脱落细胞团块;小檗碱组见轻微黏膜上皮细胞坏死脱落,未见明显病理损伤改变(图1)。

图1 各组大鼠肠组织病理学变化(HE ×100)Fig.1 Histopathological changes of rats' intestinal tissues in each group (HE ×100)
2.3 各组大鼠肠组织胶原纤维变化 Masson染色
与空白对照组比较,(1)P<0.05;与模型组比较,(2)P<0.05;与地塞米松组比较,(3)P<0.05。结果显示,空白对照组大鼠肠组织正常,无明显胶原增生;模型组大鼠肠组织黏膜下层出现胶原纤维增生;与模型组比较,地塞米松组和小檗碱组胶原纤维增生明显减少,且小檗碱组胶原纤维增生明显少于地塞米松组(图2)。
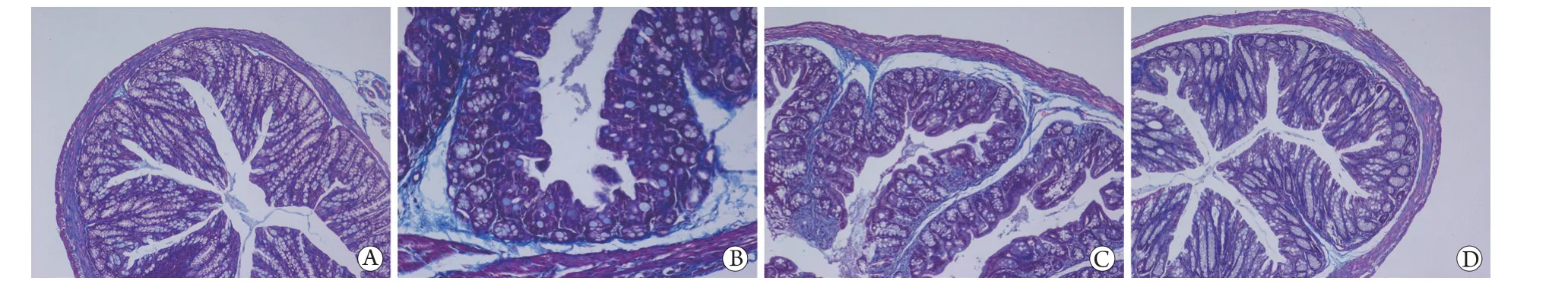
图2 各组大鼠肠组织胶原纤维变化(Masson ×100)Fig.2 Changes of collagen fibers in intestinal tissues of rats in each group (Masson ×100)
2.4 各组大鼠肠道隐窝数量比较 与空白对照组[(183.67±2.6)个]比较,模型组[(115.67±1.45)个]、地塞米松组[(148.33±3.76)个]、小檗碱组[(173.67±2.33)个]肠道隐窝数量减少,差异有统计学意义(P<0.05);与模型组比较,地塞米松组、小檗碱组肠道隐窝数量明显增多,差异有统计学意义(P<0.01);与地塞米松组比较,小檗碱组肠道隐窝数量明显增多,差异有统计学意义(P<0.01)。
2.5 各组大鼠肠组织炎性因子水平、SOD活性、MDA含量比较 ELISA检测结果显示,与空白对照组比较,模型组大鼠肠组织IL-6、TNF-α、IL-1β、LPS水平明显升高(P<0.05),地塞米松组大鼠肠组织IL-6水平升高(P<0.05);与模型组比较,小檗碱组大鼠肠组织IL-6、TNF-α、IL-1β、LPS水平明显降低(P<0.05),地塞米松组大鼠肠组织IL-6水平升高、IL-1β水平降低(P<0.05);与地塞米松组比较,小檗碱组大鼠肠组织IL-6水平明显降低(P<0.05)(表3)。
与空白对照组比较,模型组大鼠肠组织MDA含量升高、SOD活性降低(P<0.05);与模型组比较,小檗碱组和地塞米松组MDA含量降低、SOD活性升高(P<0.05);与地塞米松组比较,小檗碱组MDA含量降低(P<0.05)(表3)。
表3 各组大鼠肠组织炎性因子水平、SOD活性及MDA含量比较(±s,n=8)Tab.3 Comparison of inflammatory factor level, SOD activity and MDA content in intestinal tissues of rats in each group (±s,n=8)

表3 各组大鼠肠组织炎性因子水平、SOD活性及MDA含量比较(±s,n=8)Tab.3 Comparison of inflammatory factor level, SOD activity and MDA content in intestinal tissues of rats in each group (±s,n=8)
IL-6. 白细胞介素-6;IL-1β. 白细胞介素-1β;TNF-α. 肿瘤坏死因子-α;LPS. 脂多糖;SOD. 超氧化物歧化酶;MDA. 丙二醛;与空白对照组比较,(1)P<0.05;与模型组比较,(2)P<0.05;与地塞米松组比较,(3)P<0.05。
组别 IL-6(pg/ml) IL-1β(pg/ml) TNF-α(pg/ml) LPS(ng/ml) SOD(U/ml) MDA(μmol/L)空白对照组 28.26±1.82 496.33±23.13 418.72±2.42 14.35±0.19 22.74±0.18 6.02±1.96模型组 42.23±2.89(1) 766.66±41.89(1) 925.10±88(1) 42.75±3.75(1) 21.62±0.76(1) 12.54±1.19(1)地塞米松组 102.66±10.05(1)(2) 552.00±6.35(2) 786.31±138.78 35.74±7.16 22.54±0.22(2) 11.09±0.92(2)小檗碱组 28.27±4.59(2)(3) 529.66±6.64(2) 470.71±13.19(2) 21.15±2.52(2) 22.55±0.06(2) 9.15±0.003(2)(3)
2.6 各组IEC-6细胞中Bax、Bcl-2、caspase-3、细胞色素C mRNA表达水平比较 qPCR检测结果显示,含药血清处理24 h和48 h后,模型组Bax、caspase-3和细胞色素C mRNA表达水平高于空白对照组,Bcl-2 mRNA表达水平低于空白对照组(P<0.05);小檗碱组、地塞米松组Bax、caspase-3和细胞色素C mRNA表达水平低于模型组,Bcl-2 mRNA表达水平高于模型组(P<0.05);小檗碱组与地塞米松组Bax、Bcl-2、caspase-3、细胞色素C mRNA表达水平差异无统计学意义(P>0.05)(表4)。
表4 各组IEC-6细胞Bax、Bcl-2、caspase 3、细胞色素C mRNA表达水平比较(±s,n=8)Tab.4 Comparison of the expression levels of Bax, Bcl-2, caspase 3, cytochrome C mRNA in IEC-6 cells in each group (±s, n=8)

表4 各组IEC-6细胞Bax、Bcl-2、caspase 3、细胞色素C mRNA表达水平比较(±s,n=8)Tab.4 Comparison of the expression levels of Bax, Bcl-2, caspase 3, cytochrome C mRNA in IEC-6 cells in each group (±s, n=8)
与空白对照组比较,(1)P<0.05;与模型组比较,(2)P<0.05。
组别 Bax Bcl-2 Caspase-3 细胞色素C 24h 48h 24h 48h 24h 48h 24h 48h空白对照组 0.99±0.06 1.17±0.13 0.89±0.07 1.00±0.00 0.93±0.04 1.11±0.07 0.89±0.07 1.01±0.01模型组 70.17±2.39(1) 92.10±3.41(1) 0.15±0.01(1) 0.11±0.01(1) 64.37±19.78(1) 65.84±22.41(1) 64.09±29.49(1) 63.68±28.65(1)地塞米松组 4.51±0.11(2) 7.45±0.23(2) 0.73±0.01(2) 0.82±0.04(2) 3.96±0.12(2) 8.14±0.30(2) 2.43±0.13(2) 3.07±0.22(2)小檗碱组 10.13±3.83(2) 9.90±0.48(2) 0.59±0.13(2) 0.46±0.01(2) 12.14±0.52(2) 19.35±0.50(2) 3.18±0.27(2) 4.36±1.21(2)
3 讨 论
从天然产物中寻找毒副作用小、安全有效的药物治疗放射性肠炎是值得研究的方向。中药黄连在肠炎的治疗中应用颇多且疗效确切,小檗碱为黄连主要生物碱,在抗炎、抗菌及抗肿瘤方面药效明确。本研究证实了小檗碱能够有效治疗大鼠急性放射性肠炎,为急性放射性肠炎的药物研究提供了新的方向。
放射性肠炎是盆腔、腹腔或腹膜后恶性肿瘤放疗后的主要并发症[8],为非特异性炎症,主要表现为腹痛、脓液脓血便、腹泻等,病变累及小肠、结肠、直肠黏膜及黏膜下层[9]。在放射性肠炎急性期,紧密连接表达降低导致黏膜破坏和上皮细胞死亡,从而引起炎症[10]。单核细胞的额外募集和常驻肥大细胞的激活可刺激促炎和促纤维化介质IL-1β、IL-6、TNF-α的产生[11]。本研究通过电离辐射一次性照射大鼠腹部12 Gy模拟急性放射性肠炎,结果显示,模型组大鼠出现体重严重下降和稀烂血便,大便含血强阳性,肠组织可见黏膜上皮细胞坏死脱落、隐窝受损,隐窝数量明显减少,炎性因子IL-6、TNF-α、IL-1β水平明显升高,提示电离辐射导致的炎性损伤与上皮细胞死亡有关,急性放射性肠炎大鼠模型构建成功。本研究动物实验发现,小檗碱组大鼠体重在第3、7天均明显高于模型组和地塞米松组,血便情况优于地塞米松组;与模型组比较,小檗碱组大鼠肠组织未见明显的肠道结构破坏,胶原纤维增生明显减少,隐窝数量明显增多,但与地塞米松组比较无明显差异,表明小檗碱对大鼠急性放射性肠炎确有治疗作用。
急性放射性肠损伤凋亡期主要表现为隐窝丢失[12-13];在慢性期,辐射刺激诱导成纤维细胞增殖和胶原沉积,最终导致组织纤维化[14]。本研究发现,小檗碱对肠道隐窝有明显的保护与修复作用,且对急性放射性肠炎早期出现的胶原纤维增生有抑制作用。放射线辐射可引起大量氧自由基堆积,氧自由基通过直接攻击作用或氧化作用造成DNA及蛋白质等生物大分子损伤,从而引起细胞凋亡,进而引起肠道机械屏障、免疫屏障、化学屏障、生物屏障等功能异常,以及菌群失调与炎性因子释放等,最终造成肠组织损伤[15]。本研究选择MDA、SOD作为氧化应激的代表性指标,其中SOD活性可直接反映机体清除氧自由基、抗脂质过氧化损伤的能力,MDA可间接反映组织中氧自由基的生成量,也可反映组织生物膜脂质过氧化的程度和组织膜结构受损的程度[16]。本研究发现,放射性肠炎大鼠模型中MDA含量升高,SOD活性降低,而在使用小檗碱与地塞米松后以上指标均有改善,且小檗碱降低MDA含量的效果优于地塞米松,表明小檗碱具有减轻大鼠放射性肠炎过度氧化应激损伤的作用。此外,本研究发现,小檗碱能够明显降低急性放射性肠炎大鼠肠组织中LPS的含量。LPS是革兰阴性菌细胞壁外膜的重要组成成分,可激活生物体内巨噬细胞等效应靶细胞,刺激机体产生TNF-α、IL-1、IL-6等多种细胞因子[17]。放射性肠炎患者常存在肠道菌群紊乱,且与肠黏膜损伤、黏膜炎症及炎性因子释放相互影响[18],而小檗碱能够降低大鼠肠组织中LPS的含量,其与小檗碱抗菌作用的关系值得深入研究。
放射性肠炎的特征是隐窝细胞凋亡诱导上皮屏障的破坏及随后的炎症[14]。细胞凋亡可通过暴露于包括电离辐射在内的外源DNA损伤剂而被诱导。本研究发现,小檗碱可明显抑制促凋亡蛋白Bax、caspase-3和细胞色素C的表达,促进抗凋亡蛋白Bcl-2的表达,表明小檗碱可能通过抑制IEC-6细胞凋亡而减轻肠道炎症反应并保护、修复隐窝细胞。
综上所述,小檗碱能有效减轻大鼠急性放射性肠炎的炎症反应,其作用机制可能与小檗碱减轻氧化应激反应、调控凋亡蛋白的表达以抑制隐窝细胞凋亡有关。小檗碱灌胃对大鼠放射性肠炎具有修复作用,其作用与地塞米松相当,且在抑制胶原纤维增生、抑制炎性因子分泌、减轻氧化应激等方面优于地塞米松,表明小檗碱对于急性放射性肠炎具有综合治疗作用,具有进一步研究价值。但本研究尚存在一些不足之处:仅在急性放射性肠炎的炎症反应、氧化应激、细胞凋亡方面进行效应观察,初步探索了小檗碱治疗急性放射性肠炎的机制,但缺乏对急性放射性肠炎炎性因子、氧化应激反应以及细胞凋亡三者之间信号通路的深入探究,后续仍需进一步进行更加具体、全面的机制研究。
