基于新型磁分离技术的高分辨率DNA片段筛选技术
2021-11-19刘莹程立张博
刘莹 程立 张博
(南方科技大学生物医学工程系,深圳 518055)
肿瘤、出生缺陷和自身免疫缺陷型疾病是全世界都面临的难题,且这类疾病的致死率极高,严重威胁国民生命健康[1-2]。目前针对这类疾病还缺乏行之有效的治疗手段,因此对这类疾病的早期检测意义非凡。但目前可用的早期检测方法十分局限:有创检测方法[3-4]检测率虽高但操作复杂且有较大副作用,一些生物标记物[5-6]的检测虽操作简单但准确率不高,因此建立一种无创、快速、准确的早期检测方法,对于提前检测这类疾病,降低其死亡率、提高公众健康水平具有重要的意义。
游离核酸(cell free DNA,cfDNA)最初是在人体外周血中发现,在过去的几十年中从尿液、脑脊液和胸膜液中也提取出了cfDNA[7-10]。基于游离核酸的液体活检技术因其无创性极大地减轻了患者检测过程中的痛苦和风险,其结果分析基于核酸的测序技术,因此分析结果精准且信息全面有说服力。与之相比,基于CRISPR-Cas系统[11]等检测技术成本较高,只能针对单一序列进行检测和分析,通量低且难以实现全面的检测;而基于血清标志物[12]的检测方法虽操作简单,但仅对部分遗传病有效,限制了其应用范围,且血清标志物检测的特异性有一定局限性。经大量研究证明,来源于胎儿、肿瘤组织的cfDNA极大地促进了无创产前诊断和液体活检领域及其他潜在应用的发展[2,13-14]。
人体外周血中存在着不同片段大小的cfDNA,cfDNA不仅是检测人体内肿瘤、胎儿发育情况和自身免疫缺陷疾病等重要的生物分子目标,更能够提供供体基因组的相关信息,对于疾病的检测分析有着重要意义[15-18]。之前研究发现,孕妇血浆中来源于胎儿的cfDNA、肿瘤患者血浆中与肿瘤相关的cfDNA和自身免疫缺陷患者的cfDNA与健康人血浆中的cfDNA在片段大小上均有所差异。健康人血浆中cfDNA主峰的平均长度为l66 bp,而经序列比对,来源于胎儿的cfDNA、与肿瘤相关的cfDNA和自身免疫缺陷疾病患者的cfDNA表现为在166 bp左右的主峰降低,而150 bp以下的DNA片段比例有所增加[19-20]。造成这种片段长度差异的原因很可能是该类cfDNA甲基化水平较低,相较于来自造血组织等高甲基化的cfDNA更容易被核酸酶水解[21]。
基于所要研究的目标cfDNA(如胎儿的cfDNA、肿瘤相关的cfDNA和免疫缺陷患者体内的cfDNA)与正常的cfDNA在片段长度上的差异,原则上可以通过这种片段长度的差异对目标cfDNA进行富集。常规的富集方法主要为电泳法[22]和色谱法[23],但这两种方法在成本、效率、敏感性和特异性方面均有一定的局限性,且由于操作繁琐、结果一致性差(依赖于操作者的判断)以及难以实现高通量运行而难以应用于临床。
本研究通过发展一种基于新型磁性纳米微粒的DNA片段筛选技术,利用磁分离法从样本根源上实现了短片段DNA的富集(操作流程如图1),与传统的电泳和色谱分离技术相比,这一技术成本低,耗时短,操作简单且回收效率高,未来更有可能实现高通量和自动化。筛选效果经由临床样本验证,通过分离富集150 bp以下短片段DNA,这一技术能够在孕妇血浆样本中,相较于母体的cfDNA,更多地富集胎儿的cfDNA。富集后的胎儿cfDNA可用于进一步测序分析,经过富集处理,大大减少了母体背景DNA的干扰,这一进步改善了现有方法因胎儿cfDNA比例过低而导致的假阴性结果,能够提高无创产前诊断的灵敏度和特异性。
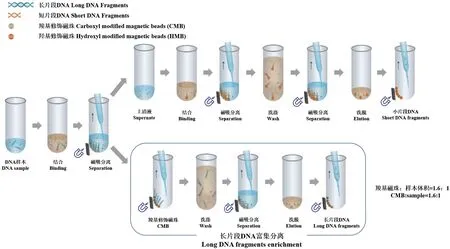
图1 富集短片段DNA的流程图Fig. 1 Workflow of short DNA fragments enrichment
1 材料与方法
1.1 材料
胎牛血清购自 Invintrogen(Gibco(26140-079)),孕妇血浆样本来源于中国科学院大学附属深圳医院儿科的10名孕妇(未知胎儿性别)以及深圳市龙岗区妇幼保健院的14名孕妇(已确定胎儿男性),所有实验均按照《涉及人的生物医学研究伦理审查办法》进行,并经南方科技大学伦理委员会批准,本研究的受试者均获得知情同意。糖原(glycogen)购自VETEC(900925-5G),异丙醇购自MACKLIN麦克林(E809056-500 mL),聚乙二醇(PEG)、无水乙醇、TE buffer(pH9.0)均购自上海沪试。引物及探针设计选择X、Y染色体特异性相关片段[24],所用引物及探针均由上海生工合成。
1.2 方法
1.2.1 羧基磁珠和羟基磁珠制备 磁珠制备及表面修饰参考文献[25-26]。
1.2.2 DNA片段筛选 长片段DNA分离:首先取10 μL 从血浆中提取的 cfDNA,与 16 μL(1.6 × 条件,即羧基磁珠体积∶cfDNA样本体积=1.6∶1)羧基磁珠(分散于PEG)混合于1.5 mL离心管,用涡旋振荡器混匀后静置5 min进行孵育,孵育结束后离心5 s,将离心管置于磁力架上静置3 min,待上清液澄清,将上清液转移至一个新的1.5 mL离心管中;短片段DNA回收:于上清液中加入4 μL糖原和8 μL羟基磁珠(分散于TE buffer),用涡旋振荡器混匀后加入46.4 μL异丙醇,然后在涡旋振荡器上涡旋10 min,孵育结束后离心5 s,然后将离心管置于磁力架上静置3 min,待上清液澄清后,弃去上清液,对上述步骤所得到的羧基磁珠和羟基磁珠分别进行两次洗涤,每次使用1 mL 80%乙醇,涡旋30 s后离心5 s,置于磁力架上静置2 min后弃上清液,两次洗涤后将磁珠静置晾干3 min后洗脱;产物洗脱:分别向装有羟基磁珠和羧基磁珠的离心管中加入10 μL洗脱液(TE bufffer,pH 9.0),涡旋5 min后离心5 s,在磁力架上静置3 min后,分别取上清到新的1.5 mL离心管,并置于-20℃冰箱保存(短期保存可置于4℃冰箱)。根据样本体积、筛选片段阈值不同,体系内各组分可等比例扩大。所得产物用2100分析仪(安捷伦)进行DNA片段分布分析。
1.2.3 二次DNA片段筛选(优化后) 第一步长片段DNA分离:首先取10 μL从血浆中提取的cfDNA,与10 μL(1.0×条件,即羧基磁珠体积∶cfDNA样本体积=1∶1)羧基磁珠(分散于PEG)混合于1.5 mL离心管,用涡旋振荡器混匀后静置5 min进行孵育,孵育结束后离心5 s,将离心管置于磁力架上静置3 min,待上清液澄清,将上清液转移至一个新的1.5 mL离心管中;第二步长片段DNA分离:于上清液中加入2 μL(0.2×条件,即羧基磁珠体积∶cfDNA样本体积=0.2∶1)羧基磁珠(分散于PEG),用涡旋振荡器混匀后静置5 min进行孵育,孵育结束后离心5 s,将离心管置于磁力架上静置3 min,待上清液澄清,将上清液转移至一个新的1.5 mL离心管中;短片段DNA回收:于上清液中加入4 μL糖原和8 μL羟基磁珠(分散于TE buffer),用涡旋振荡器混匀后加入41.6 μL异丙醇,然后在涡旋振荡器上涡旋10 min,孵育结束后离心5 s,然后将离心管置于磁力架上静置3 min,待上清液澄清后,弃去上清液。对上述步骤所得到的羧基磁珠和羟基磁珠分别进行两次洗涤,每次使用1 mL 80%乙醇,涡旋30 s后离心5 s,置于磁力架上静置2 min后弃上清液,两次洗涤后将磁珠静置晾干3 min后洗脱;洗脱:分别向装有羟基磁珠和两步羧基磁珠的离心管中加入 10 μL洗脱液(TE bufffer,pH 9.0),涡旋 5 min后离心5 s,在磁力架上静置3 min后,分别取上清到新的1.5 mL离心管,并置于-20℃冰箱保存(短期保存可置于4℃冰箱)。根据样本体积、筛选片段阈值不同,体系内各组分可等比例扩大。所得产物用2100分析仪(安捷伦)进行DNA片段分布分析。
1.2.4 临床样本的富集验证 胎儿性别验证:将得到的孕妇血液样本进行血浆分离,然后提取血浆样本中的cfDNA。当孕妇所怀胎儿为男性时,血浆所提取cfDNA中的Y染色体相关片段则均来源于胎儿。由于各条染色体在cfDNA中所占比例相对稳定,因此可以通过样本中Y染色体的比例来估算胎儿cfDNA与母体cfDNA的比例。胎儿性别的确定是基于对母体血浆中提取的cfDNA进行Y染色体相关片段的实时qPCR(TaqMan)测定。qPCR反应混合物(总体积 10 μL),其中包含 5 μL TaqManTMFast Advanced Master Mix(Thermo Fisher)、Y 染色体正向和反向引物(各 0.5 μL 引物序列见表 1)、0.5 μL TaqMan-MGB探针(VIC荧光染料,10 μmol/L,序列 见 表 1)、1 μL DNA 样 本 和 2.5 μL 不 含 RNase /DNase的水。在StepOnePlus Real-Time PCR System(Thermo Fisher)上运行程序为:95℃ 10 min;60℃1 min 然后95℃ 15 s 循环39次;60℃ 2 min,循环结束后于10℃保存,所有步骤的升温速率均为2℃/s,Ct值< 38的样本被认定为男性胎儿。

表1 引物和探针信息表Table 1 Information of primers and probes
1.2.5 胎儿cfDNA富集 对后续认定为男性胎儿的21个样本进行DNA片段筛选,长短片段筛选阈值设定为150 bp,筛选方法如1.2.2,富集前后样本使用数字PCR(ddPCR)进行胎儿cfDNA与母体cfDNA比例的分析。
1.2.6 胎儿cfDNA比例变化测定 ddPCR反应混合物总体积为14.5 μL,其中包含7.25 μL QuantStudioTM3D数字PCR预混液(Thermo Fisher Scientific),X染色体和Y染色体相关片段正向、反向引物和对应探针(引物及探针序列见表1,X染色体相关片段荧光标记为FAM,Y染色体相关片段荧光标记为VIC)各为 0.725 μL(10 μmol/L),1.45 μL DNA 样本和3.625 μL不含RNase/DNase的水。使用ProFlexTM2× Flat PCR系统(Thermo Fisher Scientific)进行ddPCR。热循环条件如下:96℃ 10 min;60℃ 1 min然后98℃ 30 s 循环39次;60℃ 2 min,循环结束后于10℃保存,所有步骤的升温速率均为2℃/s。循环结束后,使用QuantStudioTM3D Analysis SuiteTM软件分析孔中所扩增得到的荧光信号。胎儿cfDNA比例以ChrY%)计算:ChrY%= Chr Y的拷贝数/(Chr X的拷贝数+ Chr Y的拷贝数)。
2 结果
2.1 利用新型磁分离技术的DNA片段筛选结果
首先使用胎牛血清所提取的cfDNA进行模型体系验证。所得产物经2100分析仪High sensitive DNA模式进行分析,从图2-A上可以看出,相较于富集前,经过富集后的cfDNA主峰左移并且峰值下降,富集后的cfDNA不含有长片段DNA。从图2-B的定量数据分析来看,150 bp以下的DNA片段在富集前后从7.1%增加到36.4%,主峰的平均片段大小从174 bp下降为151 bp,这表明这一方法能够显著提高样本中150 bp以下cfDNA的比例。
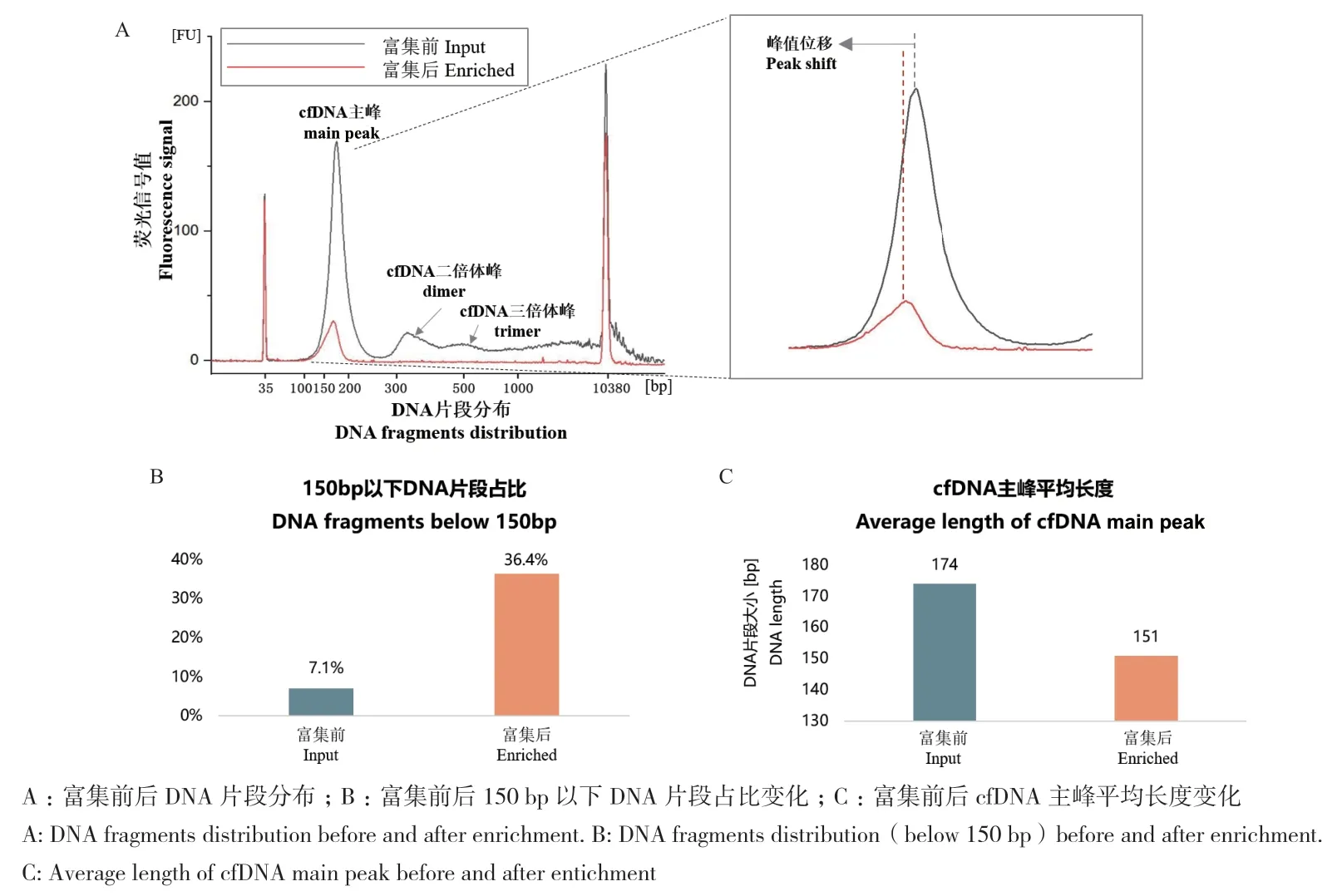
图2 cfDNA短片段富集的模型体系验证Fig.2 Verification of short DNA fragments enrichment
2.2 临床样本的富集验证结果
ddPCR对X、Y染色体的拷贝数检测流程见图3-A。其中只检测到X染色体相关片段扩增的孔用蓝色点表示,只检测到Y染色体相关片段扩增的孔用红色点表示,同时检测到X染色体和Y染色体相关片段扩增的孔用绿色点表示,而未检测到扩增的孔用黄色点表示(图3-B)。图中二维ddPCR荧光幅值图显示富集前后样本中X染色体和Y染色体相关片段的大致变化,在富集后X染色体的阳性孔数明显减少,而Y染色体的阳性孔数几乎保持不变,这证明了富集后Y染色体比例的增加(图3-B)。后续对21个样本的ddPCR结果进行定量数据分析发现,在富集前后各个样本的Y染色体比例都有显著提高,富集后Y染色体比例提高大约为富集前的3.2倍(图3-C和D)。
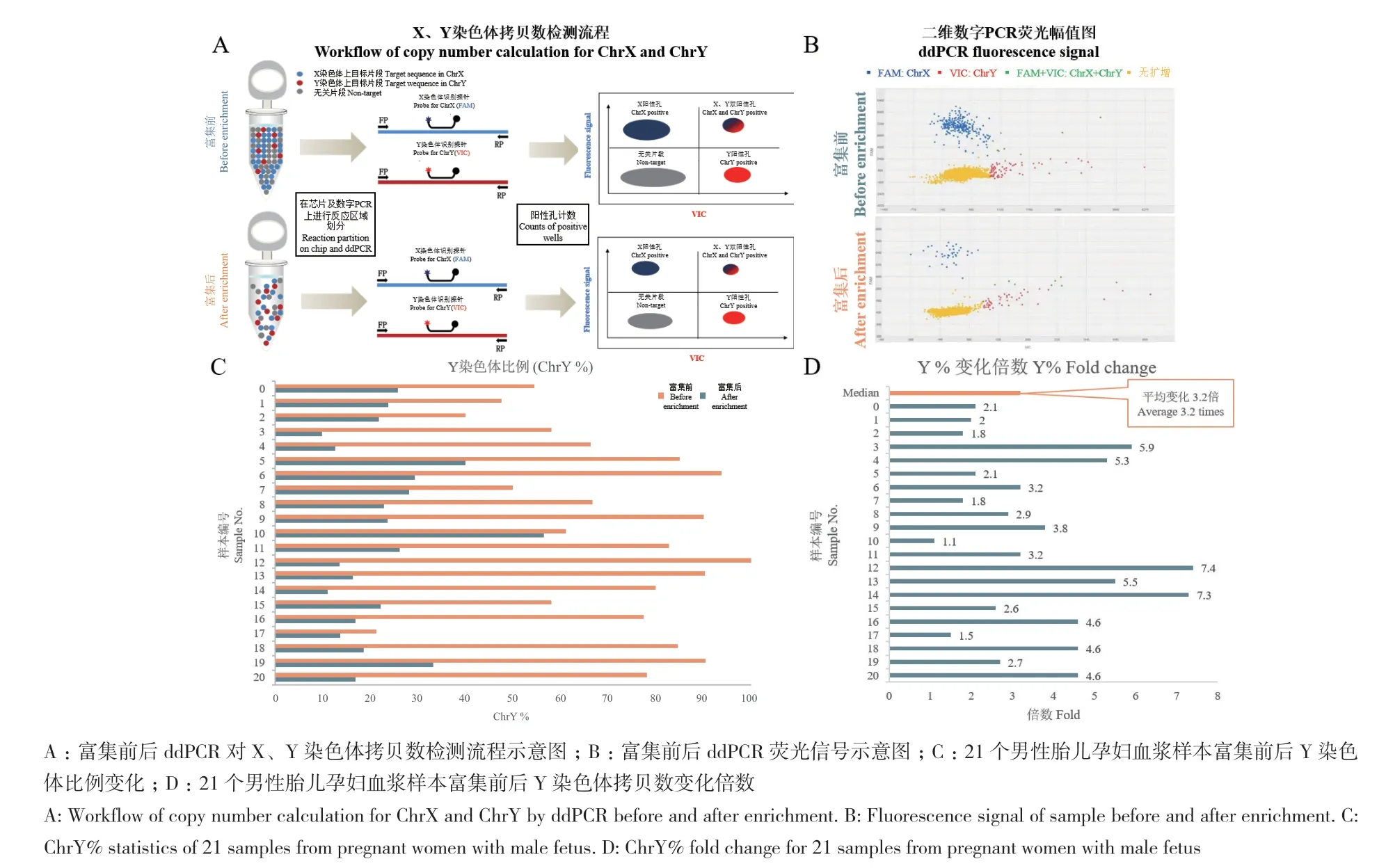
图3 ddPCR验证结果Fig.3 Enrichment efficiency evaluation by ddPCR
3 讨论
调研已有研究发现,现有的高分辨率的对DNA片段筛选和分离的方法操作繁琐且通量低,目前市面上还未有操作简单、可重复性高、可实现自动化的DNA片段高分辨率筛选方法,尤其是针对200 bp以下短片段DNA的筛选。本文所介绍的这种基于新型磁分离技术的DNA片段筛选克服了已有方法的弊端,并且可实现自动化和高通量的筛选,未来在临床应用上具有极大的潜力。
首先以胎牛血清中提取的cfDNA作为模型体系,从理论上证明了这一技术实现200 bp以下cfDNA片段高分辨率筛选的可行性。图2中的数据证明,富集后的cfDNA能够完全去除200 bp以上的长片段DNA,且富集后150 bp以下短片段DNA的占比增加近5倍,证明了这一技术能够实现150 bp以下短片段DNA的富集,这对于未来应用于临床十分重要。之后通过对临床孕妇血浆样本中的cfDNA进行富集,并利用ddPCR的分析方法,我们证明了这一技术能够显著提高孕妇血浆样本中胎儿cfDNA(基于样本中来源于男性胎儿Y染色体相关片段比例的变化)的比例,初步探索了这一技术在无创产前诊断领域应用的前景(图3)。
基于实验结果,发现在羧基磁珠与样本体积比为1.6∶1时,虽能够很好的富集150 bp以下短片段的DNA,但如图2-A所示,富集后的cfDNA主峰大幅降低,在去除长片段DNA背景干扰的同时,也可能导致临床样本中目标DNA的损失,从而导致关键信息的缺失进而引起检测结果的不准确,这对于无创产前诊断中单基因遗传病的筛查[27-29]、液体活检早期筛查[30-31]和免疫缺陷疾病的诊断[10]均十分重要,尤其在肿瘤的早期检测中,由于ctDNA(circlating tumor DNA)含量极低(仅为cfDNA的0.1‰-1‰)[30,32],过多 150 bp 以下 cfDNA 的损失很可能造成检测结果的假阴性。为了平衡短片段DNA的回收率和富集效率,我们将上述筛选方案进行了优化,在一步筛选的基础上降低羧基磁珠的用量,并调整为两次筛选(图4)。
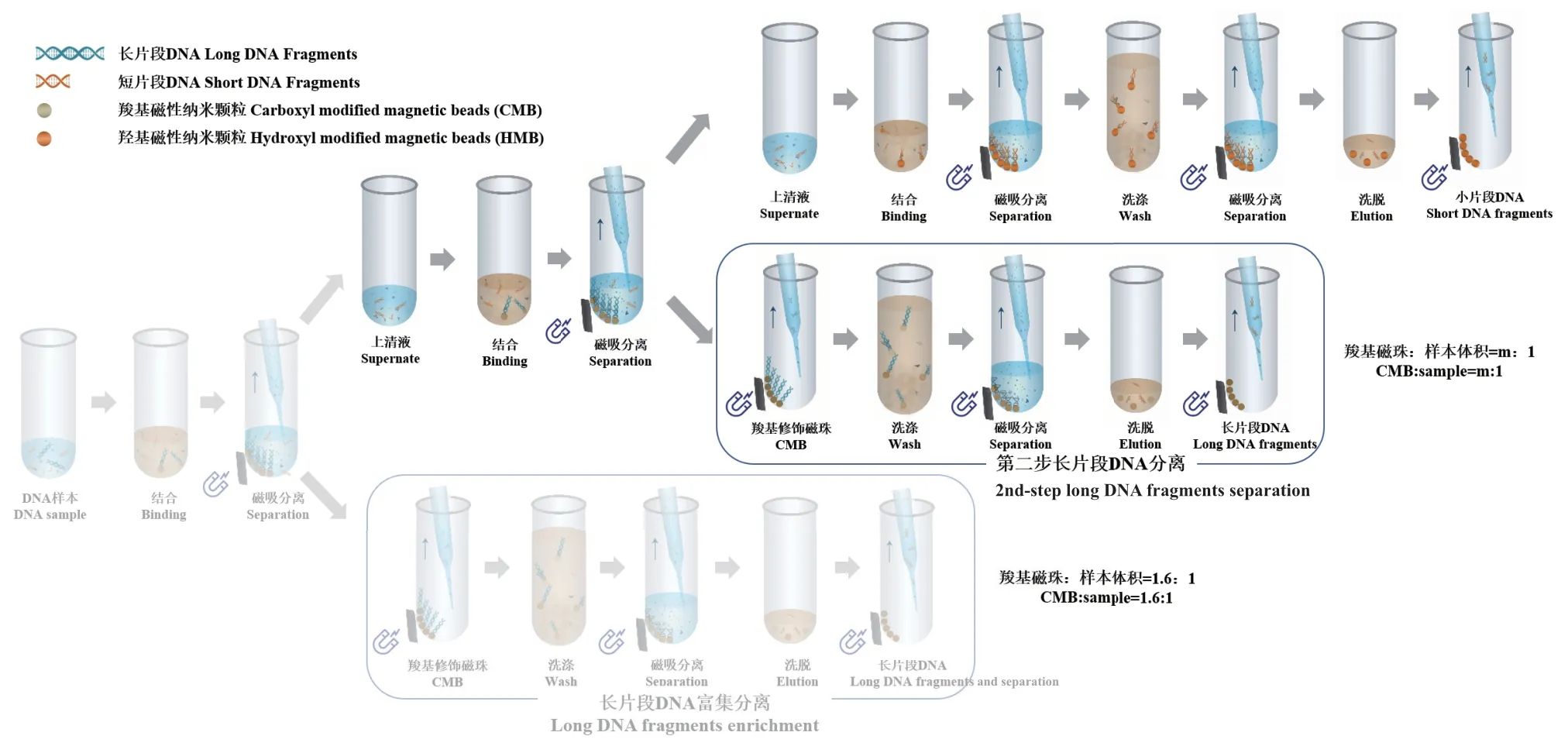
图4 优化后富集短片段DNA的流程图Fig.4 Optimized workflow of short DNA fragments enrichment
二次筛选方法将羧基磁珠与样本体积比从1.6∶1调整为第一步1∶1筛选(如图4中第一步长片段DNA分离),第二步0.2∶1筛选(如图4中第二步长片段DNA分离),通过降低羧基磁珠的用量来减少短片段DNA的损失,并将原本的一次筛选去除长片段DNA优化为二次筛选,进而提高短片段DNA的富集效率。具体步骤见1.2.3。结果如图5,图5-B中两步长片段DNA分离结果表明,优化后的两次筛选起峰位置均在150 bp左右,即最大程度上保留了150 bp以下的cfDNA。图5-C和5-D中150 bp以下DNA片段占比富集前后提高近4倍,主峰的平均长度从177 bp降至161 bp,优化后的富集方法尽可能地减少了150 bp以下cfDNA的损失,并显著提高了短片段cfDNA的比例,这对于未来将其应用于肿瘤的早期筛查、免疫缺陷型疾病的诊断以及无创产前诊断中单基因遗传病的筛查具有重要意义。
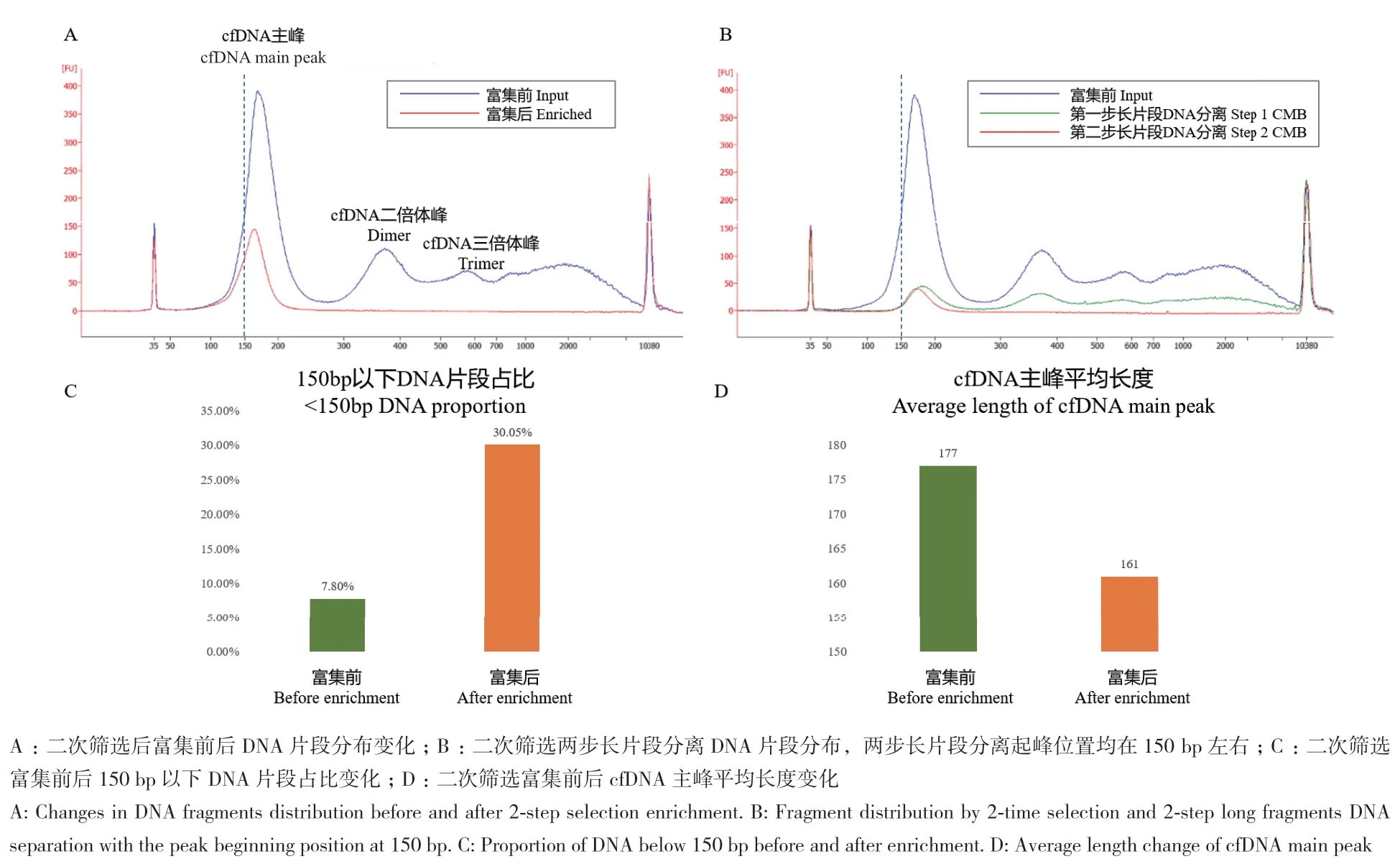
图5 优化后胎牛血清cfDNA短片段的富集Fig. 5 Enrichment of short cfDNA fragments with fetal bovine serum by optimized workflow
经实验证明,优化后的二次筛选能够有效减少150 bp以下DNA片段的损失,这对于未来临床上癌症的早期筛查和自身免疫缺陷疾病的诊断具有很大的应用潜力。已知在肿瘤患者血浆中ctDNA的含量非常低[33];同样在自身免疫缺陷疾病,如在系统性红斑狼疮患者外周血中发现存在更多150 bp以下的cfDNA[34],但大量的长片段cfDNA作为背景极大地干扰了相关靶标DNA的信号;而当前的无创产前诊断只能实现胎儿染色体异常的检测,还未能实现单基因遗传病等的早期筛查[35],均是由于目标DNA丰度太低,检测灵敏度和准确度受限于背景信号的干扰。在这些临床应用领域中,由于靶标DNA均存在片段偏小(<150 bp),且含量极低的问题,因此可以利用二次筛选技术从样本根源上富集150 bp以下的DNA,并尽可能减少短片段DNA的损失。经二次筛选后,基于新型磁分离技术的DNA片段筛选技术能够实现最大程度地减少目标长度DNA片段的损失,并显著地提高150 bp以下DNA片段在样本中的占比,保证了临床信息的完整性。且操作简单,一致性好,可自动化程度高,未来更可结合自动化实现高通量筛选。
与其他同类技术以及传统的色谱法和电泳法核酸分离技术相比,这一技术操作简单,耗时短,且可自动化程度高。在基于SPRI的DNA片段筛选技术中实现了技术突破,已经达到了10-20 bp的分辨率差别,其筛选分辨率还有进一步提高的空间。当前这一技术仅应用于小体积样本的DNA片段筛选,未来通过磁珠的磁分离属性,可应用于高通量的自动化筛选,相应的技术路线还需要进行进一步的验证和调整。未来将这项高分辨率的DNA片段筛选技术与测序等技术相结合,有希望解决无创产前诊断、液体活检和免疫缺陷型疾病早筛中样本信噪比低、灵敏度差的问题,对于如测序建库前的DNA片段筛选也具有应用潜力,运用磁分离技术对提高测序建库效率和节省成本有一定的推动作用,使基于测序的疾病早筛进入更深层次的领域,更有助于提高公众健康水平。
4 结论
本研究基于一种新型的磁分离技术,实现了高分辨率的短片段DNA的富集。经多次实验及优化证明,这一技术能够尽可能降低150 bp以下短片段DNA的损失,并能够显著提高样本中150 bp以下短片段DNA的比例。这项技术在未来有可能更多地应用于包括测序建库、无创产前诊断、液体活检、免疫缺陷型疾病早筛等方向。
致谢
感谢中国科学院大学附属深圳医院及深圳市龙岗区妇幼保健院所提供的孕妇血浆样本。
