超表达马尾松PmPT3基因提高拟南芥耐低磷能力
2021-11-19方丹丹张婷文晓鹏
方丹丹 张婷 文晓鹏
(1. 贵州大学农业生物工程研究院 生命科学学院 山地植物资源保护与保护种质创新教育部重点实验室 贵阳 550025;2. 贵阳学院生物与环境工程学院 贵州省山地珍稀动物与经济昆虫重点实验室,贵阳 550005)
磷元素是植物生长发育过程中不可或缺的营养元素之一,是促进植物生长发育的重要元素,但土壤对磷元素有着强烈的吸附作用。土壤溶液中的无机磷酸盐作为植物磷的主要来源,大多是以沉淀的形式存在于土壤环境中;同时可以与土壤溶液中的阳离子形成络合物,导致土壤环境中的有机磷不能直接被植物吸收利用[1]。植株在低磷胁迫环境中会通过根系向土壤中排放其分泌物,进而活化土壤中的无机、有机磷,以及接收缺磷的信号来诱导表达磷转运蛋白基因[2-4]。多项研究表明,植物在响应低磷胁迫的过程中,磷转运蛋白(Phosphorus Transporter,PT)会被高效诱导表达,而正常供磷环境下该蛋白反被抑制[5-9]。在低磷胁迫条件下,蒺藜苜蓿(Medicago truncatula)PT1家族中的磷转运蛋白基因MtPT5和MtPT6下可以促进有效磷向根瘤运输,使根瘤中保持磷平衡[10]。Xu等[11]从玉米(Zea Mays)中分离出ZmPt9,过表达拟南芥后发现,转基因拟南芥具有小叶子和早开花的现象。Naureen等[12]借助VIGS介导的基因瞬时沉默的技术方法,对番茄(Solanum lycopersicum)中的SlPT1基因的沉默导致番茄植株在低磷胁迫的条件下保护酶类活性显著下降。在磷素吸收与转运分配过程中,对杉木(Cunninghamia lanceolata)中的磷酸转运蛋白PHT1家族中的ClPht1基因进行同源转化发现,该基因参与杉木地下部分和地上部分磷素的运输和分配[13]。双子叶植物紫云英(Astragalus sinicus)中磷转运蛋白AsPT5基因对增强其植株本身根系对磷酸盐的吸收起着关键性的作用[14]。由此可知,磷转运蛋白(PHT)在植物吸收磷酸盐中具有重要作用。然而,木本植物中的PHT家族基因在其他植物中赋予植物生长的作用还有待探索。马尾松(Pinus massoniana)是我国松属类分布最广的针叶树种,是拥有多方面用途的用材林,同时支撑着我国森林文化、医疗保健和化工业等多个行业,被冠名为“高附加值林产品的经济树种”[15]。在我国部分缺磷严重的地区,马尾松经历长期的地理隔离、生殖隔离和自然选择,致使其种内产生遗传变异现象,在低磷环境下展现出良好的适应生存能力。前期研究发现通过对马尾松在低磷胁迫下的磷转运蛋白基因的效应,其中磷转运蛋白基因在低磷胁迫环境下具有良好的作用机制[5]。因此,进行相关植株遗传转化可以分析其潜在的应用价值。本研究通过采用花序浸染法遗传转化拟南芥,探讨在低磷胁迫条件下马尾松高亲和磷转运蛋白PmPT3基因在草本植物拟南芥中耐低磷胁迫的能力,可为林木优良基因的利用及创制耐低磷新种质提供一定的科学依据。
1 材料与方法
1.1 材料
生态型哥伦比亚拟南芥(Arabidopsis thaliana)种子,马尾松PmPT3基因(GenBank注册号为KT390744)由本实验前期克隆并注册,农杆菌(Agrobacterium tumefaciens)GV3101菌株、植物表达载体pBWA(V)HS由贵州大学农业生物工程研究院保存。
1.2 方法
1.2.1 PmPT3基因扩增及纯化 根据马尾松PmPT3基因序列与pBWA(V)HS质粒上原有的限制性内切酶酶切位点,利用软件Primer5设计特异性正反引物,并在引物5′端插入Ase I和Bsa I的酶切位点及保护碱基,所获得的克隆正反引物序列见表1,用该引物对马尾松cDNA模板进行扩增,反应总体系为 10 μL,包括 PreMix 5 μL,正反引物各 0.5 μL,模板 1 μL,ddH2O 3 μL。PCR 反应程序 :94℃预变性5 min;94℃变性30 s;50℃退火45 s;72℃延伸90 s;30个循环;72℃延伸7 min。PCR产物进行凝胶电泳检测,回收纯化,保存在-20℃冰箱中备用。
1.2.2 植物表达载体构建及农杆菌转化 将回收产物连接到BLUNT载体上,转化感受态大肠杆菌DH5α 37℃培养过夜,筛选阳性菌落进行测序,提取质粒备用。分别用限制性内切酶Ase I和Bsa I对含有PmPT3基因和pBWA(V)HS载体质粒进行双酶切,回收PmPT3和pBWA(V)HS两个目的片段。用T4连接酶将目的片段产物进行过夜连接,将连接产物转化感受态大肠杆菌DH5α细胞,PCR鉴定阳性克隆,获得重组质粒后命名为pBWA(V)HSPmPT3。用热激法将重组质粒转化至农杆菌GV3101感受态细胞,并进行阳性检测。
1.2.3 拟南芥遗传转化及阳性植株鉴定 将携带pBWA(V)HS-PmPT3超表达载体的农杆菌于液体培养基中活化过夜培养,用15%蔗糖溶液悬浮离心2次后将农杆菌重悬于20 mL渗透液(15%蔗糖+20 μL Silwet-77,OD600=1.0-1.2)中,将提前浇足水的拟南芥上的果荚和完全开放的花剪除,将渗透液充分摇匀后浸泡拟南芥花絮1 min,幼嫩的枝条花絮浸染30 s,同时轻微震荡。浸染后暗培养36 h,然后置于正常培养1周左右方可浇水,并定期继续浸染2-3次,培养至种子成熟备用。将收集到的种子培养于MS+20 mg/L Hyg(潮霉素B)+100 mg/L Cep(头孢)的固体培养基上进行筛选,pH=5.8,筛选得到T0代植株后,分株收获T1代转基因种子。按照上步方法筛选T1代转基因种子,根据孟德尔遗传定律挑选符合3∶1分离比的T2代苗,分株收获T2代转基因种子,经筛选培养最终得到T3代转基因种子,培养T3代转基因苗进行后续实验。
1.2.4 低磷胁迫处理及相关生理生化指标的测定 将拟南芥野生型和筛选得到的T3代转基因种子分别在MS条件下春化处理4 d,继续培养5 d,挑选长势一致的拟南芥野生型和转基因植株,分别移植到低磷(LP,0.125 mmol/L)、对照(MS,1.25 mmol/L)2个供磷水平的培养基中培养20 d后,观察叶片、根系的形态变化,测定相关生理生化指标:地上和地下部分的干重,总磷和无机磷含量,丙二醛(MDA)含量、超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性(测量方法参照购于索莱宝生物科技有限公司的试剂盒)。每项生理生化指标重复测定3次。
1.2.5 转基因拟南芥PmPT3基因表达分析 提取转基因拟南芥地上部分和根部的RNA,并进行cDNA第一链合成。之后进行PmPT3基因的qRT-PCR表达分析,Actin2为内参基因[9],所用引物名称及基因特异性引物序列见表1。荧光定量反应体系为10 μL :SYBR® Green Master Mix 5.0 μL、ddH2O 4.0 μL、正反向引物各0.25 μL、模板cDNA 0.5 μL。扩增程序 :95℃ 10 min;95℃ 15 s;59℃ 30 s;72℃ 60 s;40个循环。

表1 实验所用引物及序列Table 1 Primers and sequences used in the study
2 结果
2.1 植物表达载体的构建及农杆菌转化
cDNA模板PCR扩增后进行回收(图1-A),将目的基因条带连接BLUNT载体,测序拼接结果与PmPT3基因的ORF一致。进行双酶切后,酶切产物凝胶电泳检测(图1-B,图1-C),获得大小两个条带,小条带的大小在1 700 bp-1 800 bp之间,目的基因序列大小处于该区间内。转化大肠杆菌感受态DH5α细胞,获得重组质粒pBWA(V)HS-PmPT3,条带大小符合(图1-D)。向农杆菌GV3101感受态细胞加入重组质粒进行转化后,菌落PCR及凝胶电泳检测(图1-E),经过比对与目的基因条带相符,进而说明农杆菌中已成功转入pBWA(V)HSPmPT3质粒,植物表达载体构建成功。
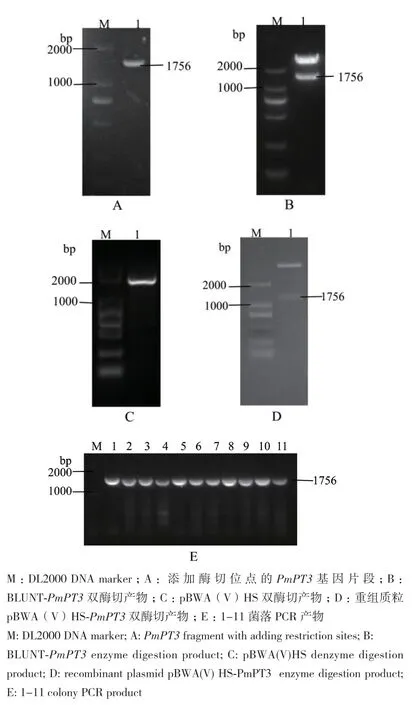
图1 马尾松PmPT3基因植物表达载体的构建Fig.1 Construction of plant expression vector of P. massoniana PmPT3 Gene
2.2 转基因拟南芥植株的获得及表达分析
采用花序浸染法,遗传转化拟南芥(图2),共获得T1代拟南芥抗性植株27株,分别提取这27株拟南芥的RNA,反转录为cDNA后进行PmPT3基因的qRT-PCR表达分析,分析结果显示27株株系中11号表达量最高,5号次之(图3-A)。通过继续筛选共获得4株T3代纯合株系,其马尾松PmPT3基因表达量最高(图3-B),进行磷处理后,叶片、根系的形态变化如图2-G和图2-F。
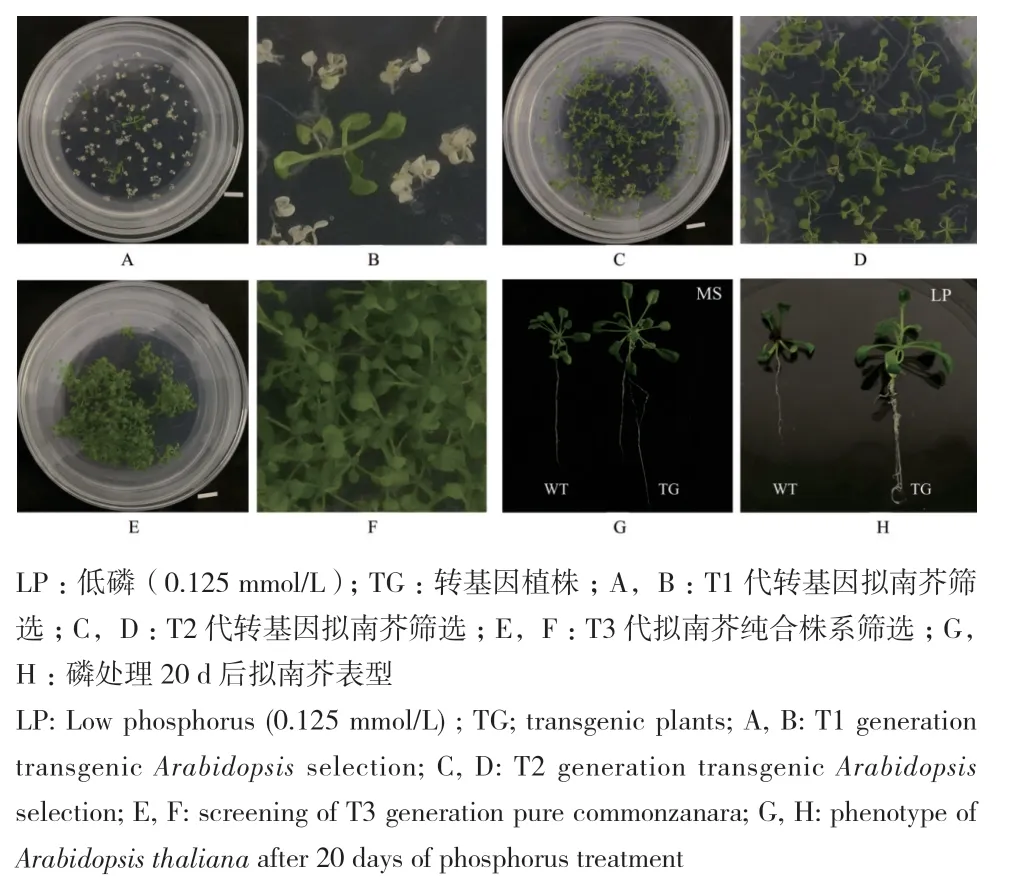
图2 马尾松PmPT3遗传转化拟南芥过程Fig.2 Process of genetic transformation of P. massoniana PmPT3 into Arabidopsis
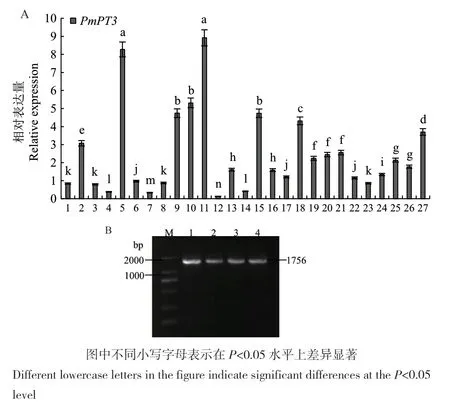
图3 T1代转基因拟南芥qRT-PCR分析(A)及纯合株系PCR检测(B)Fig.3 Analysis of positive gene expression in T1 generation transgenic Arabidopsis thaliana (A) and PCR detection of homozygous strains (B)
2.3 低磷胁迫对酶活性与丙二醛含量的影响
在正常供磷条件下,拟南芥野生型和转基因植株过氧化物酶(POD)、超氧化物歧化酶(SOD)活性、过氧化氢酶(CAT)活性和丙二醛(MDA)含量差异不显著,在低磷条件下转基因植株的POD、SOD、CAT酶活性均高于野生型植株,分别是野生型植株的2.17倍(图4-A)、1.59倍(图4-B)、1.81倍(图4-C);MDA含量都增加,但野生型植株MDA含量极显著高于转基因植株,是转基因植株的2.10倍(P<0.05,图4-D)。分析结果表明,在低磷胁迫条件下,转基因拟南芥中马尾松PmPT3基因的超表达有效的增强了植株保护酶活性,降低了丙二醛含量,进而增强了拟南芥耐低磷胁迫的能力。
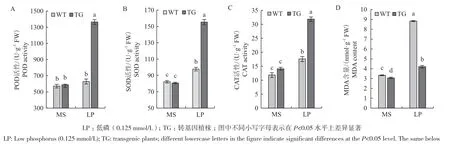
图4 低磷胁迫对转基因拟南芥POD(A)、SOD(B)、CAT(C)活性及MDA(D)含量的影响Fig.4 Effect of low phosphorus stress on the POD(A), SOD(B), CAT(C) activity and MDA(D) content of transgenic Arabidopsis
2.4 低磷胁迫对磷含量的影响
在正常供磷条件下,地上部分及根部总磷含量和无机磷含量无显著性差异。低磷胁迫处理后,转基因拟南芥的地上部分和根部总磷含量较野生型相比,分别提高了1.26倍和1.74倍(图5-A),无机磷含量较野生型相比分别提高了1.38倍和1.89倍(图5-B)。表明在低磷胁迫条件下PmPT3基因的超表达对拟南芥磷素吸收利用的能力有提高作用。
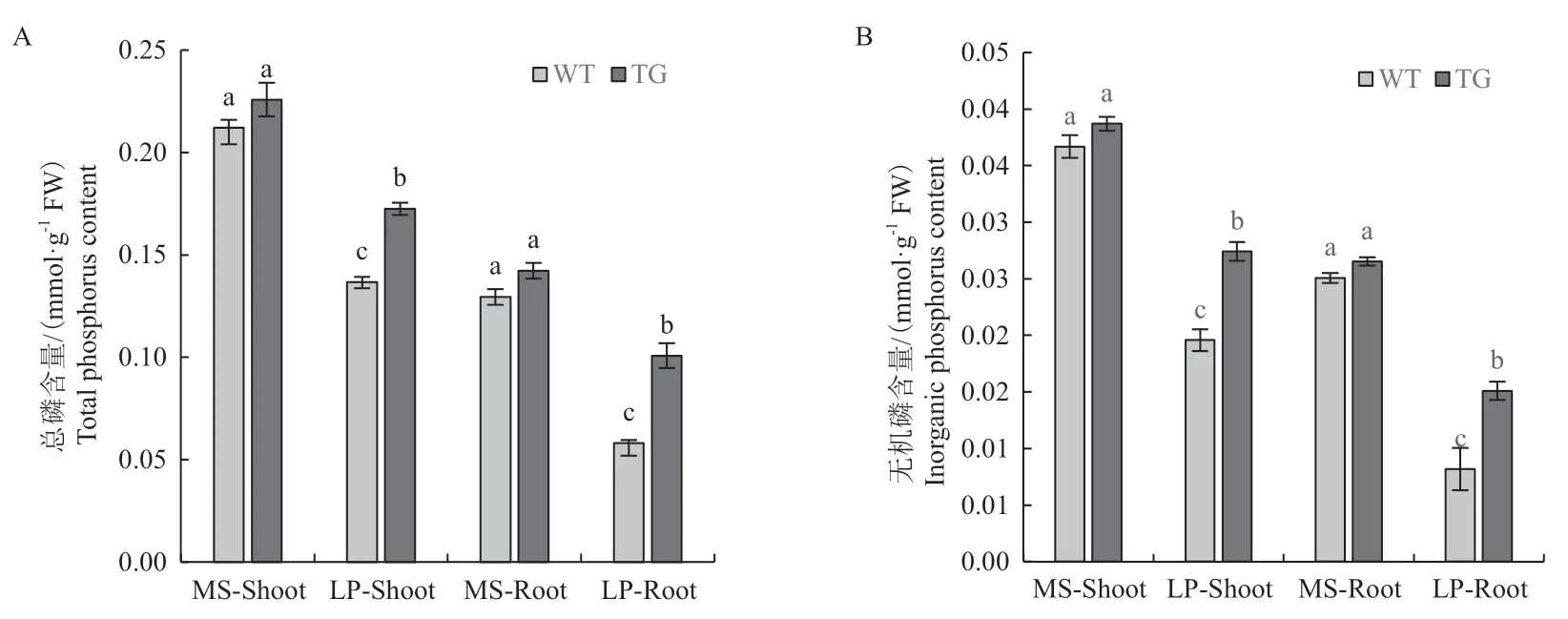
图5 低磷胁迫对转基因拟南芥总磷含量(A)和无机磷含量(B)的影响Fig.5 Effect of low phosphorus stress on the total phosphorus content (A) and inorganic phosphorus content (B) of transgenic Arabidopsis
2.5 低磷胁迫对生物量的影响
在正常供磷条件下,地上部干重、根干重和总干重都无显著差异,但在低磷胁迫条件下都表现出极显著的差异,其中转基因植株较野生型地上部干重增加了45.46%,根干重增加了55.56%,总干重增加了46.15%(图6)。根冠比都大于正常供磷条件下的拟南芥,表明低磷胁迫对植株地下部分的抑制作用可能小于地上部分。
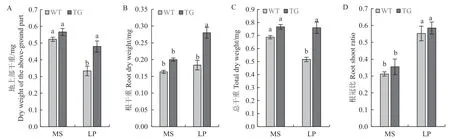
图6 低磷胁迫对转基因拟南芥地上部干重(A)、根干重(B)、总干重(C)和根冠比(D)的影响Fig.6 Effect of low phosphorus stress on the above-ground dry weight (A), root dry weight (B), total dry weight (C) and root to shoot ratio (D) of transgenic Arabidopsis
2.6 低磷胁迫对转基因拟南芥PmPT3基因表达量的影响
无论是正常供磷条件下,还是低磷胁迫条件下,根部及地上部分PmPT3基因表达量都表现为极显著性差异(图7)。与正常供磷相比,低磷胁迫下PmPT3基因相对表达量在根部及地上部分的相对表达量显著提高,且在根部相对表达量最高,这说明该基因主要在植株的根部发挥作用。
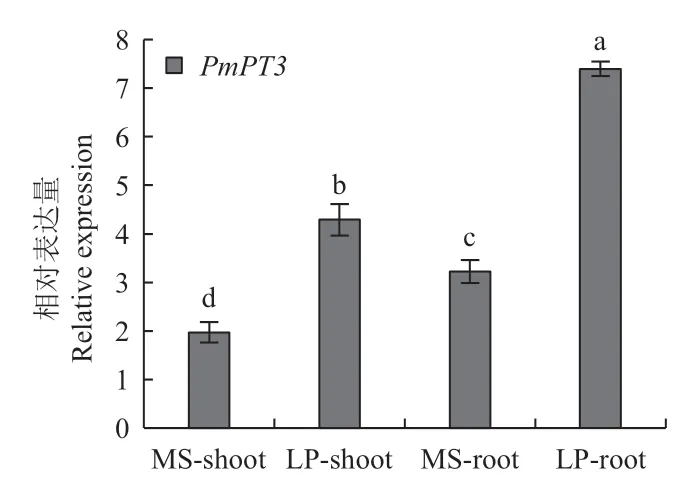
图7 磷处理后马尾松PmPT3基因相对表达量Fig.7 Relative expression of PmPT3 gene of P. massoniana after phosphorus treatment
3 讨论
磷是植物生长发育所需的重要常量元素,根系从土壤中吸收磷是植物获取磷的主要途径。当植物在面对低磷胁迫的过程中,植株本身不仅在发育、形态、生理和生化等方面形成复杂的机制来应对低磷胁迫,同时在植物基因水平也发挥着不同的作用,以此来适应各种逆境和胁迫带来的不良影响[16]。当植物生长在低磷胁迫环境中时,植物体内的磷转运蛋白基因将发挥作用,其中PHT1基因家族是调节磷转运非常重要的高亲和磷转运蛋白基因,是植株细胞膜进行吸收和转运土壤中无机磷的重要转运蛋白[17]。
本研究中,进行低磷胁迫处理后,转基因拟南芥的地上部分和根部总磷含量及无机磷含量都显著提高,说明PmPT3基因的超表达可能增加了拟南芥对磷的吸收。对其他植物中同类基因的研究也有报道,例如,番茄植株在供磷水平低的条件下,SlPT1基因如果保持沉默,则会导致植株磷含量显著降低[18]。在橡胶树中,HbPHT1基因表达量的增加改善了植株磷的吸收、转运和利用[19]。有研究发现白羽扇豆中的LaPT1基因,在低磷胁迫环境中,获得高效表达,特别是在根中[20]。马铃薯进行低磷处理后,磷转运蛋白StPHT1基因获得了过表达,根部的表达量高于茎和叶,这说明在低磷环境下,根部中StPHT1的依赖性可能大于茎与叶[21]。本研究中,低磷胁迫下PmPT3基因相对表达量在根部及地上部分的相对表达量显著提高,且在根部相对表达量最高,与其他物种中的情况相似。
另外有研究表明,在植株处于非生物胁迫条件下,细胞会产生一系列活性氧簇来打破细胞内自由基平衡,提高细胞膜透性,作为植物细胞抵御逆境的保护性酶类POD、SOD、CAT会明显上升,以此来消除植物细胞内多余的活性氧,进而来减弱低磷胁迫对植物细胞膜系统、蛋白质和核酸造成的损伤,达到保护植物的作用[22-24]。清除活性氧自由基的关键酶SOD、POD和CAT,以及MDA的含量都能间接地反映细胞膜脂的过氧化程度,可反映植物耐逆境的能力[25]。在本研究中,转基因拟南芥植株在低磷胁迫下SOD、POD、CAT活性较野生型显著升高,MDA含量显著降低。有研究表明,将马铃薯磷酸转运蛋白StPht1-1基因过表达杨树P39后生物量获得显著增加[26]。本研究中,拟南芥生物量的变化表明,PmPT3基因的超表达提高了拟南芥生物量的积累,与马尾松Pht1家族中的基因在烟草中的结果相似[5]。
4 结论
马尾松PmPT3基因的超表达提高了转基因拟南芥保护酶活性,降低了丙二醛含量,增加了磷含量和生物量的积累,进而显著提高了拟南芥耐低磷胁迫的能力。
