电刺激对兔膝关节挛缩的治疗作用及其抗纤维化机制研究
2021-11-09刘阿英张全兵黄鹏鹏王婷婷
刘阿英,张全兵*,周 云,王 华,王 锋,黄鹏鹏,杨 帆,王婷婷
在骨科和康复科临床工作中,膝关节伸直型挛缩是一种常见的关节挛缩类型。限制关节活动的解剖学因素可以分为肌源性因素(肌肉、肌腱和筋膜等)和关节源性因素(骨、软骨、关节囊和韧带等),分别导致了肌源性和关节源性挛缩。本课题组通过对家兔研究发现,肌源性挛缩至固定4周基本达到稳定状态,关节源性挛缩在固定4周后进一步发展。低频电刺激(low frequency electrical stimulation,LFES)作为一种安全有效的物理因子治疗手段,在一定条件下具有增加肌纤维的收缩功能,改善骨骼肌萎缩的作用,但它改善关节周围组织纤维化的作用尚无人探讨。该研究观察LFES对兔早期伸直型膝关节挛缩的治疗作用,并探讨其对骨骼肌和关节囊纤维化的影响。
1 材料与方法
1.1 动物
24只3~4月大的骨骼发育成熟的雄性新西兰白兔,体质量2.0~2.5 kg,购自安徽医科大学实验动物中心。将家兔单独饲养在60 cm×50 cm×40 cm的笼子中,环境温度为24 ℃,光暗循环12 h,允许兔子在笼中自由活动,自由获取水和食物。实验开始前采用标准的家兔饮食将所有的兔子进行适应性饲养两周。本实验方案经安徽医科大学动物伦理委员会批准(伦理编号:LLSC20190761)。1.2 实验材料
电子针灸治疗仪(型号:SDZ-Ⅳ型)购自苏州华佗针灸器械总厂。家兔膝关节活动范围(range of motion, ROM)的测量采用本课题组设计的具有实用新型专利的关节活动度测量仪(ZL201720251124.6)。BCA蛋白检测试剂盒(货号:P0010)购自上海碧云天生物技术有限公司;检测α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(货号:bsm-33287M-HRP)和转化生长因子-β1(transforming growth factor-β1,TGF-β1)(货号:bsm-33187M-HRP)蛋白表达量的一抗购自北京博奥森生物技术有限公司。GAPDH(货号:F2612)抗体购自美国Santa Cruz生物技术公司。化学发光(ECL)检测试剂盒(货号:32109)购自美国Thermo Scientific公司。HE染色试剂盒(货号:G1120)购自北京博奥森生物技术有限公司,Masson染色试剂盒(货号:G1340)购自北京索莱宝科技有限公司;尼康倒置显微镜(型号:TE2000-U)购自日本东京Nikon公司,Image-Pro Plus 6.0软件购自美国银泉市马里兰州Media Cybernetics股份有限公司。1.3 分组及干预措施
将24只家兔随机分为对照(C)组、单纯电刺激(E)组、自然恢复(NR)组和电刺激治疗(EST)组,每组6只。C组允许家兔自由活动7周;E组家兔先自由活动4周,随后进行3周每天20 min频率为10 Hz、电流强度为5 mA的LFES治疗;NR组家兔左膝关节管型石膏固定4周后建立兔膝关节伸直挛缩模型,随后拆除石膏,自然恢复3周;EST组采用同样的方法将家兔左膝关节用管型石膏固定4周,随后拆除石膏进行3周每天20 min频率为10 Hz、电流强度为5 mA的LFES治疗。电子针灸仪的工作方式为断续波,脉冲持续时间15 s,暂停时间5 s。电刺激的干预部位为兔左后肢股四头肌。首先,将左后肢的毛发剃除,然后将2片3 cm×3 cm的电极贴在左后肢膝关节前上方的皮肤上。两电极片之间的距离为0.5 cm。1.4 组织准备和关节活动度测量
耳缘静脉注射过量3%的戊巴比妥钠将各组家兔安乐死后,将兔左后肢于左髋关节处离断,并切断髋关节处大腿肌群的起始点,完全分离左下肢。使用本课题组前期研究设计的关节活动度测量仪测量各组家兔左膝关节在肌切开前后的活动范围(range of motion,ROM)。将股骨近端、胫骨近端和胫骨远端用金属钳固定在表盘上。所有的膝关节在施加力量前均从0 °屈曲位开始。在之前的实验中,通过测量正常家兔的ROM,发现扭矩为0.077 N.m可使家兔膝关节屈曲140 °左右。在此之后,即使继续增加扭矩,膝关节弯曲角度也很难增加。因此,以0.077 N.m为标准扭矩测量膝关节ROM, ROM测量由3名检查人员进行,每个人重复测量2次。测量结果对彼此保密,每只家兔的左膝关节活动度用重复测量结果的平均值表示。随后,分离股直肌并从中间切取2个肌肉组织样品,大小约为1 cm×1 cm×0.5 cm,一份样品用于组织学染色,另一个样品保存在-80 ℃的冰箱中用于骨骼肌纤维化蛋白的检测。最后,剔除膝关节周围的骨骼肌,再次测量兔膝关节ROM。分离兔膝关节的关节囊保存在-80 ℃的冰箱中用于关节囊纤维化蛋白的检测。肌切开前,实验组膝关节屈曲ROM较正常对照组的减少值称为总挛缩,肌切开术后屈曲ROM较对照组肌切开后ROM的减少值称为关节源性挛缩。肌源性挛缩为总挛缩和关节源性挛缩的差值。1.5 组织学检测
兔股直肌先用4%多聚甲醛(paraformaldehyde,PFA)固定,随后包埋在石蜡中。取包埋股直肌的蜡块,于肌肉中间部分垂直于肌纤维方向切片,切片层厚10 μm,每个股直肌标本取8张切片,随后各取4张切片分别按HE染色和Masson染色试剂盒说明书上的操作步骤进行染色。使用尼康倒置显微镜(型号:TE2000-U)于200倍下对切片进行观察拍摄,每张切片在200倍下随机拍摄4个视野,使用Image-Pro Plus 6.0软件测量各组兔股直肌横截面中胶原沉积百分比。1.6 Western blot
在裂解缓冲液中将兔股直肌(70~80 mg)进行匀浆、离心,取上清液进行BCA蛋白定量。用12.5%SDS-PAGE电泳凝胶分离总的溶解产物(每孔8~20 μg),然后将凝胶中分离的目的蛋白转移到PVDF膜上。用5%的脱脂牛奶(溶解于由Tris和Tween-20配制的TBST缓冲液)室温孵育90 min后,将膜分别用TGF-β1(1 ∶10 000)、α-SMA(1 ∶10 000)或GAPDH(1 ∶50 000)一抗孵育1~2 h。随后用TBST每8 min洗1遍,共3遍。再用辣根过氧化物酶标记的羊抗小鼠IgG二抗(bs-0296G,1 ∶10 000,bioss)孵育90 min。最后,再用TBST将膜洗涤3遍。将ECL化学发光液滴加到目的条带的位置,用数字成像设备检测该信号。Western blot结果重复3遍。用Image J软件对各个条带灰度值进行半定量分析。将目的条带与各组间内参条带(GAPDH)的灰度值的比值进行比较,最终确定Western blot结果差异是否有统计学意义。
2 结果
2.1 关节活动度测量仪检测肌肉切开前后兔左膝关节ROM
如表1所示,经过4周石膏固定,解除固定自然恢复3周,C组、E组、NR组和EST组总的关节挛缩角度相比差异有统计学意义(F
=52.780,P
<0.05);4组肌源性挛缩角度相比差异有统计学意义(F
=69.061,P
<0.05);4组关节源性挛缩角度相比差异有统计学意义(F
=45.889,P
<0.05)。其中,NR组的总挛缩、肌源性挛缩和关节源性挛缩相对于C组和E组均有所增加(P
<0.01);经过4周石膏固定和3周LFES治疗后,EST组的总挛缩、肌源性挛缩和关节源性挛缩相对于C组和E组均增加(P
<0.01);与NR组相比,EST组的总挛缩和肌源性挛缩减轻(P
<0.01),关节源性挛缩未见改善。
表1 4组新西兰白兔挛缩角度测量比较
2.2 各组骨骼肌纤维间间质表达和胶原沉积情况
与C组相比,HE染色结果提示,NR组和EST组中均出现了不同程度的间质增多,间质中可见细胞核呈梭形的成纤维细胞,其中NR组较EST组增多的较为明显。Masson染色结果进一步表明,经过4周固定处理的家兔骨骼肌样品中,即使经过3周的自然恢复或电刺激治疗,骨骼肌纤维间仍存在不同程度的胶原纤维沉积。但NR组和EST组相比,EST组的胶原纤维沉积更少。骨骼肌Masson染色的定量分析结果显示,4组骨骼肌胶原沉积水平相比差异有统计学意义(F
=66.436,P
<0.05)(图1),与C组相比,NR组和EST组的股直肌中纤维化面积增高(P
<0.01),但EST组的骨骼肌纤维化面积低于NR组(P
<0.01)。
图1 组织学检测结果比较 × 200与C组比较:**P<0.01;与E组比较:##P<0.01;与NR组比较:&&P<0.01
2.3 各组股直肌中TGF-β1 和α-SMA的蛋白表达
4组股直肌中TGF-β1、α-SMA蛋白的相对表达量差异有统计学意义(F
=13.985,P
<0.05;F
=15.030,P
<0.05)。如图2所示,与C组比较,E组的股直肌中TGF-β1和α-SMA蛋白表达差异无统计学意义;与C组比较,NR组的TGF-β1和α-SMA的蛋白表达升高(P
<0.05);与C组相比,EST组的TGF-β1蛋白表达升高(P
<0.01),α-SMA蛋白表达也相应升高(P
<0.05);与E组比较,NR组的TGF-β1 蛋白表达升高(P
<0.05),α-SMA蛋白表达升高(P
<0.05);EST组和E组相比,TGF-β1的蛋白表达未见差异,α-SMA蛋白表达升高(P
<0.05);与NR组比较,EST组的TGF-β1和α-SMA蛋白表达降低(P
<0.05)。
图2 各组股直肌纤维化蛋白检测与C组比较:*P<0.05, **P<0.01;与E组比较:#P<0.05;与NR组比较:&P<0.05
2.4 各组关节囊中TGF-β1 和α-SMA的蛋白表达
4组关节囊中TGF-β1蛋白的相对表达量差异有统计学意义(F
=33.580,P
<0.05),4组关节囊中α-SMA蛋白的相对表达量差异有统计学意义(F
=17.307,P
<0.05)。如图3所示,与C组比较,E组关节囊中TGF-β1和α-SMA蛋白表达差异无统计学意义;与C组比较,NR组的TGF-β1和α-SMA蛋白表达升高(P
<0.01);与C组比较,EST组的TGF-β1蛋白表达升高(P
<0.01),α-SMA蛋白表达也升高(P
<0.05);与E组比较,NR组的TGF-β1 蛋白表达升高(P
<0.01),α-SMA蛋白表达升高(P
<0.01);与E组比较,EST组的TGF-β1蛋白表达升高(P
<0.01),α-SMA蛋白表达也升高(P
<0.05);与NR组比较,EST组的TGF-β1和α-SMA蛋白表达差异无统计学意义。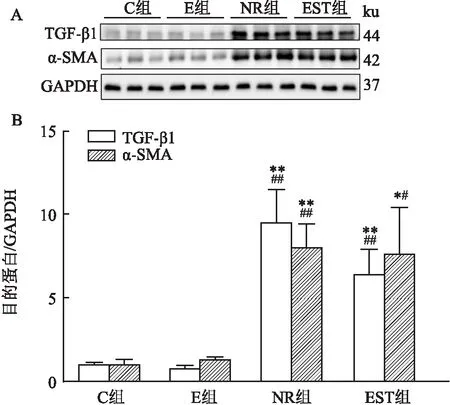
图3 各组关节囊纤维化蛋白检测与C组比较:*P<0.05, **P<0.01;与E组比较:#P<0.05,##P<0.01
3 讨论
已有的膝关节挛缩研究所使用的动物模型大多为屈曲型关节挛缩模型,屈曲固定使动物膝关节伸直活动受限,但这不符合膝关节伸直位固定的临床实际。为了更接近于临床,本研究使用管型石膏外固定建立了伸直型兔膝关节挛缩模型。
既往研究表明,关节周围组织纤维化,尤其是骨骼肌和关节囊的纤维化在关节挛缩形成过程中发挥着重要作用,但具体哪种组织纤维化在关节挛缩形成中作用更为显著,以及康复干预后对哪种组织纤维化的影响更为明显,研究比较匮乏。本研究探讨了早期LFES对骨骼肌纤维化和关节囊纤维化的各自影响,以明确LFES是通过抑制骨骼肌纤维化还是关节囊纤维化来改善关节挛缩。实验显示,膝关节固定4周后即使经过3周的自然恢复或LFES治疗,仍存在不同程度的肌源性和关节源性挛缩。经过3周LFES治疗后总挛缩和肌源性挛缩角度均减小,关节源性挛缩角度未见改善。提示早期LFES主要通过减轻肌源性挛缩来改善兔膝关节挛缩。HE染色结果显示,经过固定处理后NR组和EST组股直肌肌纤维间均出现不同程度的间质增多,间质中可见细胞核呈梭形的成纤维细胞。Masson染色的结果进一步证实,EST组的股直肌纤维化较NR组明显减轻,提示早期LFES可能是通过减轻骨骼肌纤维化来改善兔膝关节挛缩。
TGF-β1与组织纤维化的关系密切。组织在创伤修复的早期阶段大量分泌TGF-β1,促进局部间质组织的增殖和分化。本课题组前期研究显示,在关节挛缩的形成过程中,TGF-β1的表达增高,在关节挛缩的形成过程中发挥着重要作用。在复杂的纤维化信号网络中,TGF-β1/α-SMA通路已被广泛认为可诱导组织肥厚和纤维化。肌成纤维细胞可在细胞内表达α-SMA,α-SMA是细胞的一种骨架蛋白,在创伤后组织的修复过程中,有增加组织张力、促进伤口收缩愈合的作用。α-SMA的高表达可以增加纤维组织的黏着程度,是纤维组织收缩过程中重要的分子学因素。α-SMA可通过细胞膜上的整合素作用于细胞外基质,从而影响细胞外基质的构成,导致关节周围组织的纤维化,促进了关节挛缩的形成。本研究显示,经过固定处理后NR组和EST组骨骼肌和关节囊中纤维化蛋白TGF-β1和α-SMA均发生不同程度的升高,提示TGF-β1/α-SMA通路的激活可能是导致关节挛缩的分子机制。经过3周的LFES处理后,EST组的骨骼肌中TGF-β1和α-SMA的表达量相对于NR组降低,但EST组关节囊中TGF-β1和α-SMA的蛋白表达量相对于NR组未见差异。提示早期LFES主要是通过降低骨骼肌纤维化水平进而改善关节挛缩。
本研究存在一定的局限性:首先,本实验仅进行了TGF-β1/α-SMA纤维化信号通路的研究,没有做其他相关信号通路的研究。其次,本实验仅研究了固定早期LFES对膝关节挛缩角度的影响,膝关节挛缩形成后期(4周以后)的康复干预对关节挛缩的长期愈后具有更重要的临床意义。因此,本课题未来的研究将着重于对关节源性挛缩的探索,以期找到治疗关节挛缩更为有效的方法。
