制备脱细胞全喉-下咽-食管复合支架用于咽喉重建的实验研究
2021-11-05吕蝶侯楠徐小丽卢彦青李京芝马瑞娜崔鹏程
吕蝶,侯楠,徐小丽,卢彦青,李京芝,马瑞娜,崔鹏程
(1.成都医学院第一附属医院 耳鼻咽喉头颈外科, 四川 成都 610599; 2.中国人民解放军空军军医大学唐都医院 耳鼻咽喉头颈外科, 陕西 西安 710038)
头颈部肿瘤的发病率较高,约占肿瘤发病率的第6位。据报道每年世界范围内头颈肿瘤的新增例数为686 000例,因头颈肿瘤死亡的例数为376 000例[1-2]。头颈肿瘤中部分类型的肿瘤由于其发病机制的不同,易并发多源性肿瘤,如食管癌的患者同时并发下咽癌或者喉癌。因而手术中同时切除下咽、部分喉或全喉及食管的案例并不少见。但大面积缺损后所面临的器官修补及功能重建则是临床医生的一大挑战。
随着组织工程技术的快速发展,体外构建具有功能的器官或组织为器官重建提供了新思路。常用的支架材料主要包括人工材料及天然材料。细胞外基质(extracellular matrix, ECM)作为天然架材料,由于具有细胞生长的天然微观结构及生物微环境的优点,成为目前组织工程研究的热点。灌注法脱细胞技术可制备天然ECM支架,Ott团队首用灌注脱细胞的方法成功制备了保留天然结构的三维的无细胞心脏ECM支架,并成功模拟出具有一定收缩功能的心脏组织[3]。后来有大量文献报道用脱细胞的方法制备了肾、肝、胰腺、肺、食管、二尖瓣等脱细胞支架[4-10]。目前尚未有制备脱细胞全喉-下咽-食管复合支架用于下咽癌术中咽喉重建的文献报道。前期我们已参考Ott灌注法技术制备了天然脱细胞食管支架及喉支架,支架保留了ECM的复杂结构与成分,具有体外构建具有工程的食管或喉支架的可行性[11-14]。本实验我们采用上述灌注法制备天然脱细胞全喉-下咽-食管复合支架,并复合骨髓间充质干细胞(bone marrow mesenchyml stem cells, BMSCs),意在为下咽癌咽喉重建提供一种新型修补材料。
1 材料与方法
1.1 实验材料
3月龄新西兰大白兔36只,体重约3.0 kg;4周龄10只,体重约0.5 kg;雌雄不限,均由成都医学院动物实验中心提供。十二烷基硫酸钠(SDS)、曲拉通(TritonX 100)、淋巴细胞分离液、L-DMEM 培养基、腺苷、肝素、水合氯醛及胰蛋白酶均为Sigma公司产品。胎牛血清购于杭州四季青生物制品公司。青霉素、链霉素由哈尔滨制药厂生产。扫描电镜(Hitachi公司,日本);倒置显微镜(Nikon 公司,日本)。
1.2 制备去细胞全喉-下咽-食管复合支架
3月龄新西兰大白兔30只,用3.5 mL/kg 10%水合氯醛行腹腔麻醉,将大白兔仰卧固定于专用手术台上,颈部备皮,手术在无菌条件下进行。沿左侧耳缘静脉全身肝素化后常规消毒铺巾,纵行切开颈前正中皮肤,逐层分离皮下组织、颈前带状肌致充分暴露喉、下咽、气管及双侧颈总动脉,保留咽升动脉、甲状腺上动脉及喉上动脉,结扎颈外动脉其余分支及分支供应的肌肉,游离出带血管的完整喉体-下咽-食管复合体,用静脉输液针行颈总动脉插管,采用输液泵持续灌注脱细胞剂,灌注速度为50 mL/h。灌注顺序参照Ott 等报道的方法:首先将含有肝素和腺苷的磷酸盐缓冲生理盐水液灌注15 min,然后用含有1%SDS的去离子水灌注16 h,去离子水灌注15 min,再用1%Triton X的去离子水灌注30 min,最后用含双抗的磷酸盐缓冲生理盐水冲洗48 h。全喉-下咽-食管复合体离体后所有操作均在无菌操作台中进行。将制备的去细胞支架进行大体观察、HE染色[12]、免疫荧光染色[15]、CCK-8检测[16]等检测。
1.3 原代BMSCs的分离及提取
取4周龄新西兰大白兔(10只),体重约0.5 kg,10%水合氯醛3.5 mL/kg 经腹腔注射麻醉后备皮,将兔侧卧位置于无菌操作台上,碘伏消毒后铺洞巾,用16号骨髓穿刺针自股骨大转子处穿刺抽取骨髓,注入离心管中,加入适量肝素并适当振动离心管,加入等体积L-DMEM培养液,轻轻吹打成细胞悬液。按2∶1的体积比将细胞悬液加入淋巴细胞分离液的离心管中,在离心机中以1 500 r/min速度离心15 min,取出后液体分为4层,用移液枪吸取第2层移至无菌的离心管中,加入等体积的不完全L-DMEM培养液混匀后1 500 r/min离心10 min,弃上清液,重复此操作 2 遍。向离心管中加入10%胎牛血清吹打成细胞悬液,接种培养皿中,置于 5%CO237℃培养箱中培养,3 d后首次换液,以后每2天换1次液。细胞铺满瓶底约80%~90%时用0.2%胰蛋白酶(含0.02%ETA) 消化,以 1∶3 接种传代。
1.4 再细胞化支架的制备、表征及体内异位移植
将细胞计数为(7~9)×106个/mL 的细胞悬液用显微注射针多点注射脱细胞支架的ECM,每次每点注射200 μL,将再细胞化的复合体支架置于含血清的培养基中,5%CO2、37℃培养箱中孵育1 d,SEM观察体外再细胞化支架上细胞的粘附情况。按上述麻醉方式成功麻醉受体兔后将其固定于手术操作台,手术在无菌条件下进行。腹部脱毛后常规消毒铺单,于剑突下约行长约2 cm的纵行切口,逐层分离皮下组织至腹膜,打开腹膜暴露大网膜,将包裹于大网膜内,可吸收线缝合固定,逐层缝合腹部。术后常规肌肉注射青霉素3 d,每天消毒伤口,预防感染。1周后取出细胞-支架复合物,HE染色观察细胞在支架上的生长情况。
1.5 去细胞全喉-下咽-食管复合支架的体内异位移植
取3月龄新西兰大白兔作为受体兔,随机分为对照组及实验组(每组3只),将去细胞全喉-下咽-食管复合支架及新鲜复合体支架按上述操作行异体异位移植,分别于埋植后 4、 8周及12周时处死受体兔,取出支架行HE染色,观察周围组织对支架的免疫反应。
1.6 统计学方法
采用 SPSS 15.0 统计软件进行分析。组间比较采用独立样本t检验;检验水准α=0.05。
2 结果
2.1 去细胞全喉-下咽-食管复合支架大体观
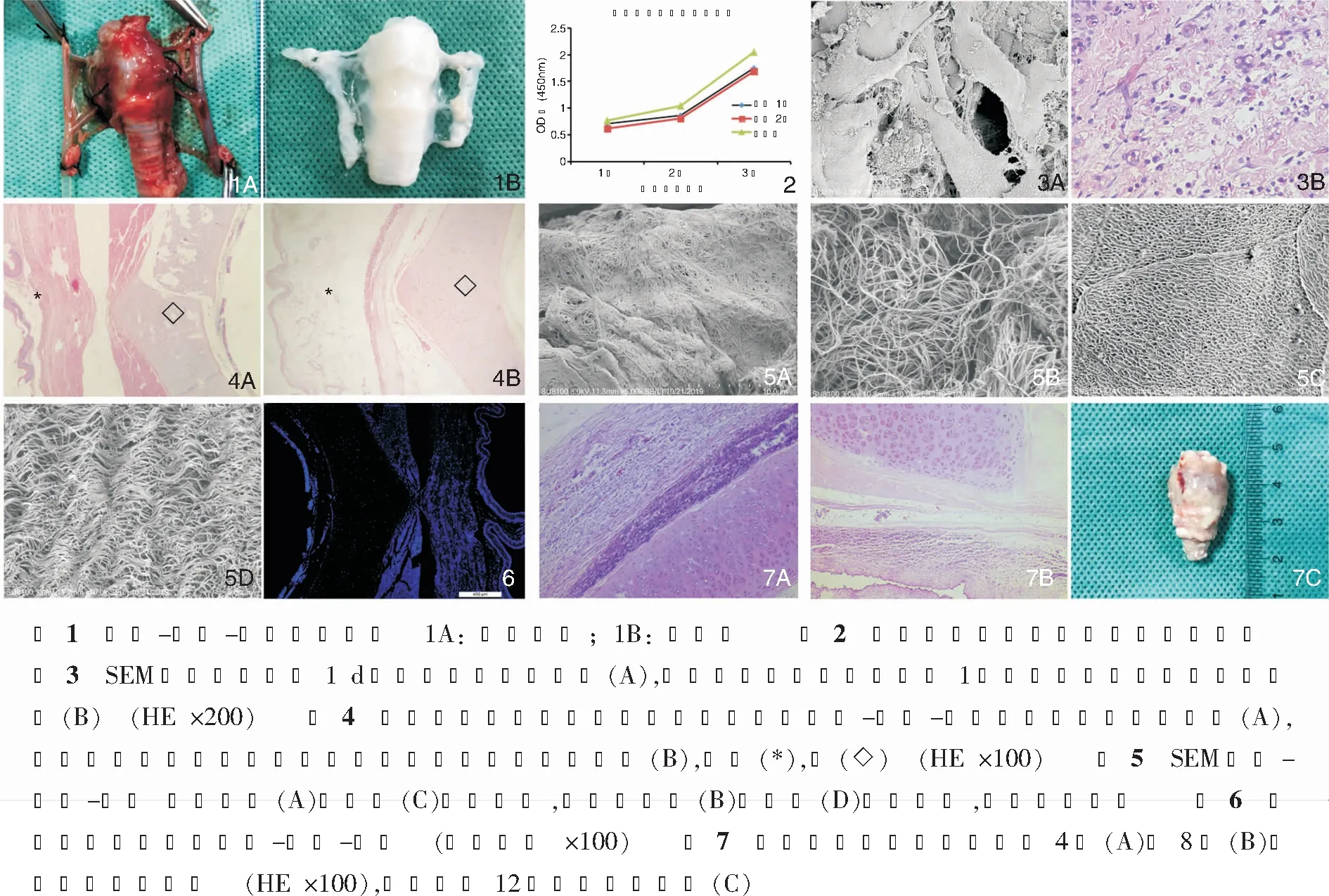
脱细胞全喉-下咽-食管复合支架灌注后体积与新鲜支架无明显差异,喉肌、食管、下咽组织保留完整,组织呈苍白透明状,新鲜组织呈鲜红色。见图1。
2.2 再细胞化的表征
去细胞支架具有良好的生物相容性,与对照组相比,对细胞生长的影响无明显差异(P>0.05)。见图2。
细胞-支架复合物体外培养1 d后扫描电镜(scanning electron microscope, SEM)显示细胞成功粘附于去细胞支架上,细胞形态较大,呈梭形。见图3A;HE染色显示体内移植1周后细胞在支架上粘附并增殖生长,细胞形态呈梭形,体积较大。见图3B。
2.3 去细胞化支架的表征
HE染色显示除喉软骨细胞保留外其余组织无细胞成分残留,仅剩ECM,且ECM三维结构保存完整,而新鲜组织内细胞成分存在。见图4。
SEM显示去细胞喉肌及食管仅剩三维的、蜂窝状的ECM,结构完整、清晰,无细胞结构残留,而新鲜组织致密。见图5。
免疫荧光染色显示脱细胞支架中ECM无主要组织相容性复合体Ⅱ(MHCⅡ)存在,ECM不具备免疫原性,软骨组织表面MHCⅡ表达较弱,DAPI染色显示脱细胞支架除软骨组织外其余组织均无细胞核残留。见图6。体内移植4周后支架被大网膜完全包裹,HE染色显示去细胞支架周围组织的免疫反应明显弱于对照组,脱细胞支架内残留细胞成分的喉肌炎症反应明显重于其他无细胞残留的ECM。8周后去细胞支架体积明显缩小,周围组织炎症较4周时减轻,对照组受体兔均未活至第8周,12周时去细胞支架仅剩喉软骨,ECM完全降解。见图7。
3 讨论
头颈肿瘤由于其自身独特性,常并发多源肿瘤,如食管癌并发下咽癌、喉癌。这类患者通常采用手术联合放化疗,但由于肿瘤浸润范围广,术中切除范围大,咽喉解剖结构及功能重建成一大难题。目前,临床上大多采用自身异位组织瓣修补缺损,虽然这可避免免疫排斥反应,但这类方式也有其自身缺陷。一方面,用自身皮瓣异位修补咽喉缺损会对患者造成二次伤害,且一旦皮瓣坏死,难以进行多次修补,另一方面,咽喉部解剖结构复杂、功能较多,这种方法不能完成功能的重建,无法避免对患者术后吞咽、发音等功能的损伤。本实验采用灌注法制备去细胞全喉-下咽-食管复合天然生物支架,保留天然咽喉-食管的解剖结构及ECM成分,意在为下咽癌术中缺损提供一种新型修补材料。
ECM是由细胞合成、分泌的生物大分子,主要包括间质和细胞周围基质。间质主要是一种以Ⅰ型和Ⅲ型胶原蛋白、纤连蛋白、弹性蛋白和多种蛋白聚糖为主要成分的松散的胶原纤维网络结构。细胞周围基质是由IV型胶原蛋白、层粘连蛋白、巢蛋白以及硫酸乙酰肝素蛋白聚糖等构成的蛋白网络结构[17]。他们共同为细胞提供生长附着的三维空间结构,同时影响着细胞的增殖、迁移、分化、凋亡等生理活动[18-19]。组织工程技术的三大基本要素包括种子细胞、生长因子和支架材料。种子细胞即具有干细胞潜能的细胞,通过迁移、增殖及分化参与组织工程的重建。三大要素缺一不可,而ECM同时具有生长因子及支架材料两重功能,所以构建天然脱细胞全喉-下咽-食管复合支架可为下咽咽喉重建提供新材料。异体支架修补缺损可避免自身皮瓣修补造成二次伤害,且来源丰富,能满足皮瓣坏死后的再次修补。但机体对异体材料的免疫排斥是其面临的最大问题。组织的主要组织相容性复合体为MHCI和MHCII,主要存在于细胞表面,而ECM无免疫原性[20]。本研究通过甲状腺上动脉灌注1%SDS及曲拉通去除全喉-下咽-食管的细胞结构及成分,以此消除异体支架的免疫原性,同时保留天然ECM的结构及成分。本实验对脱细胞全喉-下咽-食管复合支架进行组织学分析证实脱细胞支架已完全去除除软骨细胞外的所有细胞,仅剩ECM。且ECM保留了完整的呈蜂窝状天然结构,这与张建团队研究脱细胞肌肉支架的结果相同,且他们的研究结构表示通过灌注法制备的脱细胞支架能保留微血管床,利于脱细胞支架体内再血管化[21]。ECM是细胞进行增殖、迁移、分化、凋亡等一系列生物活动的场所,结构复杂,呈蜂窝状,人工支架材料难以模拟。它由细胞合成、分泌的大分子组成,成分众多,种类丰富,影响着细胞的生长生理活动,而人工材料成分较为单一,不具有天然ECM的成分复杂性[22]。
软骨组织不具免疫原性或仅具低免疫原性[23]。Ma等[15]异体异位移植全喉3个月后发现去细胞喉支架ECM成分完全降解,喉软骨未被破坏,且包裹去细胞喉支架的大网膜仅具弱炎症反应,证实了喉软骨的低免疫原性,提示软骨组织进行异体修补具有可行性。本研究中我们将去细胞全喉-下咽-食管复合体异位种植于受体兔大网膜内,1个月时去细胞复合体大体结构尚完整存在,包裹处大网膜稍增厚,3个月后取出支架,发现喉软骨仍存在,ECM完全降解。而对照组的受体兔大网膜放置新鲜全喉-下咽-食管复合体后均于术后1周内死亡。支架周围充满脓性分泌物,组织结构被破坏,且大网膜与周围组织粘连严重,对照组受体兔死因考虑是机体的超急性免疫排斥反应或腹腔严重粘连导致肠梗阻。体内实验表明本实验制备的去细胞复合体仅具低免疫原性,有作为异体材料进行重建咽喉的潜力。Ott团队通过灌注法制备去细胞肾脏系统,且成功原位移植于异体兔内,并产出原尿[8]。本实验未进行原位移植的原因为维持动物鼻饲肠内营养难以维持,动物无法配合,肠外营养操作困难、对实验室条件要求高,故本实验采用异位移植。
通过CCK-8法检测去细胞支架的细胞生物相容性,去细胞支架提取物对细胞生长无抑制作用,体外将细胞种植于去细胞支架上,SEM证实细胞在支架上成功粘附,体内种植1周后HE染色提示种子细胞在支架上粘附并生长。且支架周围仅有少量炎症细胞浸润,提示脱细胞支架具有良好的生物相容性及低免疫原性,且脱细胞全喉-下咽-食管支架复合种子细胞制备天然器官具有可行性。Citro等[10]团队用灌注法脱细胞技术获得肺脏ECM,再复合种子细胞成功制备出具有一定分泌功能的胰岛。咽喉部解构机构复杂,由多个喉软骨、声韧带、喉肌、梨状窝、环后隙等结构组成,且食管为下咽向下延伸形成,组织结构相同,下咽癌常侵及食管,人工材料支架及自体皮瓣难以模拟天然的咽喉解剖结构。且咽喉部同时兼具吞咽、呼吸及发音的功能,术中构建具有功能的咽喉显得尤为重要。
本实验表明通过颈总动脉灌注去离子剂制备脱细胞全喉-下咽-食管支架,且脱细胞复合支架保留了天然ECM的结构及成分,支架几乎无免疫原性,有作为异体移植修补材料的潜能,可避免自身组织瓣移植对患者造成的二次伤害,同时能解决自体皮瓣及人工材料均无法满足细胞生长天然环境的复杂三维结构及稳态环境的问题。但本实验目前尚未完成对脱细胞全喉-下咽-食管支架的体外功能重建,下一步我们将分化诱导后的干细胞复合于脱细胞支架,意在构建出具有一定收缩功能的的食管及喉肌。
4 结论
下咽癌患者确诊时多已进入晚期,手术切除范围大,术中咽喉重建是目前临床上面临的难题。我们的实验证实了通过颈总动脉灌注1%SDS及曲拉通制备的脱细胞全喉-下咽-食管支架,可天然ECM的结构和成分,同时仅具低免疫原性,具有成为天然异体支架修补下咽癌缺损的前景。
