麦麸阿魏酰低聚糖对大鼠肝脏抗氧化功能的影响
2021-11-04王文文段元霄孟子琪安晓萍齐景伟
王文文 段元霄 王 园* 孟子琪 安晓萍 齐景伟
(1.内蒙古农业大学 动物科学学院,呼和浩特 010018;(2.内蒙古自治区草食家畜饲料工程技术研究中心,呼和浩特 010018;(3.内蒙古自治区农牧业科学院 动物营养与饲料研究所,呼和浩特 010031)
动物机体的正常生理代谢、外源性刺激及内源性刺激均会产生自由基(Reactive oxygen species, ROS),大量的自由基累积会损伤DNA、蛋白质及脂质等生物大分子,产生氧化应激。研究发现,氧化应激会以肝脏为靶点,损伤肝细胞结构和功能,进而造成机体正常生理功能障碍[1]。此外,肝脏作为抗脂质过氧化损伤的中心器官, 其抗氧化能力的高低对机体抵抗氧化应激有重要作用。多项研究表明,摄食多糖、多酚和黄酮等生物活性物质可提高肝脏抗氧化能力,缓解氧化应激,有利于改善动物健康状况[2-3]。
研究发现,摄食全谷物可以预防与氧化应激相关的疾病,如心血管疾病、2型糖尿病和癌症等[4]。因小麦麸皮中富含酚酸类化合物和非淀粉多糖,利用其制备出的麦麸阿魏酰低聚糖(Feruloyl oligosaccharides,FOs),具有良好的抗氧化效果[5]。Zhao等[6]体外试验结果发现,从小麦麸皮中制备出4种不同聚合度的FOs,均具有清除DPPH(1,1-diphenyl-2-picrylhydrazyl)自由基、超氧化物自由基和羟自由基的作用。Wang等[7]研究结果表明,用FOs处理体外培养的人淋巴细胞,可缓解细胞中的DNA氧化应激损伤。本课题组前期研究结果也表明,利用微生物发酵法制备的FOs有良好的体外抗氧化功能,可有效清除DPPH自由基和羟基自由基[8]。然而,上述关于FOs的抗氧化作用研究多集中在体外试验上,其是否会对体内肝脏抗氧化能力产生影响鲜有报道。因此,本研究以SD大鼠为模型,分析FOs对其肝脏抗氧化酶活力、抗氧化物质谷胱甘肽(Reduced glutathione,GSH)、氧化代谢产物8-羟基脱氧鸟苷(8-hydroxy deoxyguanosine,8-OHdG)、抗氧化相关基因mRNA表达水平及蛋白表达水平的影响,以期为微生物发酵法制备的FOs在动物生产中的应用及其对肝脏抗氧化机制研究提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1麦麸FOs的制备
参照郝希然[8]的方法制备麦麸FOs。以小麦麸皮为原料,利用枯草芽孢杆菌(Bacillussubtilis)、地衣芽孢杆菌D3(BacilluslicheniformisD3)和酿酒酵母(Saccharomycescerevisiae)进行混菌发酵。发酵结束后,将发酵样品烘干、粉碎,经过水提、去蛋白、分级醇沉等一系列操作得到FOs粗提物。通过大孔树脂Amberlite XAD-2对FOs粗提物进行分离纯化,获得的FOs的质量浓度为2 668.34 nmol/g,其单糖组成主要是阿拉伯糖和木糖,并进行动物试验。
1.2 试验方法
1.2.1试验设计
试验选取40只健康断奶雄性SD大鼠,购于北京维通利华公司(动物质量合格证号:1100111911029973),按体重相近的原则完全随机设计分为5个组,正常对照组:生理盐水;阳性对照组:w(Vc)=100 mg/kg;低剂量组、中剂量和高剂量组分别灌胃FOs的剂量分别为:w(FOs)=20 mg/kg,w(FOs)=40 mg/kg,w(FOs)=80 mg/kg,加入Vc和FOs的剂量均以每kg体重为基础,如其中w(Vc)=100 mg/kg表示每kg体重加入Vc的剂量为100 mg,每个处理8只SD大鼠。
1.2.2饲养管理
本研究在内蒙古农业大学动物科学学院进行,常规饲养管理,自由采食、饮水。饲养期21 d,每日定时灌胃生理盐水、Vc及FOs水溶液1 mL。大鼠基础饲粮购于江苏协同医药生物工程有限公司。
1.3 样品采集
试验结束后,乙醚致晕,剖开腹腔,收集肝脏组织,液氮速冻后将样品存于-80 ℃冰箱中待测。
1.4 测定指标及方法
1.4.1肝脏抗氧化指标测定
取适量肝脏组织,加磷酸盐缓冲液(PBS, 0.01 mol/L, pH 7.4)制备10%(质量)组织匀浆,3 000 r/min 离心10 min,取上清液用于抗氧化相关指标测定。总抗氧化能力(Total antioxidant capacity, T-AOC)、过氧化氢酶(Catalase, CAT)、谷胱甘肽过氧化物酶(Glutathione peroxidase, GSH-Px)及超氧化物岐化酶(Superoxide dismutase, SOD)活性测试盒以及谷胱甘肽(Reduced glutathione, GSH)和8-羟基脱氧鸟苷(8-hydroxy deoxyguanosine, 8-OHdG)含量测试盒均购自武汉基因美生物科技有限公司。所有操作均按说明书进行。
1.4.2mRNA表达水平的检测
采用Trizol法提取肝脏组织总RNA。经微孔板分光光度计测得A260 nm和A280 nm比值为1.8~2.0,琼脂糖凝胶电泳法评价RNA质量。参照FastQant RT Kit(with gDNase)说明书分别将各样品的总RNA进行逆转录合成cDNA,并以此为模板,使用表1所列的引物,按照 SuperReal PreMix Plus(SYBR Green)说明书进Real-time PCR检测。以β-肌动蛋白(β-actin)为内参,谷氨酸-半胱氨酸连接酶催化亚基(Glutamate cysteine ligase catalytie subunit,GCLC)、醌氧化还原酶1(NAD(P)Hquinoneoxidoreductasel,NQO1)、谷氨酸-半胱氨酸连接酶调节亚基(Glutamate cysteine ligase modifiersubunit,GCLM)、血红素氧合酶(Hemeoxygenasel,HO-1)、CAT、SOD、GSH-Px及Nrf2的相对表达量采用2-ΔΔCt法进行计算。引物由生工生物(上海)股份有限公司合成,详细信息见表1。

表1 抗氧化基因的引物序列信息Table 1 Information of primer sequences of antioxidant genes
1.4.3蛋白表达水平的检测
用蛋白裂解液裂解肝脏组织后,取上清液用BCA蛋白浓度试剂盒(Thermo,美国)测定上清液中总蛋白含量,然后在100 ℃下煮沸5 min使样品蛋白质变性,待样品冷却至室温,加入到制备好的聚丙酰胺凝胶中,每孔上样30 μg总蛋白。80 V恒压电泳到分离胶顶端,120 V恒压电泳至溴酚蓝接近分离胶底部,直至分离出目的蛋白条带。随后在4 ℃、100 V条件下将蛋白转移到硝酸纤维素膜上,室温下封闭1 h,然后经一抗Nrf2抗体和β-actin抗体(1∶1 000,Biorbyt,英国)及二抗山羊抗兔IgG H&L抗体(1∶10 000,Abcam)孵育后,用ECL显色液进行荧光显色,置于蛋白凝胶成像仪(GE Healthcare,美国)下成像,利用Image J 软件进行目的蛋白定量分析,得到肝脏组织中Nrf2和β-actin蛋白表达量。
1.5 统计分析
本研究数据采用SAS 9.2统计软件GLM模型进行统计分析,空白处理组和不同剂量FOs处理组分别进行单因素方差、线性及二次趋势分析,同时使用contrasts语句进行不同处理间的两两比较。试验结果均以平均值和标准误表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 不同剂量FOs对大鼠肝脏抗氧化指标的影响
由表2可知,灌胃不同剂量的FOs均可极显著提高SOD和GSH-Px的活性(P<0.01),极显著减低8-OHdG含量(P<0.01),但对T-AOC,CAT和GSH等抗氧化相关指标无显著影响(P>0.05)。随着FOs剂量增加,SOD和GSH-Px活性呈二次方增加,而8-OHdG含量呈线性和二次方下降(P<0.01)。与对照组相比,Vc组大鼠肝脏的CAT,SOD和GSH-Px活性和8-OHdG的含量显著提高(P<0.05)。与Vc组相比,FOs20组大鼠肝脏的GSH-Px活性和8-OHdG含量极显著降低(P<0.01);FOs40组大鼠肝脏的T-AOC、CAT活性和8-OHdG含量显著降低(P<0.05);FOs80组大鼠肝脏的SOD和GSH-Px活性和8-OHdG 含量显著降低(P<0.05)。此结果表明,不同剂量的FOs均可提高大鼠肝脏组织中SOD和GSH-Px的活性,均可降低氧化代谢产物8-OHdG的含量。
2.2 不同剂量FOs对大鼠肝脏抗氧化基因mRNA表达的影响
由表3所知,灌胃不同剂量的FOs可提高肝脏GCLC、CAT、SOD和GSH-Px的mRNA相对表达水平(P<0.05),但对GCLM、HO-1和NQO1的mRNA表达水平无显著影响(P>0.05)。随着FOs剂量增加,GCLC、NQO1、CAT、SOD和GSH-Px的mRNA表达水平呈二次方增加(P<0.01)。与对照组相比,Vc组大鼠肝脏的CAT和GSH-Px的mRNA表达水平显著提高(P<0.05)。与Vc组相比,FOs20组大鼠肝脏CAT的mRNA表达水平显著增加;FOs40组大鼠肝脏GCLC,NQO1,CAT,SOD和GSH-Px的mRNA表达水平显著增加(P<0.05)。此结果表明,不同剂量的FOs均可增加抗氧化酶的mRNA表达水平。
2.3 不同剂量FOs对大鼠肝脏Nrf2 mRNA表达的影响
由图1(a)所知,与对照组相比,40 mg/kg FOs可显著提高大鼠肝脏Nrf2的mRNA表达水平(P<0.05)。随着FOs剂量增加,Nrf2的mRNA表达水平呈线性和二次方增加(P<0.01)。与Vc组相比,FOs40组中大鼠肝脏Nrf2的mRNA表达水平极显著提高(P<0.01)。此结果提示,40 mg/kg FOs可增加抗氧化信号通路中Nrf2的mRNA表达水平。
2.4 不同剂量FOs对大鼠肝脏Nrf2蛋白表达的影响
由图1(b和c)所知,与对照组相比,灌胃80 mg/kg FOs可显著提高大鼠肝脏Nrf2的蛋白表达水平(P<0.05)。随着FOs剂量增加,Nrf2的蛋白表达水平呈线性增加(P<0.05)。与对照组相比,Vc组中大鼠肝脏Nrf2的蛋白表达水平显著提高(P<0.05)。此结果提示,80 mg/kg FOs可增加抗氧化信号通路中Nrf2 的蛋白表达水平。
3 讨 论
肝脏是十分重要的代谢器官,极易受到ROS的攻击,产生氧化应激。机体可以通过复杂的抗氧化体系(酶体系和非酶体系)来清除ROS,缓解氧化应激。酶体系统包括GSH-Px、CAT及SOD等[9]。SOD可促进超氧化物向H2O2转化,而GSH-Px和CAT负责将H2O2转化为水。FOs是由阿魏酸羧基与低聚糖羟基通过酯键联接而成的一种阿魏酰衍生物,同时具有阿魏酸和低聚糖的生理功能,如抗氧化、调节免疫、调节肠道菌群及益生等[10]。Wang等[11]研究发现,在杜寒杂交羔羊日粮中添加100~200 mg/kg FOs可提高其血浆中GSH-Px、CAT及SOD的活力。与上述研究结果相似,本研究表明,灌胃不同剂量的FOs均可提高肝脏组织中SOD和GSH-Px的活性,同时可增加CAT、SOD和GSH-Px的mRNA表达水平,且中剂量组中大鼠肝脏CAT、SOD和GSH-Px的mRNA表达水平高于Vc组。由此推断,FOs可增加大鼠肝脏抗氧化酶活性,提高机体抗氧化能力,且40 mg/kg FOs的抗氧化效果优于Vc。FOs的抗氧化作用可能是由于其含有阿魏酰基团和低聚糖基团,这些基团被证明具有抗氧化特性[12-13]。然而,与Vc组相比,灌胃高剂量(w(FOS)=80 mg/kg)的FOs给大鼠,对其抗氧化相关基因的mRNA表达量无影响。推测灌胃高剂量的FOs可能会对大鼠肝脏的抗氧化功能产生负面效应。此外,Maurya等[14]研究体外试验结果表明,低剂量阿魏酸有良好的抗氧化特性,而高剂量则具有促进氧化的作用。
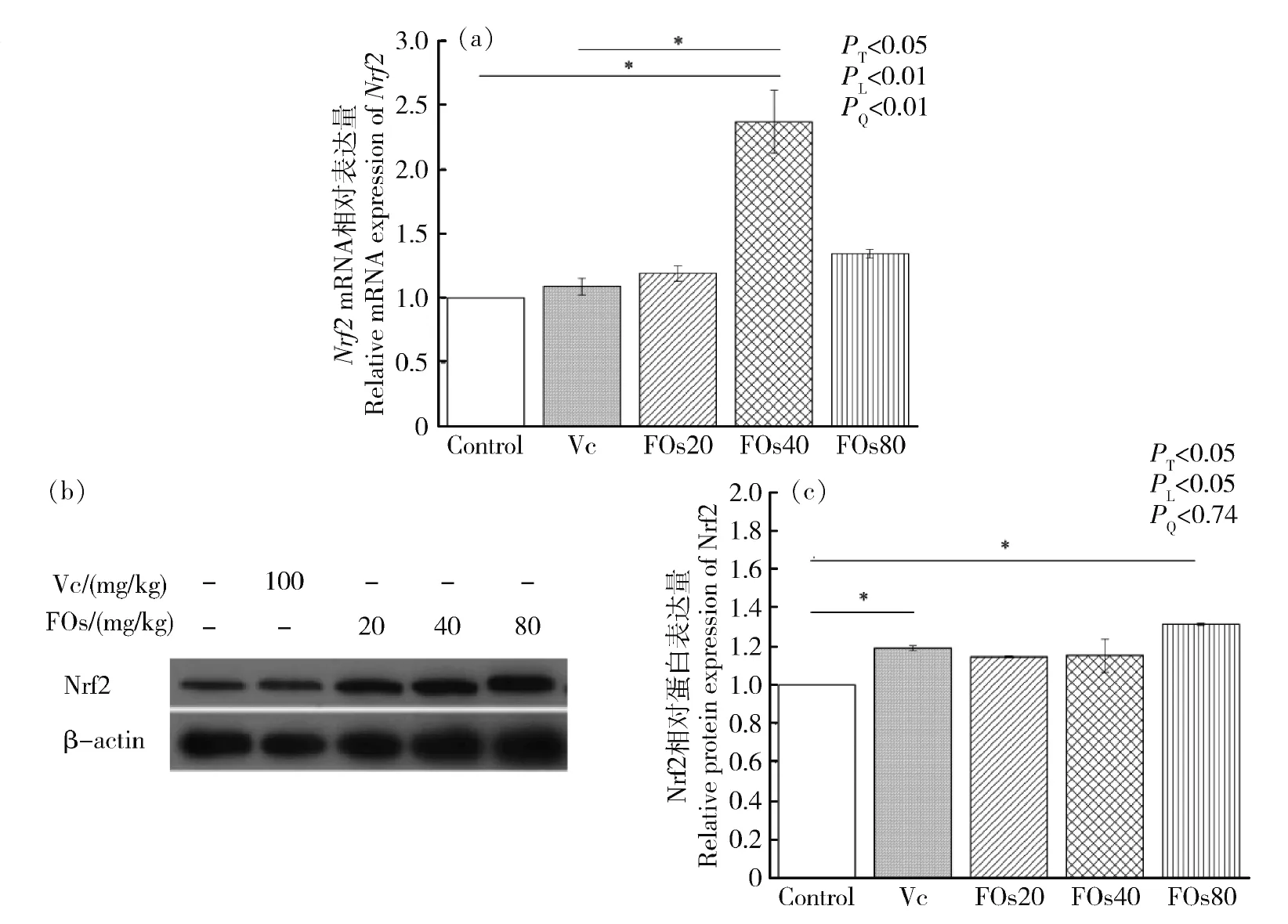
PT,处理效应;PL,线性效应;PQ,二次效应;*,P<0.05PT, treatment effect; PL, linear effect; PQ, quadratic effect; *, P<0.05图1 不同剂量FOs对大鼠肝脏Nrf2基因表达(a)和蛋白表达的影响(b)和(c)Fig.1 Effect of FOs on the mRNA expression level (a) and protein expression (b) and (c) of Nrf2 in rat liver
非酶体系包括谷胱甘肽(Reduced glutathione, GSH)、维生素C、维生素E、类胡萝卜素、丙酮酸、类黄酮、胆红素及微量元素硒等[9]。GSH主要在肝脏合成,可以提供电子,直接清除ROS,也可作为GSH-Px的底物将H2O2转化为水[15]。本研究表明,灌胃不同剂量的FOs一定程度上增加了肝脏GSH的合成,表明其可通过增加GSH的合成提高机体抗氧化能力。8-OHdG是DNA发生损伤时产生的主要有害代谢产物,是目前公认的评价氧化应激指标[16]。研究发现,FOs可缓解由H2O2诱导的人淋巴细胞氧化应激,保护DNA免受氧化应激损伤[7]。本研究发现,与Vc组相比,不同剂量的FOs均可显著降低大鼠肝脏中8-OHdG的含量,表明其可作为一种抗氧化剂缓解DNA氧化应激损伤。由此推测,FOs可通过增加非酶抗氧化剂GSH的含量和降低氧化代谢产物8-OHdG产生提高肝脏抗氧化能力。
Nrf2是目前研究最多的抗氧化信号通路关键因子之一,其可调控抗氧化酶的表达。当氧化应激发生后,Nrf2会被激活进入细胞核与抗氧化反应元件(Antioxidant response element, ARE)结合,促进HO-1、NQO1、GCLC、GCLM、CAT、SOD和GSH-Px等抗氧化相关靶基因的转录和表达[17]。HO-1可通过与金属离子螯合、修饰蛋白巯基及清除自由基等方式防御氧化应激[18]。醌类可被NQO1直接被还原成氢醌,进而减少醌类转化产生的氧自由基,从而缓解醌类物质代谢引起氧化应激损伤[19]。谷氨酸-半胱氨酸连接酶是由催化亚基GCLC和调节亚基GCLM组成的二聚体,它可以调控GSH的合成[20]。已有研究表明,摄食植物提取物可通过提高抗氧化酶的表达水平提高机体抗氧化能力。李涵等[21]研究发现,玉香参附汤能够降低大鼠心肌组织ROS水平和丙二醛含量,增强CAT、SOD活性,提高NQO1、HO-1蛋白表达量和Nrf2蛋白核转移量。此外,原江水[22]研究发现,白藜芦醇可提高老龄大鼠肝脏组织中GCLC和GCLM等基因的表达水平。与上述研究结果相似,本研究发现,灌胃FOs可提高Nrf2、GCLC和NQO1的mRNA表达水平,且中剂量组大鼠肝脏Nrf2、GCLC和NQO1的mRNA表达水平高于Vc组。此外,80 mg/kg FOs可增加抗氧化信号通路中Nrf2的蛋白表达水平。基于上述研究结果推测,FOs处理大鼠肝脏抗氧化能力的提高可能与Nrf2-ARE信号通路的关键因子Nrf2的激活有关。
4 结 论
不同剂量的FOs均可增强肝脏抗氧化酶活性,减少DNA氧化损伤,且可提高Nrf2及其下游抗氧化基因的mRNA表达水平,且以中剂量40 mg/kg BW的使用剂量效果最佳。本研究证实FOs具有良好体内的抗氧化活性,有望作为一种抗氧化剂应用于保健食品中。
