硝磺草酮抗性菌株的筛选及抗性hppd基因的克隆表达
2021-11-04张磊李林
张 磊 李 林
(1.西华师范大学 生命科学学院,四川 南充 637000;(2.南京振旭生物科技有限公司,南京 210000)
草甘膦和抗草甘膦作物的组合在农作物转基因领域超过20年的大面积持续应用,对全球范围农田杂草的控制起到了非常大的作用[1]。然而,长期高剂量使用草甘膦造成了严重的环境危害和巨大的选择压力,已经导致了40多种杂草对草甘膦产生了抗药性[2-3]。草甘膦及其抗性基因替代组合的发掘和应用,是植物转基因领域重要且紧迫的研究任务之一。
4-羟基苯丙酮酸双加氧酶(4-hydroxyphenylpyruvate dioxygenase,HPPD,EC1.13.11.27)抑制剂类除草剂是近年来新开发的一类新型白化型除草剂,其除草机理是通过竞争性抑制植物酪氨酸代谢途径中HPPD的活性,从而使质体醌和生育酚的合成受阻,间接影响了类胡萝卜素的合成和功能,使植物光合作用不能正常进行,导致杂草叶片白化,组织坏死,最终死亡[3-5]。HPPD抑制剂类除草剂广泛应用于防治玉米田中的阔叶杂草和禾本科杂草,具有环境安全性高、作物安全性好和杂草抗性产生慢等优点,被认为是替代草甘膦的转基因作物靶标除草剂[4-5]。HPPD抑制剂类除草剂主要品种有硝磺草酮、苯吡唑草酮和异噁唑草酮,其中硝磺草酮是用量最大的一类。目前,巴斯夫和先正达利用来自于燕麦的HPPD突变体AvHPPD-03开发出抗硝磺草酮的转基因大豆SYHT0H2并已进行了商业化生产[6-9],而国内仅克隆出了3个HPPD基因[10-12],尚无高抗硝磺草酮的HPPD编码基因的报道。
自然界微生物库中存在广泛的各类基因资源,本研究从除草剂污染的土壤中分离筛选到一株硝磺草酮高耐受菌株MST-5,从中克隆到硝磺草酮抗性基因Sthppd,利用E.coliBL21(DE3)对StHPPD进行了异源表达和纯化,研究了StHPPD对硝磺草酮的抗性,旨在为新型除草剂抗性基因的发掘和应用提供基础材料。
1 材料与方法
1.1 材料和培养基
L-酪氨酸购自百灵威公司(中国,上海),分子生物学试剂购自大连宝生物公司和南京诺维赞生物科技有限公司,引物及测序服务委托上海生工生物公司。其他化学试剂(分析纯)购于国药集团化学试剂有限公司。硝磺草酮、苯吡唑草酮和二酮腈(异噁唑草酮代谢物)购买自美国Sigma-Aldrich公司,分别用DMSO配置成300 mmol/L的母液,过滤除菌后保存于4 ℃冰箱。
LB培养基:NaCl 5.0 g/L,蛋白胨10.0 g/L,酵母膏5.0 g/L。基础盐培养基(MSM):NaCl 1.0 g/L,NH4Cl 1.0 g/L,KH2PO40.5 g/L,K2HPO41.5 g/L,MgSO4·7H2O 0.2 g/L,加超纯水至1 L,并调节pH至7.0。酪氨酸无机盐培养基(TMSM)为MSM培养基添加1 g/L的酪氨酸。
1.2 抗性菌株的筛选分离
土壤样品采自于南京某农药厂和安徽某农药厂表层土壤和下水道污泥。称取2.0 g样品加入到添加有2 000 μmol/L硝磺草酮的50 mL MSM培养基中,在30 ℃,180 r/m富集培养5 d。然后,将5 mL 培养物转移到50 mL新鲜的MSM培养基中,继续培养5 d。经过连续富集驯化5轮后,吸取1 mL上清培养液并稀释涂布于TMSM平板上,挑取在平板上生长的单菌落反复划线,获得纯培养物,并经革兰氏染色法筛选获得其中的阴性菌。纯化得到的革兰氏阴性菌株转接至含有500 μmol/L硝磺草酮的TMSM平板上,挑取能在平板上生长的菌株,然后转接到新的筛选平板上,转接过程中逐渐增加筛选平板上硝磺草酮的浓度以增加选择压力,最终筛选出硝磺草酮高度耐受菌株。
1.3 抗性菌株对硝磺草酮的抗性测定
为比较抗性菌株对硝磺草酮的抗性情况,将筛选得到的抗性菌株转接至TMSM液体培养基中,在30 ℃,180 r/m条件下培养至对数生长期,5 000 r/m离心收集菌体,用TMSM液体培养基重悬菌体并调节OD600为10.0,以1%的接种量分别接种到含500、1 000、2 000、3 000、4 000和5 000 μmol/L硝磺草酮的20 mL TMSM液体培养基中,设置不接抗性菌株作为对照。于37 ℃、180 r/m培养60 h后检测OD600值。
1.4 抗性菌株的16S rRNA基因序列分析及系统进化树构建
采用SDS-高盐法提取抗性菌株基因组DNA,根据16S rRNA基因通用引物27F/1492R(表1),PCR扩增抗性菌株的16S rRNA基因序列。PCR产物TA克隆至pMD18-T载体,转化至EscherichiacoliDH5α。提取阳性克隆子质粒并委托上海生工进行测序。得到抗性菌株的16S rRNA基因序列提交到在线网站EzBioCloud(https:∥www.ezbiocloud.net/)中进行序列比对。下载同源性高的模式菌株的16S rRNA基因序列,在MEGA 6.0软件中,利用邻接法构建进化树。
1.5 硝磺草酮抗性基因hppd的克隆
根据同属的StenotrophomonasindicatrixWS40T的hppd基因(Locus tag: CR918_RS17620)序列,设计引物对Sthppd-F和Sthppd-R(表1),以菌株MST-5基因组DNA为模板,PCR扩增Sthppd基因,并克隆到pMD18-T载体上,然后转化至E.coliDH5α中。提取阳性克隆子的质粒并对Sthppd基因进行测序。通过NCBI数据库中BLASTN和BLASTP对获得的Sthppd基因序列进行核酸和蛋白序列的比对分析。
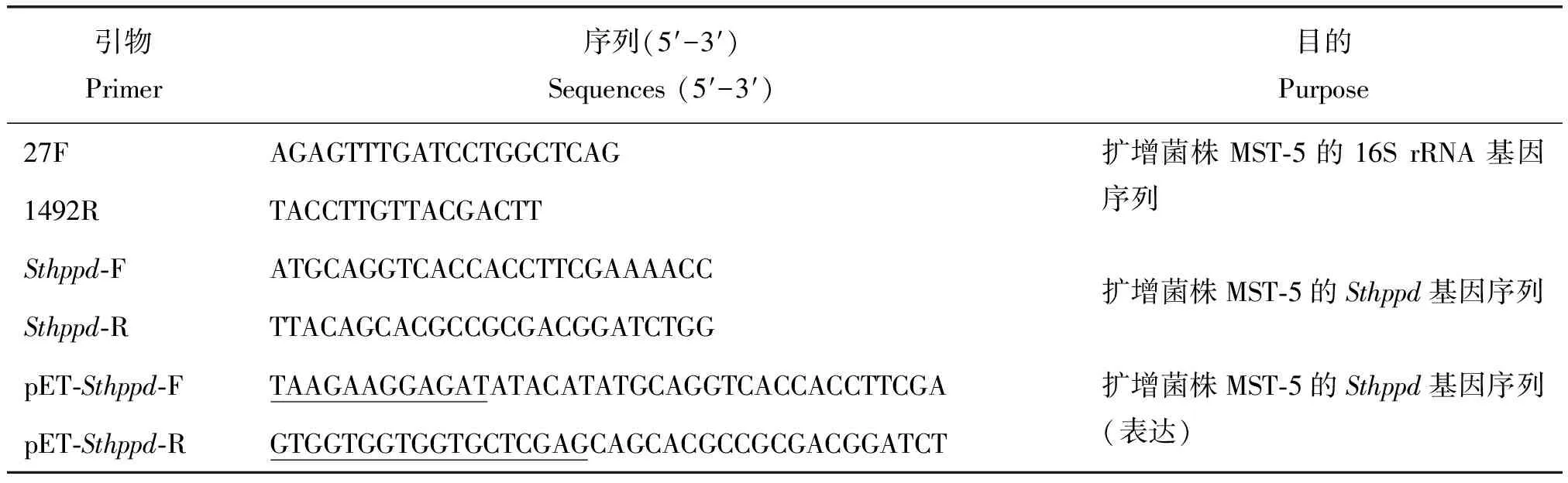
表1 引物序列Table 1 Primers used in this study
1.6 HPPD蛋白表达和纯化
以MST-5菌株基因组DNA为模板,根据引物对pET-Sthppd-F和pET-Sthppd-R,PCR扩增其hppd基因。对PCR产物进行回收纯化,然后利用同源重组的方式克隆至线性化的pET-29a(+)载体。构建好的pET-Sthppd表达载体转化至E.coliBL21(DE3)感受态细胞中。StHPPD重组蛋白在16 ℃、160 r/m摇床中过夜诱导表达,利用Co2+柱进行蛋白纯化。具体方法参考彭乾等[13]。
1.7 HPPD酶活检测
在50 mmol/L PBS(pH 7.4)缓冲溶液中添加2 mmol/L 抗坏血酸,1 mmol/L FeSO4,0.2 mmol/L 4-HPP和25 μgStHPPD,构建总体积为1 mL的酶促反应体系,以不添加酶作为对照。将酶促反应体系置于30 ℃反应15 min后,沸水浴5 min终止反应。样品经离心过滤后,利用HPLC检测尿黑酸的生成量,HPLC检测方法见1.10。
1.8 HPPD抗性测定
在1.7构建的标准酶反应体系中添加0~50 μmol/L 的硝磺草酮、苯吡唑草酮和二酮腈,于30 ℃反应15 min后沸水浴5 min终止反应,利用HPLC检测尿黑酸的生成量。以不添加HPPD抑制剂时的酶活为100%,计算相对酶活。在GraphPad Prism 6软件中利用非线性拟合计算不同抑制剂的半抑制浓度(IC50)值。
1.9 HPPD酶学性质分析
将1.7构建的酶促反应体系置于10~50 ℃条件下测定StHPPD的最适反应温度,以30 ℃时的酶活为100%,计算相对酶活。配置3种50 mmol/L缓冲溶液,在pH 4.0至9.0范围内分析StHPPD的最适pH:柠檬酸缓冲液(pH 3.0~6.0)、PBS缓冲液(pH 6.0~8.0)和Tris-HCl缓冲液(pH 7.0~9.0)。以在50 mmol/L PBS缓冲液中pH 7.0时的酶活为100%,计算相对酶活。在酶促反应体系中分别加入1 mmol/L不同的金属离子(Fe2+、Fe3+、Mg2+、Ca2+、Al3+、Co2+、Mn2+、Hg2+、Cu2+、Ni2+、Zn2+和Ba2+),5 mmol/L Urea,5 mmol/L 金属螯合剂EDTA,5 mmol/L SDS和0.1%的DEPC,测定它们对酶活的影响,以添加Fe2+时的酶活为100%。
1.10 HPLC检测方法
4-HPP、HGA和硝磺草酮的HPLC检测方法参照彭乾等[13]。其中4-HPP和HGA的流动相为V(乙腈)∶V(水)=3∶7,水中添加体积分数为0.1%的三氟乙酸;硝磺草酮的流动相为V(甲醇)∶V(水)=55∶45,水中添加0.1%的磷酸;流速1.0 mL/min,柱温40 ℃;4-HPP、HGA和硝磺草酮的检测波长分别为282、292和245 nm。
2 结果与分析
2.1 硝磺草酮抗性菌株的筛选
经分离纯化,从采集的土壤样品中共获得了96株能以酪氨酸为唯一碳源生长的细菌,分别编号为MST-1~MST-96。为从中筛选硝磺草酮抗性菌株,将96株菌分别逐渐转接至含有500~5 000 μmol/L硝磺草酮的TMSM平板上。在低浓度硝磺草酮(500 μmol/L)作为选择压力时,大部分细菌的生长不受抑制,从中筛选获得了72株菌。然而,随着硝磺草酮浓度的不断提高,细菌的生长受到抑制,获得的菌株也越来越少。在含有5 000 μmol/L硝磺草酮的TMSM平板上筛选到3株菌株,分别为MST-5、MST-32和MST-66。
为进一步比较3株菌株对硝磺草酮的抗性,将它们分别接种于含有500~5 000 μmol/L硝磺草酮的TMSM液体培养基中,37 ℃培养60 h后测定培养液的OD600,结果如表2所示。在含有500 μmol/L硝磺草酮的TMSM液体培养基中,菌株MST-5和MST-32的生长基本不受影响;然而,随着硝磺草酮浓度的增加,菌株MST-5和MST-32的生长逐渐被抑制;相比较而言,菌株MST-5对硝磺草酮的抗性要稍好于MST-32。对于菌株MST-66,在含有500~5 000 μmol/L硝磺草酮条件下,其生长不受抑制。因此,3株菌株对硝磺草酮的抗性强度为:MST-66>MST-5>MST-32。
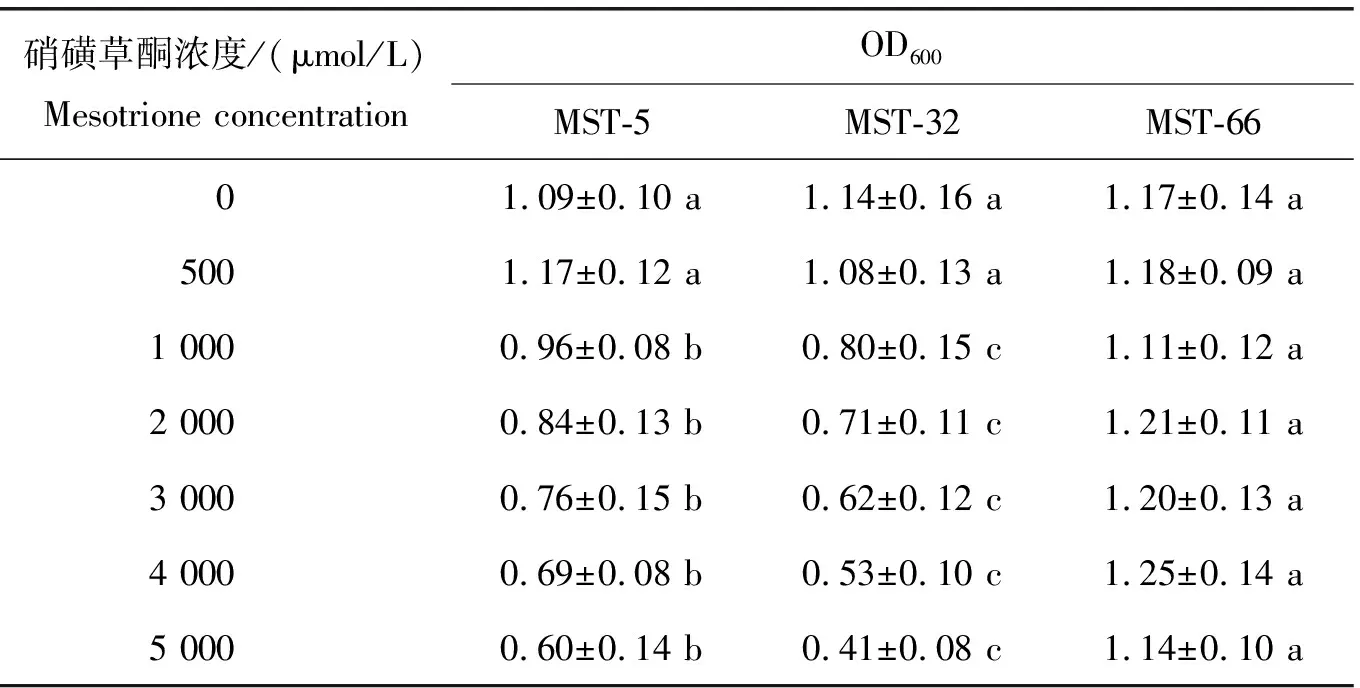
表2 菌株MST-5、MST-32和MST-66对不同浓度硝磺草酮的抗性Table 2 The resistance of strains MST-5, MST-32 and MST-66 to mesotrione
据文献报道,细菌对HPPD抑制剂的抗性具有多种机制,而最常见的是体内靶标酶HPPD对除草剂不敏感以及降解酶将除草剂降解而获得的抗性[18]。为研究菌株MST-5、MST-32和MST-66对硝磺草酮的抗性是来自靶标酶抗性还是降解获得的抗性,选取上述添加了500 μmol/L硝磺草酮的TMSM液体培养基,利用HPLC对培养基中的硝磺草酮含量进行检测。如图1所示,硝磺草酮的出峰时间在5.9 min左右,处理(接种菌株MST-5、MST-32和MST-66)和对照(未接菌)中的硝磺草酮特征峰相互叠加,且峰面积基本一致,也没有新的特征吸收峰的生成,表明硝磺草酮没有被降解。因此菌株MST-5、MST-32和MST-66对硝磺草酮的抗性可能是来自靶标酶抗性而非降解获得的抗性。
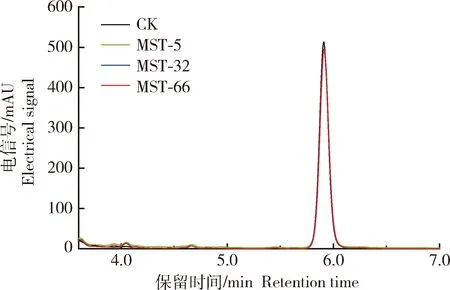
图1 菌株MST-5、MST-32和MST-66对硝磺草酮的降解能力Fig.1 HPLC analysis of the degradation of mesotrione by strains MST-5, MST-32 and MST-66
2.2 菌株MST-5的系统进化分析
经16S rRNA基因序列分析,菌株MST-5、MST-32和MST-66分别为嗜麦芽窄食单胞菌属(Stenotrophomonassp.)、伯克氏菌属(Burkholderiasp.)和节杆菌属(Arthrobactersp.)。鉴于节杆菌中没有HPPD基因,其通过3,4-二羟基苯乙酸途径(Homoprotocatechuate pathway)代谢酪氨酸[19],因此节杆菌对HPPD抑制剂不敏感。而菌株MST-5对硝磺草酮的抗性要高于菌株MST-32,因此选择菌株MST-5进行后续研究。
菌株MST-5为革兰氏阴性、好氧细菌,其在LB平板上生长2 d后,菌落为黄色圆形,边缘光滑(图2(a))。用透射电子显微镜观察,MST-5菌体形态为杆状,大小为0.9~1.0 μm× 2.1~2.2 μm(图2(b))。PCR扩增得到菌株MST-5的16S rRNA基因序列长为1 441 bp。将其提交至EzBioCloud进行序列比对,结果表明菌株MST-5与StenotrophomonasindicatrixWS40T相似性最高,为99.73%,其次为StenotrophomonaslactitubiM15T(99.66%)和StenotrophomonaschelatiphagaDSM 21508T(99.05%)。Neighbor-joining法构建菌株MST-5的系统进化树,表明菌株MST-5属于Stenotrophomonas属,与StenotrophomonasindicatrixWS40T形成一个分枝(图3)。因此将菌株MST-5初步鉴定为嗜麦芽窄食单胞菌属。

(a)菌落形态;(b)透射电镜(放大倍数为10 000倍)照片。(a) Colony morphology; (b) Transmission electron micrograph (10 000×).图2 菌株MST-5的形态特征Fig.2 Morphological characteristics of strain MST-5
2.3 hppd基因的克隆
Blast分析表明,同一个属的HPPD基因非常保守,其核酸序列和氨基酸序列相似性高达90%以上。虽然抗性菌株MST-5的基因组尚未测定,但和其亲缘关系最近的菌株StenotrophomonasindicatrixWS40T的基因组序列已经公布(登录号:PEJS00000000.1)。因此,在StenotrophomonasindicatrixWS40T氨基酸序列文库中,通过同源序列比对找到其HPPD(WP_032951734.1)以及对应的hppd基因(Locus tag: CR918_RS17620),并以此设计引物对Sthppd-F和Sthppd-R(表1),以菌株MST-5基因组DNA为模板,利用PCR成功扩增出了hppd基因,命名为Sthppd。经测序,Sthppd长为1 071 bp,GC含量为62%,编码356个氨基酸。
同源序列分析表明,StHPPD和已报道的抗性HPPD序列一致性较低(图4)。如:StHPPD与来自Burkholderiasp. BW-1的BkHPPD相似性为55%,与来自PseudomonasfluorescensP.J.874的PfHPPD相似性为51%,与来自Ensifersp. Ace-21 的EnHPPD相似性为51%,与来自Pseudomonassp. AM-H4的PsHPPD的相似性为47%,与来自Sphingobiumsp. TPM-19的SpHPPD的相似性为49%。
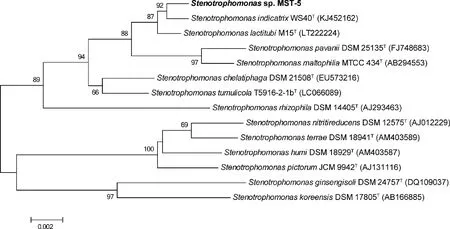
括号中的序号代表GenBank登录号;节点上的数字表示Bootstrap值;刻度0.002表示序列偏差值。Accession numbers of sequences are given in parentheses. Bar, 0.01 substitutions per nucleotide position. Numbers at the nodes indicate the bootstrap values. Bar, 0.002 substitutions per nucleotide position.图3 菌株MST-5基于16S rRNA基因序列的系统发育树Fig.3 Phylogenetic tree reconstructed by the neighbour-joining method based on 16S rRNA gene sequences of strain MST-5
2.4 StHPPD的表达与纯化
为测定StHPPD的酶活,将Sthppd克隆至pET29a(+)表达载体上,并转化至E.coliBL21(DE3)进行异源表达,表达产物通过Co2+亲和层析纯化。SDS-PAGE分析表明纯化的蛋白的分子量大约为42 000 u,与理论值40 100 u相符(图5)。纯化的StHPPD蛋白质量浓度为436 μg/mL。
2.5 StHPPD的酶活及对不同HPPD抑制剂的抗性分析
利用HPLC检测StHPPD的酶活,如图6所示,不添加酶的对照只有4-HPP特征峰,出峰时间为9.7 min;而添加StHPPD的处理在3.9 min有一个新的特征峰生成,与HGA标准品的出峰时间一致。HPLC检测结果表明StHPPD具有4-羟基苯丙酮酸双加氧酶的活性,可以在体外将4-HPP转化成HGA。
为进一步研究StHPPD对3种HPPD抑制剂类除草剂的抗性,利用HPLC检测了StHPPD在添加有不同浓度的HPPD抑制剂时残留的酶活,结果显示,硝磺草酮、苯吡唑草酮和二酮腈对StHPPD的IC50分别为15.5、10.8和28.2 μmol/L。
2.6 温度、pH、金属离子及化学添加剂对StHPPD酶活影响
如图7(a)所示,StHPPD的最适反应温度为30 ℃;在20~40 ℃范围内,StHPPD的酶活能够保持在50%以上;当温度高于40 ℃时,StHPPD酶活快速下降;在50 ℃时,StHPPD基本丧失酶活。如图7(b)所示,StHPPD的最适pH为7.0;pH为6.0~7.5,StHPPD酶活能保持在90%以上;当pH为8.0时StHPPD酶活能保持在50%左右;当pH<5.0或pH=9.0时,StHPPD基本检测不到酶活。金属离子和一些化学添加剂对StHPPD酶活的影响如表3所示。大部分金属离子,如Al3+、Co2+、Hg2+、Cu2+、Ni2+、Zn2+和Ba2+,严重抑制StHPPD酶活;只有Fe3+和Mg2+不影响StHPPD的酶活;加入5 mmol/L脲对StHPPD酶活基本没影响,但加入EDTA、SDS和DEPC之后,StHPPD酶活完全被抑制。

表3 金属离子和化学添加剂对StHPPD酶活的影响Table 3 Effects of metal ions and chemicals on StHPPD activity
3 讨论与结论
HPPD抑制剂类除草剂被认为是理想的抗除草剂转基因靶标除草剂,近年来,HPPD抑制剂类除草剂抗性菌株的筛选及抗性基因的克隆成为当前的研究热点。目前已有近10种HPPD抑制剂类除草剂抗性菌株被分离出来[6-11]。本研究分离到一株硝磺草酮抗性菌株MST-5,初步鉴定为嗜麦芽窄食单胞菌属(Stenotrophomonassp.)。该属细菌的HPPD抑制剂抗性是首次报道。MST-5能够耐受5 000 μmol/L的硝磺草酮,与能耐受250 μmol/L硝磺草酮的Sphingobiumsp. TPM-19相比[12],Stenotrophomonassp. MST-5对硝磺草酮具有更高的抗性。
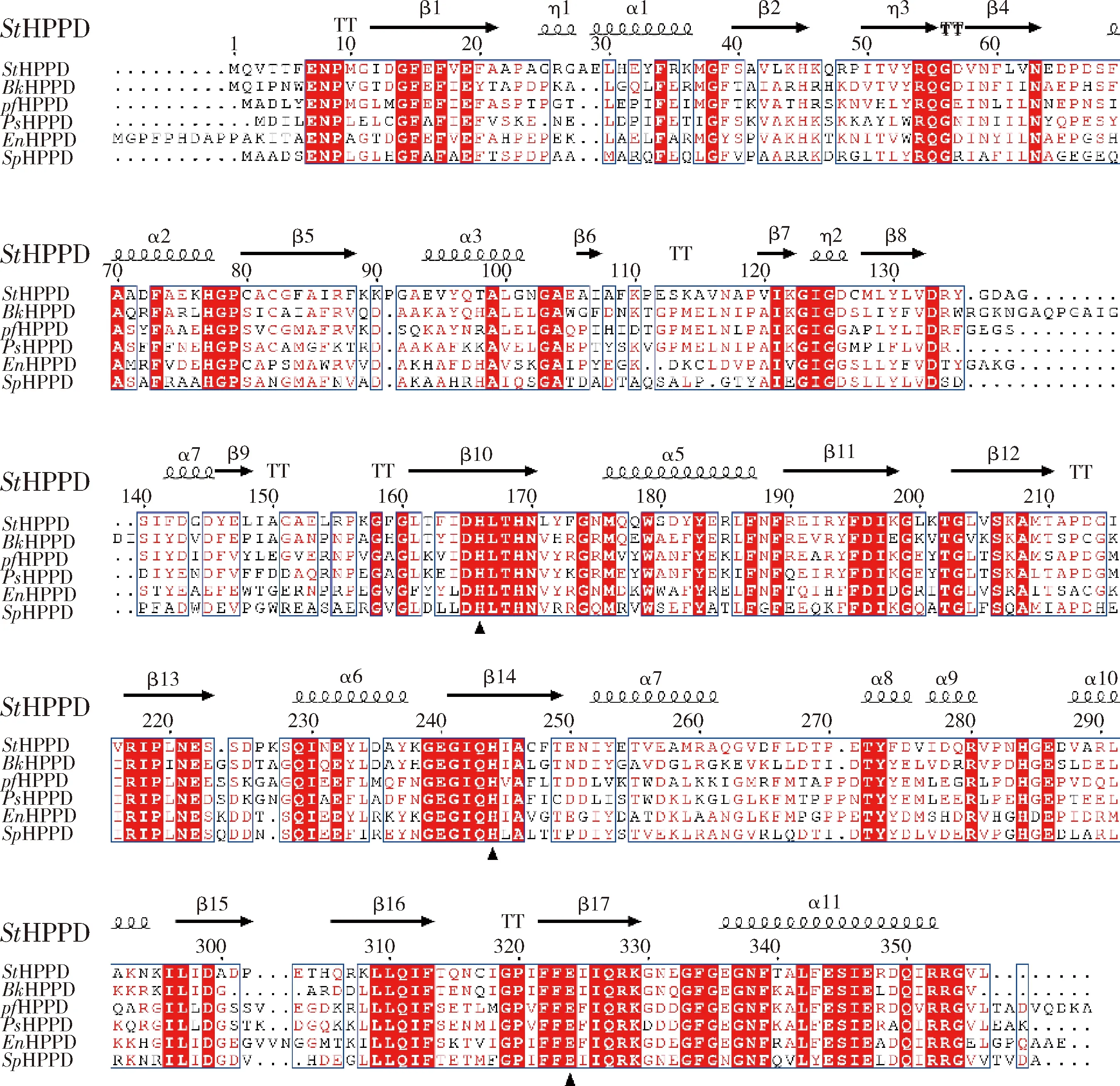
序列上方带箭头部分为StHPPD二级结构,包括α螺旋和β折叠,相同的序列背景用红色背景标出,保守序列位点用方框标出。黑色填充三角标记的严格保守的残基(His170,His248 和Glu332)是Fe(II)结合位点。Numbers above the amino acid sequences indicate the residue positions of StHPPD. The predicted StHPPD secondary structure is shown above the alignment with α-helices, β-strands, and turns. The conserved amino acid residues are emphasized in box and identical residues are shown with a red background. Strictly conserved residues (His170, His248 and Glu332) labeled with black filled triangles are Fe(II) binding site.图4 HPPD氨基酸序列比对Fig.4 Multiple alignment of HPPD enzymes protein sequence
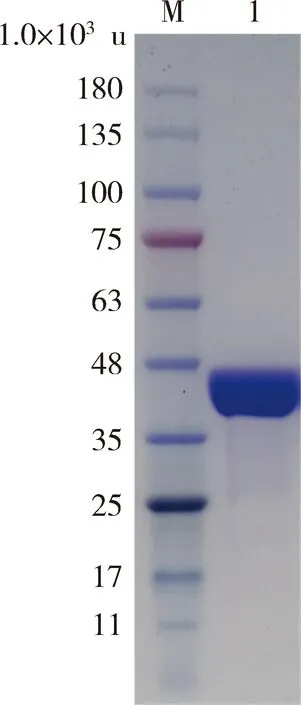
M:蛋白Marker;1:StHPPD纯酶。Lane M: Standard protein molecular marker;Lane 1: Purified StHPPD.图5 StHPPD的SDS-PAG检测图Fig.5 SDS-PAGE analysis of StHPPD
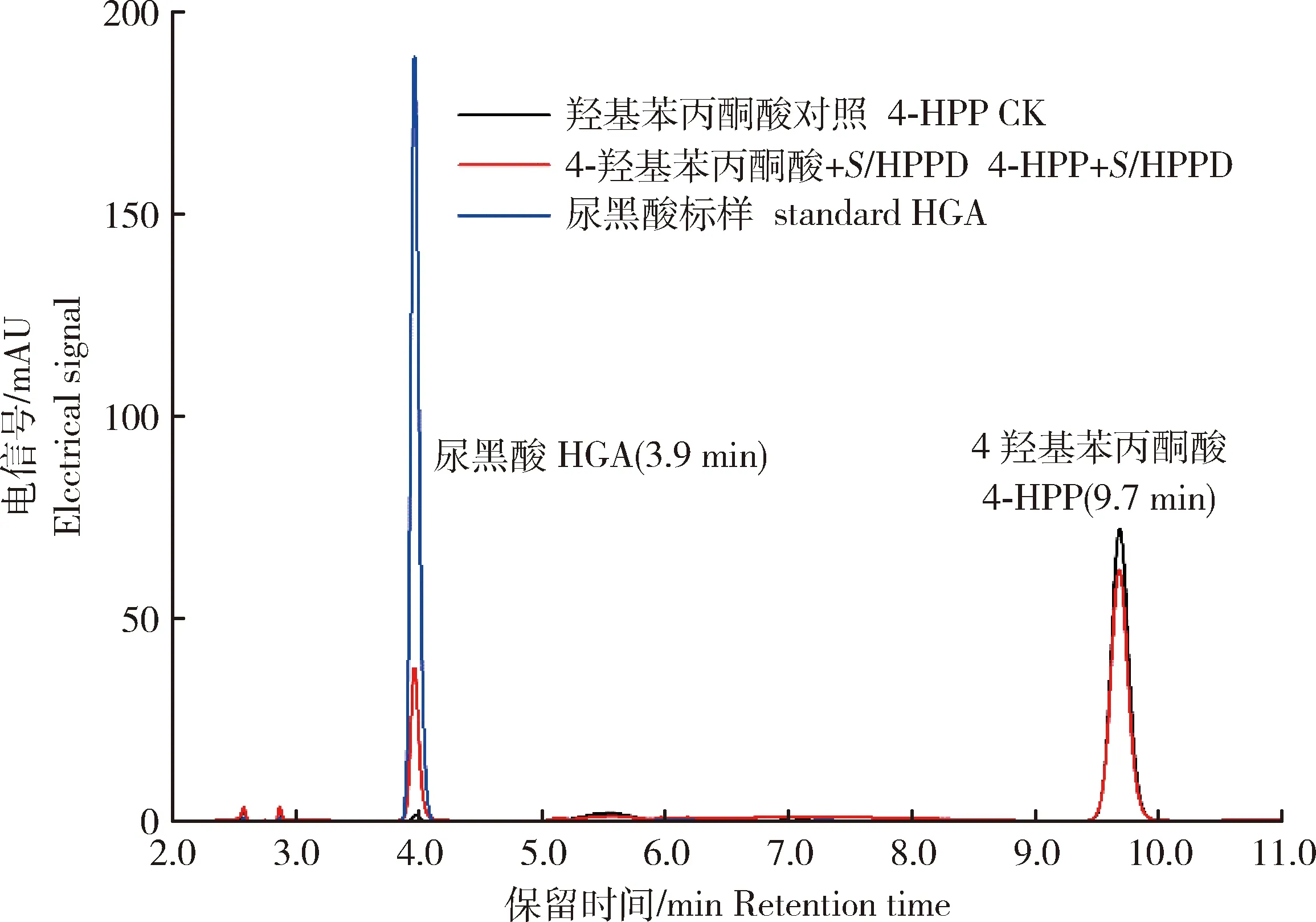
图6 StHPPD催化4-HPP生成HGA的液相色谱图Fig.6 HPLC analysis of 4-HPP transformation by StHPPD
国内外克隆获得了多个HPPD抑制剂除草剂抗性HPPD基因[6~11],其中有2个HPPD抗性基因突变体,分别是从Pseudomonasfluorescens的HPPD中筛选得到的突变体GW336[8]和从Avenasativa的HPPD中筛选得到的突变体339[9],已经用于转基因大豆生产中,并使转基因大豆产生了对异噁唑草酮和硝磺草酮的较强抗性。本研究从Stenotrophomonassp. MST-5中克隆HPPD基因Sthppd,并外源表达StHPPD。最近,Liu等[12]和彭乾等[13]分离到2个抗性HPPD,分别命名为SpHPPD和EnHPPD。SpHPPD和EnHPPD表现出广谱的HPPD抑制剂抗性,硝磺草酮、苯吡唑草酮和二酮腈对SpHPPD的IC50为4.2~8.7 μmol/L,对EnHPPD的IC50为12.7~35.1 μmol/L。在本研究中3种HPPD抑制剂对StHPPD的IC50为10.8~28.2 μmol/L,与SpHPPD和EnHPPD处在同一个数量级水平上。这说明StHPPD对多种HPPD抑制剂类除草剂具有较高的抗性,是优良的广谱HPPD抑制剂类除草剂抗性基因资源,具有潜在应用价值。

数值以“平均值±标准偏差”表示;n=3。Data are shown as mean±SD. n=3.图7 温度(a)和pH(b)对StHPPD酶活的影响Fig.7 Effects of temperature (a) and pH (b) on the activity of StHPPD
同源序列分析结果显示,StHPPD和已报道的抗性HPPD序列相似性仅为47%~51%,其C端序列相对保守,而N端序列则与已报道HPPDs差异较大。前人研究表明,HPPD一级结构中的C末端氨基酸序列高度保守,是酶的活性中心,而N末端同源性较低,没有催化功能,在维持蛋白质稳定性方面发挥作用[12,20]。Liu等[12]通过对已报道的4-羟基苯丙酮酸双加氧酶进行序列比对发现,虽然基因序列相似性不高,但各HPPD蛋白中与Fe2+结合的2个His和1个Glu高度保守。我们预测的StHPPD一级结构中也有三个催化活性中心Fe2+结合位点His166、His244和Glu332。这些结果说明StHPPD可能具有与已报道的HPPD蛋白类似的催化机制。
本研究分离到一株硝磺草酮高耐受菌株Stenotrophomonassp. MST-5,并从中克隆到硝磺草酮抗性基因Sthppd。抗性分析表明StHPPD对HPPD抑制剂类除草剂表现出较高的抗性,但其抗性机制和在转基因植物中的抗性性能有待进一步研究。本研究为抗HPPD抑制剂类除草剂转基因作物的培育提供优良的基因资源。
