基于Nrf2/ARE信号通路探讨白藜芦醇治疗非酒精性脂肪性肝炎大鼠的作用机制
2021-11-02冯成军周艳萌田应娟
冯成军, 周艳萌, 田应娟
1.遵义医科大学第三附属医院感染科,贵州 遵义 563000; 2.遵义医科大学微生物学与免疫学实验室,贵州 遵义 563000; 3.遵义市播州区中医院B超科,贵州 遵义 563000
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)是最常见的肝病之一,高发于高热量饮食人群,全世界患病率约25%[1,2]。NASH是由过多的甘油三酯(triglycerides,TG)诱导累积导致肝脂肪变性,继而发展为非酒精性脂肪性肝炎,最后导致肝硬化甚至肝癌[3,4]。目前为止,尚无有效的治疗非酒精性脂肪性肝炎的方法。从脂质积累分子机制来看,氧化应激可能会引起脂肪变性。抗氧化剂可调节脂肪生成、脂质氧化和过氧化以及炎症,氧化环境的改善可能改善肝损伤和纤维化,从而降低脂肪肝风险[5]。因此抗氧化可能成为一种有前景的治疗方法。白藜芦醇(resveratrol,RSV)是一种天然多酚,提取自葡萄、浆果和红酒,具有抗氧化作用[6],可控制能量代谢。白藜芦醇通过热量限制,激活关键的代谢调节通路,如AMP活化激酶(AMP-activated protein kinase,AMPK)[7]、核 因 子 红 系 衍 生 样2(nuclear factor erythroid 2-related factor 2,Nrf2)[8]。Nrf2是调节细胞氧化应激反应的重要转录因子,也是维持细胞内源性氧化还原稳态的调节因子。Nrf2可降低活性氧和亲电体对细胞的损伤,诱导抗氧化应激酶,使细胞保持稳定状态。Nrf2在细胞质通过与其负性调节因子Kelch样ECH结合蛋白1(kelch-like ECH-associated protein 1,Keap1)结合,促进Nrf2泛素化。在活性氧作用下,Nrf2以Keap1-Nrf2复合物的形式从细胞质转移到细胞核,然后与抗氧化反应元件(antioxidant response element,ARE)结合。该复合物激活多种解毒剂和抗氧化剂酶基因的表达,如醌氧化还原酶1(NADPH quinone oxidoreductase 1,NQO1)、血红素加氧酶1(heme oxygenase-1,HO-1),保护细胞免受氧化压力以及其他毒素危害[9]。最近的数据表明,Nrf2/ARE途径在抗氧化和凋亡损伤的保护作用中起着核心作用[10]。本实验主要基于Nrf2/ARE信号通路探讨白藜芦醇治疗非酒精性脂肪性肝炎大鼠的作用机制。
1 材料与方法
1.1 实验材料
1.1.1 主要试剂 RSV(纯度>98%)购自美国Sigma公司;OAD85(Nrf2/ARE抑制剂齐墩果酸衍生物)由云南民族大学云南民族大学-香港浸会大学传统天然药物研发联合实验室惠赠;HE试剂盒购自北京索莱宝科技公司。 丙氨酸氨基转移酶(alanine aminotransferase,ALT)、天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)、胆 固 醇(total cholesterol,TC)、甘油三酯(TG)、高密度脂蛋白(high density lipoprotein cholesterol,HDL)、低密度脂蛋白(low density lipoprotein,LDL)和 游 离 脂 肪 酸(free fatty acid,FFA)试剂盒购自美国雅培公司。Keap1、Nrf2、ARE、NQO1、HO-1、GAPDH、H1兔抗鼠一抗,IgGHRP羊抗兔二抗购自美国Abcam公司。Favorgen试剂盒购自台湾Favorgen生物科技公司。
1.1.2 实验动物 雄性SD大鼠(体重200~260 g),购自北京华阜康生物科技有限公司,生产许可证号:SCXK(京)2016-0041。大鼠保持有规律的12 h光/暗循环(24±2)℃。CD饲料的能量组成含10%脂肪(可可脂4%,大豆油6%),20%蛋白质以及70%碳水化合物。HCD饲料的能量来自65%脂肪(可可脂59%和大豆油6%),20%蛋白质,10%碳水化合物,2%胆固醇,0.5%胆酸盐等。
1.2 实验方法
1.2.1 动物分组及模型构建 雄性SD大鼠32只,适应性饲养1周后,取8只继续喂养普通饲料作为CD组,其他采用高脂饮食法构建大鼠NASH模型[11]。实验第4周末从高脂造模动物中随机抽取2只大鼠处死取其肝行肝组织病理学诊断,有明显脂肪肝改变视为造模成功,并随机分为高脂饮食组(HCD)、白藜芦醇组(HCD+RSV)及(白藜芦醇+OAD85)组(HCD+RSV+OAD85),每组取6只。各组大鼠干预情况如下:(HCD+RSV)组及(HCD+RSV+OAD85)组在喂养第4周灌胃给予10 mg/kg RSV或10 mg/kg RSV+100μg/kg OAD85[12,13],灌胃剂量3 ml,每日1次,连续给药28 d,CD组和HCD组给予等量生理盐水,观察病理情况并测试相关评价指标。
1.2.2 肝HE染色病理学评价 取大鼠肝组织,于4%多聚甲醛溶液中固定,脱水,石蜡包埋,组织切片。进行HE染色观察肝组织病理学改变。脂肪变性程度主要观察肝含脂肪面积的百分比。肝组织学参数分级按照非酒精性脂肪性肝炎临床研究网络NAFLD活动评分。脂肪变性分级(0级,<5%受影响;1级,5%~33%;2级,34%~66%;3级,66%以上);小叶炎性活动(0~3级)和肿胀程度(0~2级);门静脉炎症分级为(0,无;1,轻度;2,中度;3,严重)。NASH总分采用非酒精性脂肪性肝炎临床研究评分,是脂肪变性(0~3)、小叶炎症(0~3)和肿胀(0~2)得分的未加权总和[14]。
1.2.3 肝组织冰冻切片油红O染色观察脂肪量变化冰冻切片厚5μm,用10%中性缓冲福尔马林固定5 min,随后进行脂质染色。脂类使用油红O染色法检测。1 g油红O染料溶解于100 ml 70%乙醇/丙酮混合溶液中。切片在70%乙醇中进行适应冲洗,然后在工作溶液中培养10 min。切片在70%乙醇中进行分化,然后用HE复染进行对比。
1.2.4 血液生化指标检测 腹主动脉取大鼠全血,4000 r/min离心10 min得到血清,利用试剂盒测试血清酶指标(ALT、AST)以及血脂水平(TC、TG、LDL、HDL和FFA),操作严格按照试剂盒说明进行。
1.2.5 qRT-PCR检测mRNA表达 使用Favorgen试剂盒分离肝组织总RNA,测试RNA纯度。将其逆转成cDNA,进行实时定量PCR。反应条件:95℃预变性10 min,95℃变性10 s,60℃退火15 s,72℃延伸20 s;第2步开始读板,5 s读板1次,共39个循环,溶解曲线65~95℃。 U6作 为 内 参(上 游 引 物 为 5′-CCTGAGCAGGAACAGCTTGA-3′,下 游 引 物 为5′-CGTACGTAGTCGAACCGAGA-3′),keap1(上游引物为5′-CCATATCGCTGGATGACGAT-3′,下游引物为5′-GTGCAGGGTCCGAGGT-3′),Nrf2(上 游 引 物 为5′-AGGACATGGATTTGATTGAC-3′,下 游 引 物 为5′-TACCTGGGAGTAGTTGGCA-3′)、ARE(上游引物为5′-GTTTCAACGAACAGTGGTA-3′,下 游 引 物 为5′-CTAGCTTGGAATGACATTG-3′)、NQO1(上游引物为5′-CCCTGCGAACTTTCAGTATCC-3′,下游引物为5′-CTTTCAGAATGGCAGGGACTC-3′)、HO-1(上游引物为5′-GGCAGCAAGGTGCAAGA-3′,下 游 引 物 为5′-GAAGGAAGCCAGCCAAGAG-3′),相对表达量用2-△△CT表示。
1.2.6 Western blot检测Nrf2/ARE蛋白表达 从各组肝细胞中提取蛋白质。肝细胞研磨成为单细胞混悬液,在RIPA缓冲液中裂解。用BCA蛋白质分析法测定蛋白质浓度。每组上样蛋白质含量(50μg),用10%聚丙烯酰胺凝胶电泳分离并电转移至硝化纤维素膜。5%脱脂牛奶在室温下封闭2 h。抗体的非特异性结合被阻断。然后加入稀释的一抗Keap1(1:1000),Nrf2(1:200),ARE(1:200),NQO1(1:200),HO-1(1:2000)、H1(1:1000)或GAPDH(1:2000)在4℃孵育过夜。第2 d膜在室温下复温1 h,加入IgGHRP二抗孵育2 h,滴加ECL发光液显影,利用成像系统拍照,Image-J软件定量光密度值。最后细胞质蛋白以目的蛋白与GAPDH蛋白的表达量比值作为相对表达水平,细胞核蛋白以目的蛋白与H1蛋白的表达量比值作为相对表达水平。
1.3 统计学分析
所有数据以(均数±标准差)表示。两组间的比较采用单因素方差分析。采用Graghpad 5和SPSS进行数据分析,P<0.05代表具有统计学差异。
2 结果
2.1 肝组织HE染色病理学评价
实验28 d后进行肝组织HE染色,结果如图1所示。CD组显示正常的肝组织学形态。HCD组大鼠肝组织表现出广泛的大量的脂肪变性,最明显的肝脂肪变性出现在3区周围,出现微泡和少量的大泡脂肪变性,同时伴有小叶炎症、少量的门静脉炎症且细胞有轻微肿胀,这也是纤维化的开始,符合NASH组织病理形态。而(HCD+RSV)组表现出较少的脂肪变性,小叶炎症和门静脉炎症减轻,肿胀有一定程度的改善。NADH评分结果显示,HCD组肝脂肪变性、小叶炎症、门静脉炎症、肿胀程度评分最高(P<0.05),(HCD+RSV)组各项评分较之降低(P<0.05),(HCD+RSV+OAD85)组与HCD组类似,如表1。
表1 肝组织病理评分表(±s)Tab.1 Liver pathology score sheet(Mean±SD)
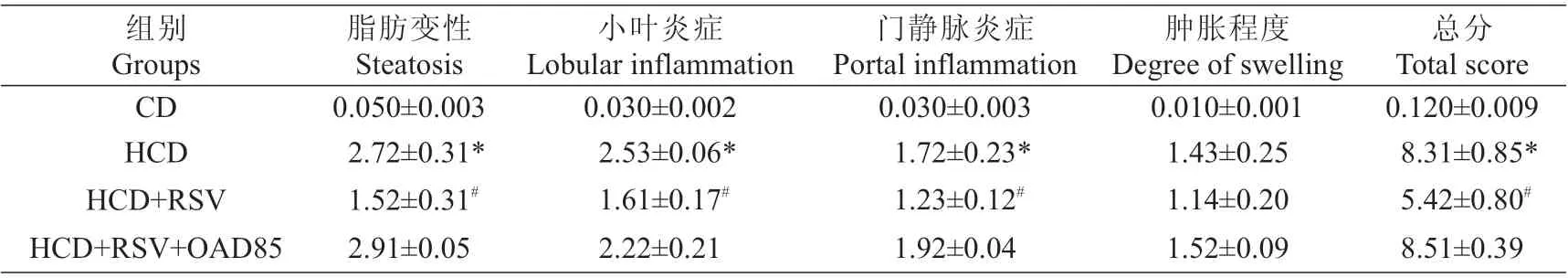
表1 肝组织病理评分表(±s)Tab.1 Liver pathology score sheet(Mean±SD)
注:*P<0.05,与CD组相比#P<0.05,与HCD组相比Note:*P<0.05 vs CD group;#P<0.05 vs HCD group
总分Total score 0.120±0.009 8.31±0.85*5.42±0.80#8.51±0.39组别Groups CD HCD HCD+RSV HCD+RSV+OAD85脂肪变性Steatosis 0.050±0.003 2.72±0.31*1.52±0.31#2.91±0.05小叶炎症Lobular inflammation 0.030±0.002 2.53±0.06*1.61±0.17#2.22±0.21门静脉炎症Portal inflammation 0.030±0.003 1.72±0.23*1.23±0.12#1.92±0.04肿胀程度Degreeof swelling 0.010±0.001 1.43±0.25 1.14±0.20 1.52±0.09

图1 肝组织HE染色Fig.1 HEstaining of liver tissue
2.2 肝组织油红O染色观察脂肪量变化
结果如图2所示,CD组几乎没有观察到脂肪的含量,与CD组相比,HCD组脂肪含量明显升高(P<0.05)。与HCD组相比,(HCD+RSV)组脂肪含量明显降低(P<0.05)。(HCD+RSV+OAD85)组与HCD组相比差异无统计学意义(P>0.05)。
2.3 血液生化指标检测
血液生化指标检测结果显示(图2~3),与CD组相比,HCD组血清中酶指标ALT、AST显著升高(P<0.001),血脂水平TC、TG、HDL、LDL、FFA明显升高(P<0.01),与HCD组相比,(HCD+RSV)组酶指标与血脂水平显著下降(P<0.01)。
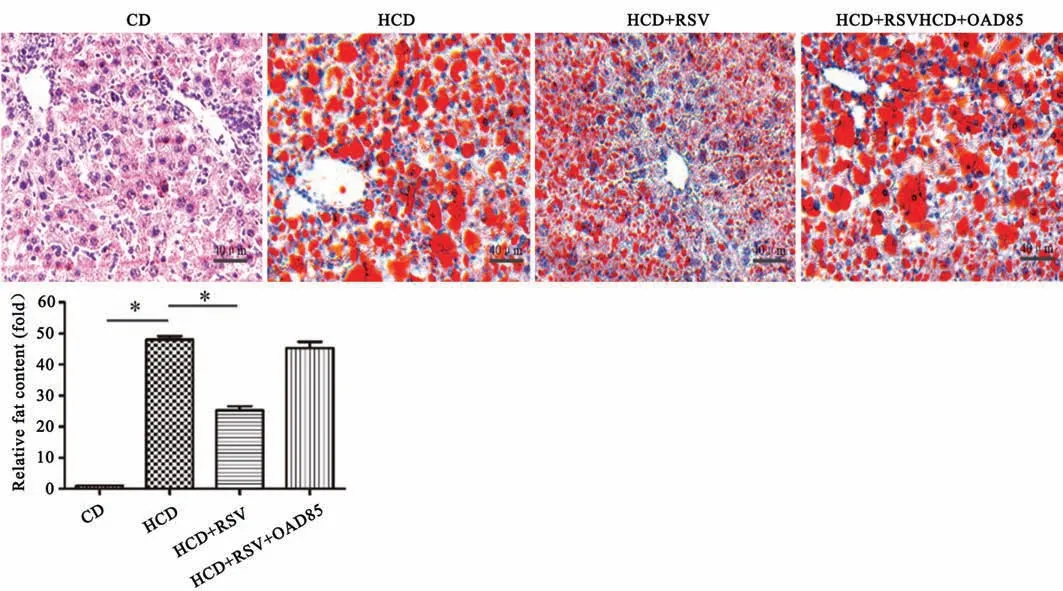
图2 RSV对肝脂肪量的影响 *P<0.05 n=6Fig.2 Effect of RSV on liver fat mass *P<0.05;n=6
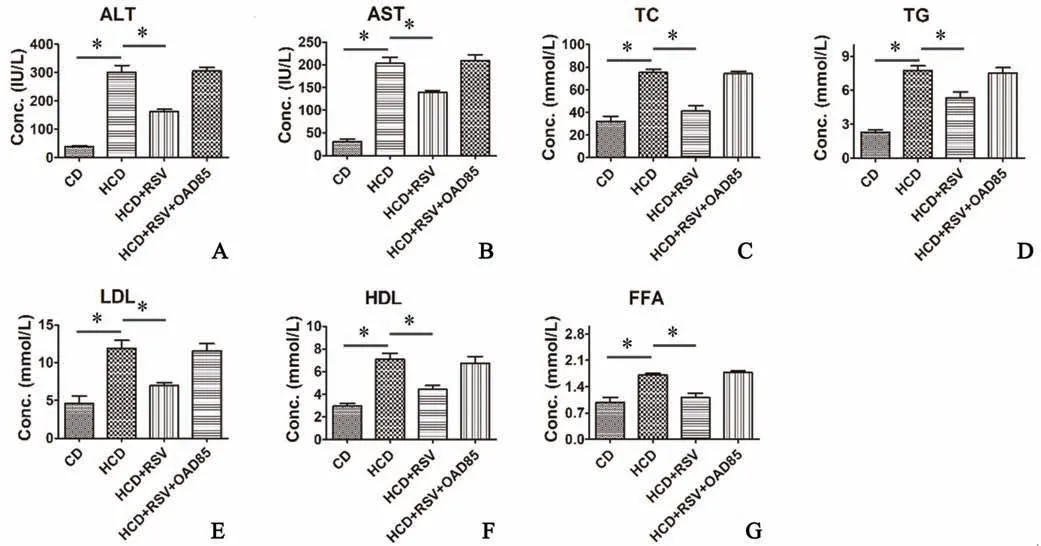
图3 RSV对血液生化指标ALT(A),AST(B)及TC(C),TG(D),LDL(E),HDL(F),FFA(G)的影响 *P<0.05 n=6Fig.3 Effect of RSV on blood biochemical indexes ALT(A),AST(B),TC(C),TG(D),LDL(E),HDL(F)and FFA(G) *P<0.05;n=6
2.4 qRT-PCR测试mRNA表达
对Nrf2/ARE通路的mRNA检测结果显示(图4),与CD组 相 比,HCD组Nrf2、ARE、NQO1、HO-1 mRNA的表达均升高(P<0.05),Keap1 mRNA明显下降(P<0.01);与HCD组相比,(HCD+RSV)组中Nrf2、ARE、NQO1、HO-1 mRNA的表达均降低(P<0.05),Keap1 mRNA升高(P<0.05);HCD组与(HCD+RSV+OAD85)组差异无统计学意义(P>0.05)。
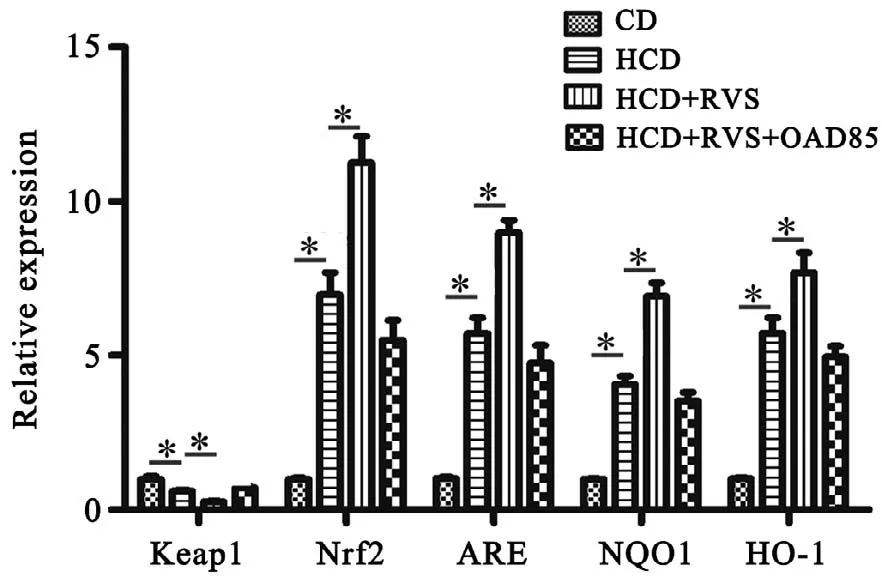
图4 mRNA在各组的表达水平 *P<0.05 n=6Fig.4 mRNA expression levels in different groups*P<0.05 n=6
2.5 Western blot检测Nrf2/ARE蛋白表达
Western blot检测Nrf2/ARE蛋白表达结果发现(图5),与CD组相比,HCD组及(HCD+RSV)组NQO1、HO-1、Nrf2、ARE蛋白表达均升高(P<0.05);与HCD组对比,(HCD+RSV)组NQO1、HO-1、Nrf2、ARE蛋白表达均增加(P<0.05),Keap1蛋白表达降低(P<0.05)。HCD组与(HCD+RSV+OAD85)组差异无统计学意义(P>0.05)。
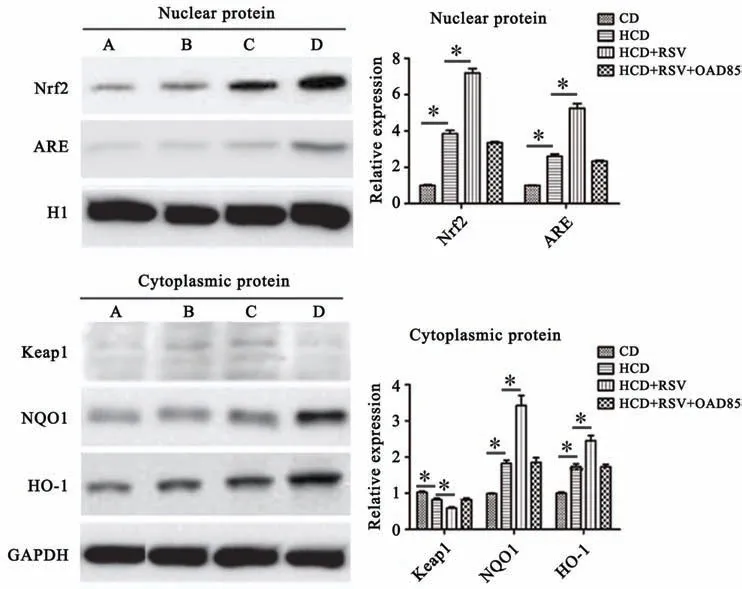
图5 Western blot检测各组Nrf2/ARE蛋白表达水平A:CD组B:(HCD+RSV+OAD85)组C:HCD组D:(HCD+RSV)组*P<0.05 n=6Fig.5 Protein expression levelsof Nrf2/AREin different groupsdetected by Western blot A:CD group;B:HCD+RSV+OAD85 group;C:HCD group;D:HCD+RSV group*P<0.05;n=6
3 讨论
NASH是西方发达国家常见的肝病,与肥胖、糖尿病及其他代谢病密切相关。NASH的发病机制目前并不清楚,大量的脂质物质和过氧化引起的氧化应激是引起细胞损伤和肝组织炎症加重的主要原因,氧化应激通过特异性调节Nrf2/ARE通路来影响NASH。Nrf2/ARE途径是一种内源性抗氧化信号通路,提供细胞抵御氧化损伤的能力。Nrf2尤为重要的作用是,它能激活多种抗氧化酶(如谷胱甘肽过氧化物酶和硫氧还蛋白还原酶),来清除体内过多的氧化自由基。因此研究Nrf2/ARE通路的特异性激活对于治疗NASH很有必要。NASH模型研究表明,给予大鼠以含酒精或高脂饮食,可导致其出现比相同饮食更为严重的肝损伤;该通路具有潜在的保护作用,可能是加强抗氧化物和解毒酶的表达,从而减少细胞脂质过氧化,减少FFA从脂肪组织中释放及对FFA的摄取[15]。本研究表明白藜芦醇通过Nrf2/ARE表达导致肝损伤细胞数量减少,脂肪变性显著减少,同时有些炎症反应被抑制。对比CD组,HCD组Nrf2明显增加,同时在白藜芦醇的作用下会对Nrf2显著激活。在HCD作用下,Nrf2及相关通路指标增加的可能原因是高脂造成的细胞损伤环境诱导了氧化应激通路,从而使抗氧化物质水平升高。白藜芦醇也显著增加了ARE、NQO1、HO-1,说明激活了Nrf2/ARE通路,并且对下游的基因蛋白产生了诱导作用。白藜芦醇对细胞质内Keap1的影响有少量下降的趋势,由此可看出白藜芦醇的作用主要体现在正向调节Nrf2/ARE通路,负向调节Keap1。OAD85会抑制Nrf2,同时油红染色等结果发现OAD85抑制RSV的脂肪代谢,这从一个侧面说明RSV的脂肪代谢与Nrf2通路有关。白藜芦醇有很好的抗氧化作用,它通过激活Nrf2/ARE通路抑制非酒精性脂肪性肝炎。有其他研究表明,白藜芦醇可以减弱心肌缺血再灌注损伤引起的氧化应激,可能也是因激活Nrf2/ARE保护心肌组织[16]。白藜芦醇经Nrf2/ARE通路减轻MPTP毒性,可通过抗氧化应激来实现[17]。由此可见,白藜芦醇通过Nrf2/ARE通路减弱氧化应激,可治疗多种疾病,减少组织损伤。
本研究使用高脂饮食喂养SD鼠来模拟非酒精性脂肪性肝炎疾病的形成。临床NASH患者往往是受肥胖、胰岛素抵抗和代谢综合征等多种因素影响,选择高脂饮食虽不能模拟真正发病的情况,但高脂饮食后形成的肝病灶包括脂肪变性、肿胀变性、炎症和纤维化等接近于临床NASH的病理表现。许多研究人员使用高脂饮食造模,系统地研究了Nrf2缺乏对NASH发生发展的影响。抑制Nrf2表达会导致脂肪变性和氧化应激增加[18]。Nrf2过度激活模型的研究显示,Nrf2对肝脂肪变性有改善作用。在这些研究中,系统性Nrf2过度激活是通过敲除基因Keap1(k1kd)模型或通过CDDO-IM 的药物诱导。Wible等[19]灌胃CDDO-IM药物诱导,Zhang等[20]用k1kd小鼠配合蛋氨酸-胆碱缺乏饮食(MCD)饮食5 d,两者都显示了NASH病情减弱。本研究结果较为一致。然而,有研究者使用瘦素缺乏症(lepob/ob)k1kd小鼠喂养到16周以及使用k1kd小鼠喂养HCD 24周后,均表现为肝脂肪变性增加,Nrf2过度活化[21]。与本结果相矛盾。值得注意的是,不同研究喂养时间的长短差别很大,显示Nrf2的保护作用的饮食时间较短,最多4周。另有研究者注意到8周龄时lepob/ob和lepob/ob k1kd之间的肝脂肪变性没有区别,且在8周龄时k1kd抑制lepob的脂质积累,而在16周龄时可促进脂质积累[22]。说明Nrf2对肝脂肪变性的保护可能是一种时间限制效应。
Nrf2/ARE通路可以调节解毒酶的转录水平,从而调节氧化还原水平和各种抗氧化平衡,是细胞抵御氧化应激的主要作用机制。Nrf2/ARE通路主要由3个部分构成,抗氧化反应元件ARE、调节氧化应激反应的重要转录因子Nrf2以及两者结合调控基因表达。Nrf2在细胞质通过与Keap1结合形成Keap1-Nrf2复合体,细胞质转移到细胞核,复合体解离,导致游离的Nrf2增加并且诱导Nrf2 mRNA转录,促进Nrf2蛋白生成,然后与ARE结合激活靶基因,如NQO1、HO-1。有研究表明灌胃鹅去氧胆酸后小鼠肝中Nrf2、HO-1与NQO1蛋白表达水平明显升高[23]。。这些数据表明在实验性NASH中,Nrf2的激活途径仍具有功能性。此外,这些数据可能表明,患有NASH的患者可能保留功能性Nrf2信号。NASH仍然受益于抗氧化剂/Nrf2活化疗法。研究表明有药物激活Akt和Nrf2/ARE信号通路,并增加Nrf2/ARE途径的两个下游因子HO-1和NQO-1的蛋白质水平,提高ROS清除能力和抑制氧化反应[24]。HO-1在抗氧化的同时也可以降低多种炎症反应,减轻组织的损伤,对组织具有保护作用。
总而言之,白藜芦醇治疗非酒精性脂肪性肝炎大鼠可能是基于Nrf2/ARE信号通路激活机制,从而改善氧化应激水平,可减轻肝病理损伤,然而,白藜芦醇是如何特异性激活Nrf2的表达,是否通过影响哪些上游分子信号通路来影响Nrf2的表达,且不同作用时间段会产生不同的影响,这些问题都有待进一步探讨和研究。