miR-548t-3p靶向CITED2调控甲状腺癌细胞的凋亡研究
2021-11-02王爱霞刘玮芳王春平
王爱霞 刘玮芳 王春平
甲状腺癌(TC)是常见的内分泌恶性肿瘤,最近几十年来在世界范围内迅速增加[1]。根据2014年世界癌症报告,全球约有298,000例新的TC病例和40,000例死亡病例[2]。根据2015年的中国癌症统计资料,TC已成为中国女性中的第六位恶性肿瘤,也是30岁以下女性中最常见的肿瘤[3]。此外,TC的复发率很高,导致治愈率下降和死亡率显着增加,这严重危害了人类健康[4]。目前,最常见的TC治疗方法是手术结合放射疗法或化学疗法。但是,它对耐受性乳头状癌,未分化癌和髓样癌没有很好的疗效,并且在癌症复发和对人体的危害方面仍存在争议[5]。因此,探索TC的肿瘤发生机制,寻找影响TC细胞增殖和凋亡的关键分子,是TC治疗的重要途径。miRNA是一大类微小的非编码RNA,它们是内源编码的,并通过与靶mRNA的3'UTR区结合而负调控基因表达,从而导致mRNA的翻译抑制或降解[6]。Vriens等[7]通过高通量测序发现TC癌组织和TC癌旁组织中miRNA的表达种类显著不同,包括miR-548t-3p。然而,miR-548t-3p在TC细胞中的功能尚未得到研究。基于此,本研究旨在探讨miR-548t-3p调控甲状腺癌细胞凋亡的潜在机制。
1 材料与方法
1.1 材料
甲状腺癌细胞SW579、B-CPAP、8305C、BHT101、CAL-62、KHM-5M、TPC-1、FTC-133、HTh-7均购自普诺赛公司(货号:CL-0457,CL-0575,CL-0613,CL-0617,CL-0618,CL-0623,CL-0643,CL-0644,CL-0647)。miR-548t-3p mimcis,miR-548t-3p inhibitor,siRNA和过表达质粒均有北京擎科合成。lipo3000转染试剂购自武汉市武昌区科迈实验用品经营部(货号:L3000015)。TRIzol试剂购自四川爱奇生物科技有限公司(货号:15596026)。第一链cDNA合成试剂盒购自宝如亿(北京)生物技术有限公司(货号:N118-1-1)。BCA蛋白测定试剂盒购自上海碧云天生物技术有限公司(货号:P0012)。CITED2抗体购自广州吉英生物科技有限公司(货号:46505)。GAPDH抗体购自广州洛唯尔生物科技有限公司(货号:ab8245)。FITC-Annexin V细胞凋亡检测试剂盒购自广州市左克生物科技发展有限公司(货号:22839)。荧光素酶检测试剂盒购自北京伊诺凯科技有限公司(货号:N1150)。
1.2 方法
1.2.1 一般资料 纳入2020年1月至2021年1月我院收治的甲状腺癌患者62例;其中男性25例,女性37例,年龄31~77岁,平均年龄(47.32±9.45)岁;肿瘤直径1.0~3.6 cm,平均直径为(1.77±0.82)cm;依据国际抗癌联盟《TNM恶性肿瘤分类》第7版进行TNM分期:均为Ⅲ期。甲状腺癌患者均经我院病理科证实。排除标准:①严重心、肝、肾功能损害者。②长期使用皮质类固醇激素及免疫抑制剂者。③患有精神疾病者。④患有其他肿瘤者。本研究经医院伦理委员会审批,受试者均签署知情同意书。
1.2.2 细胞培养与转染 将CAL-62、KHM-5M、TPC-1、FTC-133、HTh-7细胞保持在1640培养基中,将SW579、B-CPAP、8305C、BHT101细胞保持在DMEM培养基中,并补充10%胎牛血清、100 U/ml青霉素和0.1 mg/ml链霉素。将上述细胞放置与5%CO2、37 ℃的培养箱中培养。将甲状腺癌细胞以2×105/孔的密度接种在6孔板中,以进行RNA干扰。将miR-548t-3p mimcis,miR-548t-3p inhibitor,siRNA和过表达质粒分别与lipo3000转染试剂混合,室温静置15 min后缓缓滴入甲状腺癌细胞中。
1.2.3 RNA抽取与实时荧光定量PCR 根据制造商的规程,使用TRIzol试剂提取总RNA,并使用第一链cDNA合成试剂盒进行逆转录。在ABI 7500系统上在以下条件下进行qRT-PCR:95 ℃持续30 s;95 ℃持续5 s(40个循环);60 ℃持续30 s,72 ℃持续15 s。使用GAPDH作为内部对照计算基因的相对表达水平。
1.2.4 免疫印迹 处理后收集甲状腺癌细胞裂解液,并用双辛可宁酸(BCA)蛋白测定试剂盒测定蛋白浓度。用10%SDS-聚丙烯酰胺凝胶分离等量的蛋白质进行电泳,然后将其转移到聚偏二氟乙烯(PVDF)膜上。用5%脱脂牛奶封闭后,将膜与抗CITED2抗体作为一抗和抗GAPDH抗体作为内参。随后,将膜与适当的二抗在室温下孵育1 h。信号用化学发光底物试剂盒成像,并通过凝胶成像系统检测。
1.2.5 甲状腺癌细胞的凋亡检测 用胰蛋白酶收集甲状腺癌细胞,并用冰冷的D-Hanks溶液洗涤2次。然后,根据制造商的说明,使用FITC-Annexin V细胞凋亡检测试剂盒进行Annexin V/PI染色。使用贝克曼计数器流式细胞仪分析样品。
1.2.6 荧光素酶报告实验 根据生产商的说明,使用FuGENE HD将50 μg的荧光素酶报告载体和150 μg的pLL3.7-miR-548t-3p或pLL3.7-miR-对照载体转染到96孔板中的1.5×104SW579细胞中。转染后48 h,按照制造商的说明,使用双荧光素酶报告基因分析系统测量荧光素酶活性。将海肾荧光素酶活性标准化为萤火虫荧光素酶活性。
1.3 统计学分析
通过SPSS 16.0进行统计分析。根据统计分析的要求,所有结果均通过至少三个独立实验确认。由于异常分布或方差的异质性,数据表示为平均值±标准偏差,并使用Mann-Whitney检验进行分析。P<0.05被认为具有统计学意义。
2 结果
2.1 miR-548t-3p在甲状腺癌组织和甲状腺癌旁组织中的表达水平
miR-548t-3p在甲状腺癌组织的表达水平显著高于甲状腺癌旁组织(P<0.05),见图1。
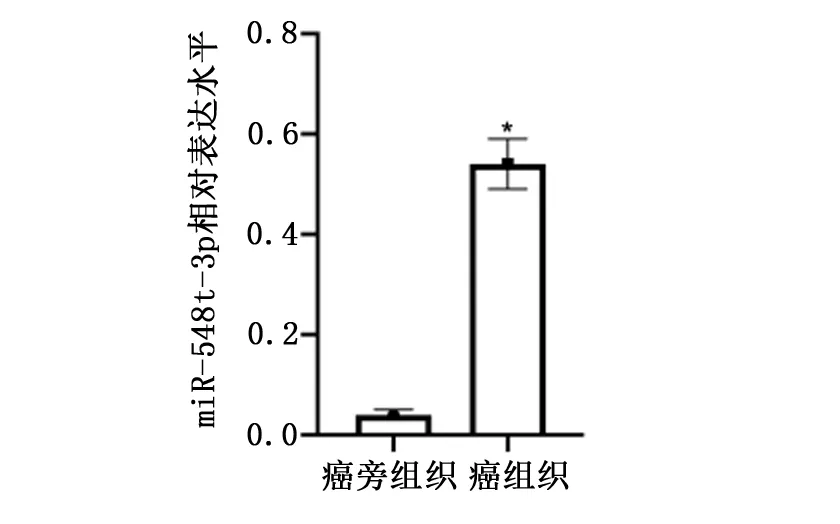
图1 miR-548t-3p在甲状腺癌组织和甲状腺癌旁组织中的表达水平
2.2 miR-548t-3p抑制甲状腺癌细胞凋亡
过表达miR-548t-3p后,甲状腺癌细胞SW579、B-CPAP、8305C、BHT101、CAL-62、KHM-5M、TPC-1、FTC-133、HTh-7的凋亡水平均下降(P<0.05);而敲低miR-548t-3p后,甲状腺癌细胞的凋亡水平均上升(P<0.05),见图2。
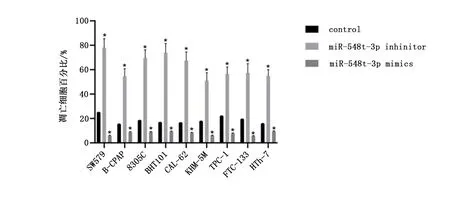
图2 miR-548t-3p抑制甲状腺癌细胞凋亡
2.3 miR-548t-3p靶向CITED2调控甲状腺癌细胞凋亡
通过miRDB在线分析发现miR-548t-3p潜在靶向92个基因的mRNA。在甲状腺癌细胞SW579中过表达miR-548t-3p后,检测上述基因mRNA水平的表达,发现miR-548t-3p能够显著降低SNRK、VASP、CITED2的mRNA水平(P<0.05),见图3A。使用siRNA敲低SNRK、VASP、CITED2后,发现当敲低CITED2时,甲状腺癌细胞SW579的凋亡水平显著下降(P<0.05),见图3B。过表达CITED2后,甲状腺癌细胞SW579的凋亡水平显著上升(P<0.05),见图3C。敲低miR-548t-3p后,CITED2的蛋白表达水平显著上升,见图3D。过表达miR-548t-3p后,CITED2的蛋白表达水平显著下降,见图3E。同时,荧光素酶报告实验发现miR-548t-3p靶向CITED2的3端非编码区(P<0.05),见图3F。同时敲低miR-548t-3p和CITED2,SW579细胞的凋亡水平无显著改变(P>0.05);同时过表达miR-548t-3p和CITED2,SW579细胞的凋亡水平无显著改变(P>0.05),见图4。
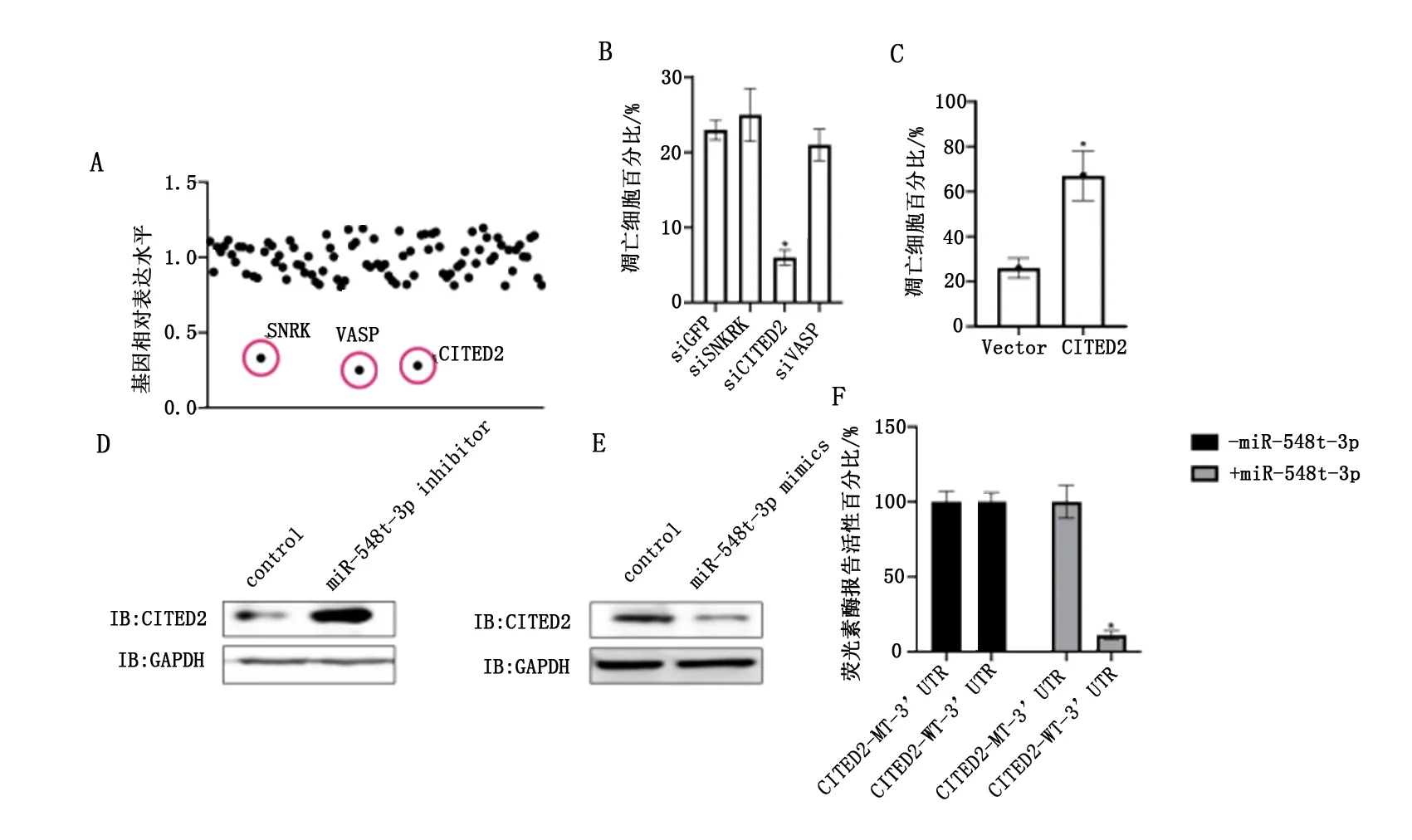
图3 CITED2调控甲状腺癌细胞凋亡
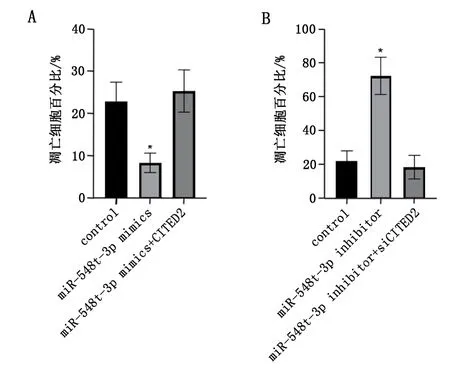
图4 miR-548t-3p靶向CITED2调控甲状腺癌细胞凋亡
3 讨论
甲状腺癌是最常见的内分泌恶性肿瘤,每年占全世界癌症发生率的1.3%和癌症死亡率的0.5%[8]。根据组织病理类型,甲状腺癌分为乳头状甲状腺癌,滤泡性甲状腺癌,未分化甲状腺癌和髓样癌[9]。最常见的类型是乳头状甲状腺癌,约占甲状腺癌的70%~80%[10]。因此,深入了解甲状腺癌发生发展的分子机制将有助于确定新的诊断和治疗方法。
在本研究中,发现miR-548t-3p在甲状腺癌组织的表达水平显著高于甲状腺癌旁组织(P<0.05)。过表达miR-548t-3p后,甲状腺癌细胞SW579、B-CPAP、8305C、BHT101、CAL-62、KHM-5M、TPC-1、FTC-133、HTh-7的凋亡水平均下降(P<0.05);而敲低miR-548t-3p后,甲状腺癌细胞的凋亡水平均上升(P<0.05)。miRNA是一类非蛋白质编码的单链RNA分子,由内源基因编码,长度为19~25个核苷酸,在物种中高度保守[11]。miRNA通常作用于一个或多个mRNA,并通过降解mRNA或抑制翻译水平来负面调节基因表达[12]。提示miR-548t-3p通过降解某个底物来调控甲状腺癌细胞的凋亡。
过表达miR-548t-3p后, miR-548t-3p能够显著降低SNRK、VASP、CITED2的mRNA水平(P<0.05)。敲低SNRK、VASP、CITED2后,仅当敲低CITED2时,甲状腺癌细胞SW579的凋亡水平显著下降(P<0.05)。尽管敲低SNRK和VASP并没有影响甲状腺癌细胞SW579的凋亡,但是miR-548t-3p靶向SNRK和VASP在甲状腺癌发生发展中的其他作用仍然值得进一步探讨。
过表达CITED2后,甲状腺癌细胞SW579的凋亡水平显著上升(P<0.05)。敲低miR-548t-3p后,CITED2的蛋白表达水平显著上升。过表达miR-548t-3p后,CITED2的蛋白表达水平显著下降。多项研究证实[13-14],CITED2可诱导细胞凋亡。其机制可能是CITED2是CBP / p300的负调节剂,而CBP/p300是组蛋白乙酰转移酶,可以通过乙酰化(例如在Lys-373上)稳定p53,并在p53稳定性中起重要作用[15]。因此,miR-548t-3p抑制了CITED2,随后p53积累减少最终抑制了细胞凋亡。此外,据报道丢失CITED2可以防止MYC与HDAC1相互作用,从而引起p21CIP1启动子的活化和细胞的静止[16]。这些结果与我们的结果一致,表明miR-548t-3p干扰可能通过下调CITED2的表达并随后影响p53和p21的表达来抑制细胞凋亡。
综上所述,miR-548t-3p通过靶向CITED2 mRNA的3端非编码区,降解了CITED2 mRNA并减少了CITED2的蛋白表达,最终抑制了甲状腺癌细胞的凋亡。
