氟中毒对神经细胞线粒体功能及凋亡的影响*
2021-11-02李新颖于星辰王爱国
李新颖,于星辰,张 舜,王爱国,刘 莉△
华中科技大学同济医学院公共卫生学院 1流行病与卫生统计学系 2劳动卫生与环境卫生学系环境与健康教育部重点实验室,武汉 430030
氟是人体生长发育必需的微量元素,一定剂量的氟摄入可维持机体正常生理活动。
研究表明,过量氟暴露可引起运动协调、认知和记忆能力的下降,提示过量的氟摄入可能影响神经行为和功能[1-2]。神经系统是机体氧耗量最高的系统,而线粒体是细胞供能的主要场所[3],因此研究氟中毒致神经细胞线粒体改变具有重要意义。线粒体呼吸链能够产生活性氧(reactive oxygen species,ROS),过量的ROS若未被及时清除,会导致线粒体能量代谢衰竭和氧化应激[4]。而氟则可能通过诱导ROS的产生,损伤线粒体相关成分从而产生毒性效应。
现已有研究报道氟对神经细胞线粒体相关基因表达的影响[5-6],而氟对神经细胞线粒体功能、线粒体动力学和自噬相关蛋白表达的影响鲜见报道。本实验通过研究氟对人神经母细胞瘤细胞(SH-SY5Y细胞)线粒体功能、线粒体动力学和自噬相关蛋白表达及细胞凋亡的影响,对氟中毒致神经系统损伤的机制进行探讨。
1 材料和方法
1.1 主要仪器和试剂
凝胶成像系统(ChemiDocTMXRS+,Bio-Rad,上海);流式细胞仪(CytoFLEX S,Beckman Coulter,美国);全功能微孔板检测仪(PerkinElmer/envision,上海);荧光显微镜(BX53,Olympux,日本)。NaF(Sigma,美国);Miro1/RHOT1抗体(Invitrogen,美国);MitoSOX Red检测试剂盒(Invitrogen,美国);ATG5抗体(Invitrogen,美国);PINK1抗体(Invitrogen,美国);PARP抗体(Invitrogen,美国);cleaved Caspase-3抗体(Affinity Biosciences,美国);Bcl-2抗体(Affinity Biosciences,美国);GAPDH抗体(普健生物,武汉);凋亡检测试剂盒(Vazyme Biotech,南京);线粒体跨膜电位检测试剂盒(JC-1)(Solarbio,北京);山羊血清(碧云天,上海);胎牛血清(Hyclone,美国);DMEM(Hyclone,美国)。
1.2 细胞培养及样品前处理
实验所用SH-SY5Y细胞购自ATCC,冻存于液氮中备用,复苏后用含10%胎牛血清的培养液在37 ℃、5% CO2的细胞培养箱中培养。
参考已发表的氟暴露与神经系统损伤相关研究[7-8],设定NaF染毒剂量为20、40、60 mg/L。配制4 mg/mL的NaF储备液,进一步用DMEM培养液依次稀释为20、40、60 mg/L NaF处理液,备用。
1.3 实验方法
1.3.1 线粒体跨膜电位(ΔΨm)检测 实验分组为对照组和20、40、60 mg/L NaF染毒剂量组。细胞按照对应剂量进行NaF染毒后,放入5% CO2、37 ℃恒温培养箱内24 h。收集细胞悬液,离心后弃去上清。加入1 mL JC-1(1×),37 ℃避光孵育20 min。1 mL预冷染色缓冲液(1×)洗2次。加入300 μL PBS后进行流式检测。
1.3.2 线粒体内活性氧(MitoROS)水平检测 细胞按照对应剂量进行NaF染毒后,放入5% CO2、37 ℃恒温培养箱内24 h。收集细胞悬液,离心后弃去上清。PBS洗1次。用PBS将5 mmol/L Mito-SOX Red探针储液稀释1000倍(工作浓度不超过5 μmol/L)。每组加入1000 μL工作液,37 ℃避光孵育10 min后进行流式检测。
1.3.3 Western blot检测Miro1(RHOT1)、ATG5、PINK1、PARP、cleaved Caspase-3和Bcl-2蛋白表达 细胞按分组染毒24 h后,收集细胞提取蛋白。采用BCA法对蛋白质进行定量。取各组蛋白样品经12% SDS分离胶电泳分离,然后将目的蛋白转至PVDF膜上,封闭。加入稀释的一抗(Miro1、ATG5和PINK1稀释度为1∶600;其余一抗稀释度均为1∶1000),4 ℃孵育过夜。PBST溶液漂洗3次,加入1∶5000稀释的二抗,室温孵育1 h。PBST溶液漂洗3次,在凝胶成像系统中以化学发光法显色,采集图像。
1.3.4 免疫荧光检测Miro1、ATG5和PINK1蛋白与线粒体共定位情况 各组细胞按照对应剂量进行NaF染毒后,放入5% CO2、37 ℃恒温培养箱内培养48~72 h。向培养液中加入线粒体探针MitoTracker Red CMXRos,使之终浓度为0.5 μmol/L,培养箱避光孵育30 min后吸弃培养液。PBS缓冲液轻柔洗涤3次,加入500 μL 4%多聚甲醛溶液,室温下放置15 min,再次以PBS缓冲液轻柔洗涤3次,加入500 μL 0.5%曲拉通-100,室温下放置20 min,再次以PBS缓冲液轻柔洗涤3次,加入500 μL山羊血清,室温下放置30 min。接着进行抗体孵育,一抗、二抗稀释比均为1∶50。PBST溶液漂洗3次,加入DAPI染液,避光放置5 min。PBST溶液漂洗4次,吸干残液,取出爬片,置于含防荧光淬灭剂的封片上,荧光显微镜下进行观察,采集图像。
1.3.5细胞凋亡检测 各组细胞按照对应剂量进行NaF染毒后,放入5% CO2、37 ℃恒温培养箱内24 h。收集细胞悬液,离心后弃去上清,加入1×结合缓冲液100 μL重悬细胞。向其中加入5 μL Annexin Ⅴ-FITC染液,室温下避光放置10 min,继续加入PI染液5 μL,室温条件下避光放置约15 min。随后补加1×结合缓冲液150 μL,上机进行流式检测。
1.4 统计学方法
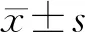
2 结果
2.1 NaF对神经细胞线粒体功能的影响
本研究采用ΔΨm和MitoROS两个指标来反映氟中毒对神经细胞线粒体功能的影响。与对照组比较,20、40和60 mg/L NaF染毒组的ΔΨm相对水平分别为36.07%、23.83%和11.22%,均明显降低(均P<0.01),且随着氟染毒剂量的增加,ΔΨm呈下降趋势(P<0.01)。相对于对照组,20、40和60 mg/L NaF染毒组的MitoROS相对水平分别为131.45%、179.23%和202.05%,均明显高于对照组(均P<0.05),且随着氟处理浓度的增加呈上升趋势(P<0.05)(图1)。

1:对照组;2:NaF 20 mg/L;3:NaF 40 mg/L;4:NaF 60 mg/L;*P<0.05 **P<0.01图1 经NaF处理后SH-SY5Y细胞内ΔΨm(A)、MitoROS水平(B)变化Fig.1 Levels of ΔΨm(A)and MitoROS(B)in SH-SY5Y cells after treatment with NaF
2.2 NaF对线粒体动力学和自噬相关蛋白表达的影响
采用Miro1、ATG5和PINK1这3个线粒体动力学和自噬相关蛋白指标来反映氟中毒对神经细胞线粒体动力学和自噬的影响。与对照组相比,Miro1、ATG5和PINK1在40和60 mg/L NaF处理组的表达水平均显著提高(均P<0.01),且随着氟染毒剂量的增加,蛋白表达均呈上升趋势(P<0.05)(图2)。

1:对照组;2:NaF 20 mg/L;3:NaF 40 mg/L;4:NaF 60 mg/L;A~C:分别为Miro1(A)、ATG5(B)和PINK1(C)的蛋白表达水平统计;D:蛋白电泳条带;# P<0.05;与对照组比较,**P<0.01图2 经NaF处理后SH-SY5Y细胞内线粒体动力学和自噬相关蛋白的表达水平变化Fig.2 Expression levels of mitochondrial dynamics-related and autophagy-related proteins in SH-SY5Y cells after treatment with NaF
在细胞免疫荧光检测中,3个蛋白被绿色荧光蛋白标记,利用MitoTracker Red CMXRos探针和DAPI进行线粒体和胞核双染,以观察蛋白与线粒体的共定位状态。随着氟染毒剂量的增加,Miro1、ATG5和PINK1蛋白的荧光斑点逐渐增强,数量增加,且不断向线粒体内聚集,提示过量氟可导致Miro1、ATG5和PINK1线粒体动力学和自噬相关蛋白表达增加,并诱导其转入线粒体,从而促进其在线粒体内发挥作用,如激活自噬相关分子生物学过程和诱导凋亡等。免疫荧光检测结果(图3~5)与Western blot蛋白定量结果一致。

绿色荧光为标记的Miro1蛋白;红色荧光为MitoTracker Red CMXRos探针标记的线粒体;蓝色荧光为DAPI标记的细胞核;Rr为Pearson相关系数图3 经NaF处理后SH-SY5Y细胞内Miro1蛋白与线粒体共定位情况Fig.3 Colocalization of Miro1 and mitochondria in SH-SY5Y cells after treatment with NaF
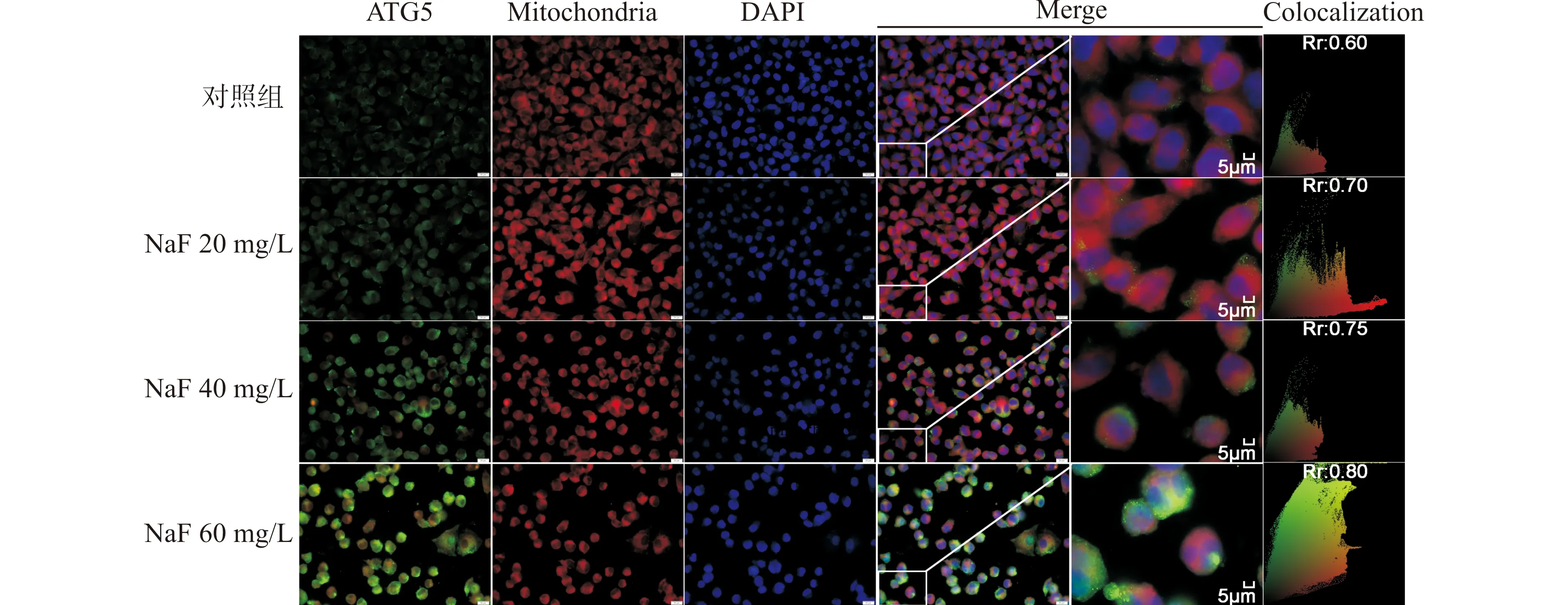
绿色荧光为标记的ATG5蛋白;红色荧光为MitoTracker Red CMXRos探针标记的线粒体;蓝色荧光为DAPI标记的细胞核;Rr为Pearson相关系数图4 经NaF处理后SH-SY5Y细胞内ATG5蛋白与线粒体共定位情况Fig.4 Colocalization of ATG5 and mitochondria in SH-SY5Y cells after treatment with NaF

绿色荧光为标记的PINK1蛋白;红色荧光为MitoTracker Red CMXRos探针标记的线粒体;蓝色荧光为DAPI标记的细胞核;Rr为Pearson相关系数图5 经NaF处理后SH-SY5Y细胞内PINK1蛋白与线粒体共定位情况Fig.5 Colocalization of PINK1 and mitochondria in SH-SY5Y cells after treatment with NaF
2.3 NaF对细胞凋亡的影响
通过凋亡率、凋亡蛋白PARP和cleaved Caspase-3及抗凋亡蛋白Bcl-2的表达来反映氟中毒对神经细胞凋亡的影响。细胞早期凋亡率在对照组为2.58%,在40和60 mg/L NaF染毒组则分别为6.89%和8.36%,明显高于对照组(均P<0.01),且随着氟浓度的增加呈上升趋势(P<0.05);对照组细胞总凋亡率为3.14%,40和60 mg/L NaF染毒组总凋亡率则分别为8.57%和11.70%,明显高于对照组(P<0.01),且随着氟剂量的增加呈升高趋势(P<0.05)(图6)。与对照组相比,60 mg/L NaF处理组凋亡蛋白PARP的表达水平显著升高(P<0.05);凋亡蛋白cleaved Caspase-3的表达在40和60 mg/L NaF染毒组均有所提高(均P<0.05),且随着氟染毒浓度的增加呈上升趋势(P<0.05);抗凋亡蛋白Bcl-2的表达情况则相反,随着氟染毒剂量的增加,Bcl-2的相对表达量呈下降趋势(P<0.05),与对照组相比,40和60 mg/L NaF染毒组Bcl-2表达量明显降低(均P<0.01)(图7)。

1:对照组;2:NaF 20 mg/L;3:NaF 40 mg/L;4:NaF 60 mg/L;**P<0.01图6 经NaF处理后SH-SY5Y细胞凋亡情况Fig.6 Apoptosis rates of SH-SY5Y cells after treatment with NaF

1:对照组;2:NaF 20 mg/L;3:NaF 40 mg/L;4:NaF 60 mg/L;A~C:分别为PARP、cleaved Caspase-3和Bcl-2的蛋白表达水平统计;D:蛋白电泳条带;与对照组比较,*P<0.05 **P<0.01图7 经NaF处理后SH-SY5Y细胞凋亡相关蛋白的表达水平Fig.7 Expression levels of apoptosis-related proteins in SH-SY5Y cells after treatment with NaF
3 讨论
本研究通过检测经不同浓度NaF处理后SH-SY5Y细胞线粒体功能、线粒体动力学和自噬相关蛋白表达变化及细胞凋亡情况,探讨过量氟暴露对神经系统的损伤机制。本研究发现,经NaF处理后SH-SY5Y细胞ΔΨm下降,MitoROS水平上升,线粒体动力学和自噬相关蛋白(Miro1、ATG5和PINK1)表达上升并向线粒体内聚集,细胞凋亡率增加,凋亡蛋白(PARP和cleaved Caspase-3)表达上升,抗凋亡蛋白Bcl-2表达下降。且随着NaF浓度增加,上述各指标变化程度增加。
线粒体是由双层膜围成的囊状结构,线粒体基质内的质子泵出,进入线粒体膜间隙,即形成ΔΨm。正常的ΔΨm是维持线粒体进行氧化磷酸化、产生ATP的先决条件[9]。ΔΨm可反映线粒体内膜通透性,线粒体内膜通透性增加、ΔΨm改变是细胞凋亡信号转导过程的早期事件[10]。随着NaF浓度增加,SH-SY5Y细胞ΔΨm明显下降,表明过量氟暴露诱导了线粒体功能障碍,而细胞在早期凋亡时均有ΔΨm的下降[11],因此ΔΨm降低提示SH-SY5Y细胞发生了早期凋亡,这与流式检测凋亡的结果一致。MitoROS水平可反映细胞氧化应激的程度,ROS生成增加可引发神经元突触功能减退及神经元死亡[12]。本研究中,随着NaF浓度增加,SH-SY5Y细胞MitoROS水平呈上升趋势,表明氟化物可能通过氧化应激途径损伤神经细胞。
神经系统是机体氧耗量最高的系统,线粒体不断在胞体和轴突之间转运和重新分布,对于维持神经元的正常代谢活动非常重要。Miro1为线粒体衔接蛋白,可调控线粒体沿微管的移动[13],将受损线粒体逆行运送至胞体,从而被降解和回收,同时将正常线粒体顺向运送至神经元的功能部位,降低氧化应激损伤,发挥正常功能[14]。在氧化应激环境下,受损的线粒体可启动自噬过程,被包裹入自噬体中,经溶酶体途径完成降解过程,达到及时清除受损线粒体和异常蛋白等成分的目的,对维持线粒体正常功能和细胞稳态有重要意义[15]。自噬蛋白ATG5可与ATG家族其他蛋白结合为复合体,通过PERK等信号通路发挥自噬作用[16],PINK1则可招募E3泛素链接酶Parkin,通过PINK1/Parkin通路作用于Miro1发挥线粒体移动作用或启动线粒体自噬[17-18]。自噬的作用具有双向性,适度的自噬有助于受损成分的清除和重新利用,促进细胞生存;但在氧化应激等损伤过度情况下,自噬则会诱导细胞死亡[19]。随着NaF浓度增加,SH-SY5Y细胞Miro1、ATG5和PINK1的表达水平均升高,说明线粒体的转运和自噬活动增强,提示线粒体可能通过增强转运和自噬来代偿性地保护神经元功能,但也要注意过度自噬可能会加重损伤从而诱导自噬性细胞死亡。
PARP和Caspase-3在细胞凋亡中具有重要作用。当存在低水平DNA损伤时,PARP活化后可促进细胞存活,然而当存在广泛DNA损伤时,PARP过度激活将导致细胞死亡[20]。Caspase-3活化后可成为cleaved Caspase-3,进而启动细胞凋亡,这一过程在一定程度上可被抗凋亡蛋白Bcl-2阻断。本研究发现,随着NaF浓度增加,SH-SY5Y细胞PARP和Caspase-3表达增加,Bcl-2表达减少,提示过量氟化物可诱导细胞凋亡。并且流式检测出SH-SY5Y细胞早期凋亡率、总凋亡率均上升,与之一致。
综上所述,在体外SH-SY5Y细胞染毒实验中,通过检测在不同氟染毒剂量下线粒体跨膜电位、氧化应激水平、线粒体转运和自噬水平以及细胞凋亡情况,提示氟暴露可能通过促进线粒体的氧化应激、转运和自噬而参与神经损伤。本研究有助于阐明线粒体在氟暴露所致神经损伤中的作用机制,为寻找氟神经毒性潜在的早期效应生物学标志及对氟神经毒性的早期干预提供新思路。
