长链非编码RNA在妊娠相关疾病中的研究进展
2021-10-27唐淮云汤丽莎
唐淮云,汤丽莎
(连云港市妇幼保健院生殖医学科,连云港 222000)
长链非编码RNA(Long non-coding RNA,lncRNA)是一种结构与mRNA相似的、长度大于200个核苷酸的非编码RNA(ncRNA),分布在细胞核和细胞质中,近年已成为疾病研究的热点。虽然lncRNA编码蛋白能力很低,但它们在印迹调控、DNA甲基化、细胞周期、细胞凋亡、血管生成等生物学调控中发挥着重要作用,参与了很多疾病的发生发展。
近年lncRNA在肿瘤、心血管、免疫等重大疾病方面的机制研究取得了瞩目进展。在胎盘中被识别的lncRNA数量也日益增加。研究也证实了lncRNA与胎盘发育存在明显相关性,lncRNA可通过影响胎盘形成、子宫胎盘循环、内皮细胞等功能促使妊娠相关疾病的发生。本文总结了参与妊娠相关疾病发生的lncRNA及其作用机制。
一、子痫前期(Preeclampsia,PE)相关的lncRNA
PE是最常见和严重的妊娠并发症之一,是孕产妇和胎儿产前死亡的主要原因[1],全球发病率为5%~7%[2]。滋养层细胞过度凋亡、对子宫壁的不良侵袭、母胎界面螺旋动脉重构受损是PE主要的胎盘病理改变[3]。近年,全基因组表达模式显示,PE胎盘中存在数百个lncRNA异常表达,这些异常表达的lncRNA可能使其靶基因功能异常,从而影响胎盘功能,导致PE的发生。
1.通过影响滋养层细胞功能参与PE发生的相关lncRNA:绒毛外滋养层细胞正常侵袭与迁移是胎盘形成、妊娠完成的基本前提,而体内微环境可对绒毛外滋养层细胞的侵袭、迁移能力进行精确调节,调控胎盘血管的重塑,影响妊娠过程和结果。研究发现多个lncRNA参与调控了这一过程:(1)lncRNA TUG1蛋白在PE患者的胎盘组织中表达降低。TUG1过表达促进体外两种滋养层细胞(HTR-8/SVneo和 BeWo细胞系)的增殖、侵袭和血管生成,抑制滋养层细胞的凋亡。TUG1可以通过改变miR-29b的表达影响髓样细胞白血病-1(MCL1)、血管内皮生长因子A(VEGFA)和金属基质蛋白酶2(MMP2)的基因表达和蛋白水平,参与PE的发生发展[4]。ZEB2-AS1是PE患者胎盘中异常表达的新型lncRNA,可通过靶向miR-149/PGF轴,调节滋养层细胞系HTR-8/SVneo的增殖和侵袭潜能[5]。(2)重症PE患者胎盘组织中Linc00261表达上调,通过靶向miR-558/TIMP4轴抑制滋养层细胞的侵袭和迁移[6]。同样在重度PE的孕妇胎盘组织中FAM99A[7]和SNHG5[8]的表达水平下调,体外过表达FAM99A及SNHG5均可通过靶向Wnt/β-catenin信号传导促进HTR-8/SVneo细胞的侵袭和迁移。(3)先兆子痫患者的胎盘中lncRNA DLX6-AS1被证实显著上调,DLX6-AS1的过表达显著降低JEG3和HTR-8/SVneo细胞的增殖、迁移和侵袭。进一步分子机制研究表明,DLX6-AS1可能损害miR-376c/GADD45A轴,降低滋养层细胞的增殖、迁移和侵袭能力,因而导致先兆子痫的发生[9]。(4)lncRNA uc003fir与microRNAs相互作用,影响滋养层细胞对子宫肌层的侵袭,可以作为PE的靶点[10]。
2.通过其他机制参与PE发生的lncRNA:一项研究发现,HK2P1和HK2的表达下调可能通过抑制糖酵解和削弱蜕膜形成而导致先兆子痫的发生发展[11]。HK2是一种参与糖酵解的关键酶,HK2P1或HK2的下调对子宫蜕膜化具有重要意义。H19 rs217727、rs3741219与rs2107425三种多态性与PE易感性之间没有关系,此外,以上H19的3种多态性的CTC、TTC和TTT单倍型与PE的较高风险相关[12],但具体机制不详。
综上,lncRNA多通过调节滋养层细胞的功能导致患者胎盘功能异常,从而促使PE的发生,其与microRNAs相互作用、调控EGFR-JAK/STAT[13]、MAPK[14]、Wnt/β-catenin等信号通路为目前发现的主要分子生物学机制。另有研究发现,lncRNA通过介导募集促炎细胞因子、抑制糖酵解以及自噬等途径影响PE的发生发展。具体详见表1。
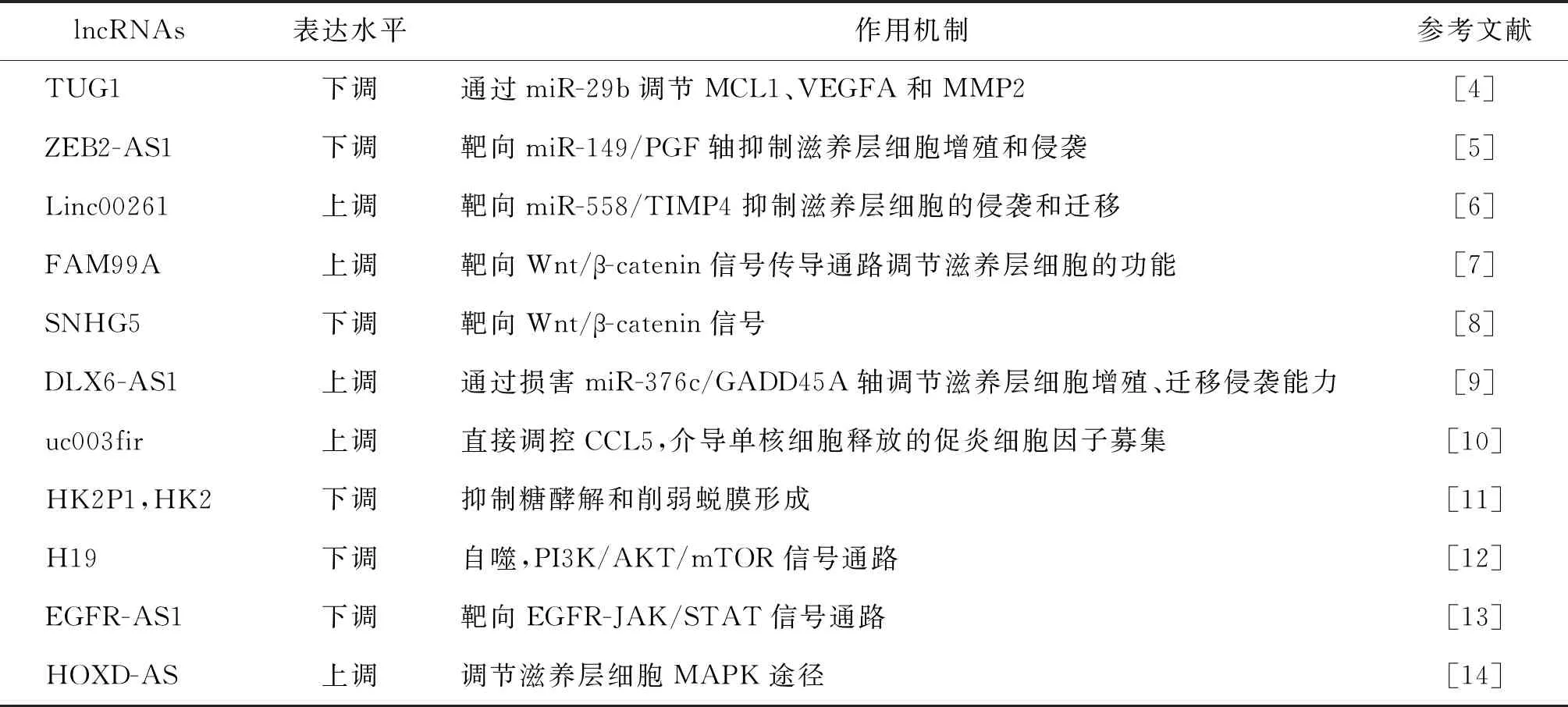
表1 PE患者胎盘组织异常表达的lncRNA
二、复发性流产(Recurrent miscarriage,RM)相关的lncRNA
RM是指与同一伴侣遭受3次或3次以上自然流产。RM病因复杂,已明确的病因包括解剖因素、遗传因素、内分泌因素、血栓前状态、感染因素、免疫性因素等。据估计,仍有50%的RM病因不明,表观遗传和环境中的一些未知因素可能与RM存在相关性。lncRNA可通过表观修饰参与X染色体沉默、基因组印迹、染色体剂量补偿效应等关键生命活动,对于胚胎的顺利发育和组织细胞正常分化发挥了特殊作用[15-16]。但lncRNA在RM中的作用机制研究仍然处于初始阶段,绝大多数分子调控机制尚不明确。
1.感染、炎症与RM:Wang等[17]收集自然流产和人工流产的胚胎和蜕膜,并用全基因组lncRNA微阵列分析,结果发现感染和炎症通路在流产中占主导地位,推测孕妇发生的大多数亚临床感染和炎症可能是自然流产的主要的潜在机制。Wang等[18]研究认为,趋化因子-细胞因子途径可能在自然流产、早产等不良妊娠致病机制中发挥重要作用。
2.甲基化异常与RM:Ankolkar等[19]发现,父源印迹控制区域的甲基化在DLK1-GTL2、MEST(PEG1)、ZAC(PLAGL1)和全基因组的甲基化水平与特发性复发性流产(Idiopathic Recurrent Spontaneous miscarriages,IRSM)无明显相关性,不是诊断IRSM的良好表观遗传标记。Ankolkar等[20]通过对精子参数与H19ICR甲基化水平的分析研究发现,IRSM组与对照组的父亲年龄和精液参数均无显著性差异,但ISRM组H19 ICR甲基化水平显著低于对照组。
3.基因多态性与RM:遗传因素在反复流产的易感性中可能起多种作用。研究者通过比较分析RM组和对照组患者两种lncRNA CCAT2多态性(rs6983267和rs3843549)的基因分型,发现lncRNA CCAT2中的rs6983267 G等位基因与RM易感性降低存在相关性,携带两个不利等位基因的女性比没有或只有一个不利等位基因者表现出低反复流产风险[21]。SOX2OT基因中的rs9839776 C基因型与复发流产风险增加之间也存在显著相关性[22]。
4.糖酵解与RM:微阵列和GEO数据库分析发现,EPB41L4A-AS1在RM早期胎盘组织中高表达,在阻断糖酵解、增强对脂肪酸氧化依赖性等方面有关键作用,通过调节HIF-1a和VDAC1的表达导致代谢重编程,从而影响胎盘发育,促进滋养层细胞凋亡,导致流产发生[23]。
5.滋养层细胞侵袭、迁移功能改变与RM:HOTAIR在RM患者滋养层细胞中的表达降低,通过调节滋养层细胞的迁移和侵袭促进RM和/或PE的发生。进一步研究发现,TTP/HOTAIR在妊娠早期滋养层细胞侵袭中是一条调控新途径[24]。生物信息学分析发现在HOTAIR启动子区域发现两个YY1结合位点,YY1通过HOTAIR激活PI3K-AKT信号通路,促进MMP2的表达,增强了滋养层细胞的侵袭和迁移能力,因此HOTAIR可作为治疗RM的潜在作用靶点[25]。
三、其他病理妊娠和生殖疾病中的lncRNA
1.lncRNA与妊娠期肝内胆汁淤积症(Intrahepatic cholestasis of pregnancy,ICP):lncRNA在ICP的表达和功能鲜有研究。研究发现,Linc02527在ICP患者的胎盘和血清中表达增加,在HTR8细胞中过表达促进自噬并增殖;进一步研究发现,Linc02527通过miR-3185调节ATG5和ATG7的表达,还可直接与YBX1结合并激活P21,导致C57小鼠的生长受到阻碍[26]。
2.lncRNA与胎膜早破:到目前为止,胎膜早破的致病机制尚不清楚。微阵列鉴定出lncRNA在早产儿与未足月胎膜早破(PPROM)产妇的胎盘中存在差异表达,推测lncRNA可能参与了PPROM的发病过程;功能分析显示,感染和炎症反应、ECM-受体相互作用、细胞凋亡、肌动蛋白细胞骨架和平滑肌收缩是导致PPROM的主要途径[27]。另有研究发现,9对泛素-蛋白酶体-胶原(CUP)通路相关的mRNA和相关的lncRNA在PPROM和自发性早产患者胎盘组织中存在表达差异,表明了CUP途径与PPROM的发生发展有关[28]。从自发性早产和PPROM产妇胎盘中同样鉴定出差异表达的lncRNA,通过调控其相关mRNA,启动泛素-蛋白酶体系统与感染-炎症途径可能参与其作用机制[29]。
3.lncRNA与生殖:另外,lncRNA在生殖疾病方面的功能也引起了关注。卵巢早衰(POI)是影响育龄妇女生育能力的主要疾病之一,部分患者病因不清楚。最新研究发现,HCP5在POI患者颗粒细胞中表达降低,通过与YB1相互作用调节MSH5转录和DNA损伤修复,从而导致颗粒细胞功能失调,为POI发病机理提供了新的表观遗传机制[30]。Qiu等[31]也研究了lncRNA Gtl2在种植前发育中的作用,Gtl2的敲除破坏了滋养层细胞的生长,并下调了Dlk1 Dio3印迹区邻近基因。另有研究发现,参与人类早期胚胎发育的lncRNAs与卵母细胞成熟以及线粒体功能均有关[32]。2017年Borensztein等[33]发现,lncRNA Xist仅在植入前雌性小鼠胚胎的父源X染色体上表达,并介导该染色体的转录沉默,表明了在早期胚胎发育过程中遗传和表观遗传学调节X染色体转录沉默的作用。男性不育是由遗传、环境和生活方式多因素共同导致的,临床发病率日趋增高。最近的研究表明,印迹基因内的差异甲基化区域异常可能与特发性男性不育有关[34]。lncRNA还可以通过竞争性内源RNA(ceRNA)调控网络在男性非梗阻性无精子症的发生发展中起重要作用,可作为治疗该疾病的生物标记[35]。
四、结语与展望
与mRNA相比,lncRNA虽然表达丰度较低,但却具有更多的细胞类型及组织特异性,逐渐成为各领域研究热点,目前在肿瘤机制方面的研究展现出良好的诊断和治疗前景。但在病理妊娠及生殖疾病方面lncRNA的研究相对较少。综合目前研究证据来看,lncRNA与微小RNA结合或者通过多种信号通路调节胎盘滋养层细胞增殖、迁移和侵袭能力,还可以通过促进炎症反应、自噬、影响糖酵解等机制参与子痫前期、复发性流产等疾病的发生发展,但作用机制仍待进一步研究。根据lncRNA用于肿瘤预防和治疗的研究成果,在生殖、妊娠疾病方向lncRNA有望成为特异性的诊断和治疗靶点,提高临床诊治效果,促进女性全生命周期生殖健康。
