黄腐酚与异黄腐酚对变形链球菌致龋毒力因子的抑制作用
2021-10-27杨若琪
杨若琪,李 泉,王 涛,刘 东*
(1.胜利油田中心医院 口腔科,山东东营 257029;2.山东中医药大学 药学院,山东 济南 250355;3.潍坊医学院附属医院 中医科,山东 潍坊 261000)
0 引言
龋齿是由口腔细菌引起的一种常见的慢性感染性疾病,其特征在于牙釉质被逐渐破坏[1].变形链球菌(Streptococcus mutans)是口腔中常见的革兰氏阳性兼性厌氧细菌,因其在不同培养基中生长时形态发生变化而得名[2].变形链球菌在龋齿发病机理中的作用已有充分的文献记载,它的致龋能力强于其它口腔链球菌,通常以生物被膜(Biofilm)的形式存在[3].与单细胞浮游状态的微生物不同,生物被膜状态的微生物表现出一系列新的生物学特征,并具有更强的适应外界环境的能力[4].牙菌斑生物被膜是一个以细菌为主定植于牙齿表面的微生态环境,是龋病发生的始动因子[5].
人类使用天然药物预防和治疗口腔疾病最早可以追溯到几千年前.尽管目前对于龋齿的病因学研究取得了长足的进步,但用于控制牙菌斑生物被膜的化学制剂仍以广谱抗菌剂为主[6].口腔生态学的观点认为:长期使用广谱抗菌药物反而会导致口腔生态失衡.大多数市售的口腔护理产品都含有洗必泰,但是长时间使用高浓度的洗必泰具有明显的副作用,例如牙渍,形成牙结石以及暂时性的味觉障碍[7].
近年来,随着中草药研究的不断深入,中药单体以其良好的生物学特性成为了研究的热点.许多中药单体化合物表现出了对口腔病原微生物的抗龋活性[8].黄腐酚和异黄腐酚是桑科植物啤酒花(Humulus lupulus Linn.)中含量最高的黄酮类化合物.研究显示这两种化合物对金黄色葡萄球菌(Staphylococcus aureus)、粪肠球菌(Enterococcus faecalis)等革兰氏阳性菌具有不同程度的抑菌活性,然而关于它们在口腔疾病防治领域的报道却相对较少[9,10].因此,本研究旨在探讨黄腐酚和异黄腐酚对口腔主要致龋细菌——变形链球菌的生长、产酸性、耐酸性以及生物被膜形成的影响,为新型抗龋药物的研发和临床应用提供参考.
1 材料与方法
1.1 实验材料
黄腐酚(批号6754-58-1)、异黄腐酚(批号70872-29-6),购于成都瑞芬思生物科技有限公司;变形链球菌(S.mutans)UA159,由山东中医药大学微生物教研室提供;BHI培养基(批号B8130),购于北京索莱宝生物科技有限公司;2.5%戊二醛固定液(批号DF0156),购于北京雷根生物技术有限公司;DNM-9602酶标仪(北京普朗新技术有限公司);PHS-3C型pH 计(上海虹益仪器仪表有限公司);E200 厌氧培养箱(美国GeneScience 公司);ImageStream X Mark II量化成像分析流式细胞仪(美国Merck公司);Quanta 250 FEG 场发射扫描电子显微镜(美国FEI公司).
1.2 实验方法
1.2.1 药液以及菌液的制备
将实验组药物黄腐酚、异黄腐酚用无水乙醇配置成10 mg/m L的母液,用BHI培养基进行梯度二倍稀释.用接种环将变形链球菌UA159接种于BHI液体培养基中,37 ℃过夜厌氧培养.
1.2.2 生长曲线和最低抑菌浓度的测定
在37 ℃厌氧条件下,将处于对数生长期的变形链球菌UA159(初始接种量为5×105CFU/m L)与不同浓度的实验组药物在BHI培养基中共同孵育12 h,在此过程中每隔2 h 用酶标仪测量600 nm 处的吸光度.孵育结束后,肉眼观察细菌的生长情况,将完全抑制细菌可见生长的最低浓度定义为药物的最低抑菌浓度(minimum inhibition concentration,MIC).
1.2.3 流式细胞术
将变形链球菌UA159的终浓度在BHI培养基中稀释至5×105CFU/m L.将菌悬液与不同浓度的实验组药物共同厌氧孵育12 h,在用无菌蒸馏水洗涤后,将细菌重悬于1 mL NaCl溶液中.将稀释2 500倍的荧光染料SYTO 9和PI加入菌悬液中,并在黑暗环境下孵育15 min,随后立即进行流式细胞术分析.
1.2.4 产酸实验
在含有1%(w/v)蔗糖的BHI培养基中加入初始菌浓为5×105CFU/m L 的变形链球菌UA159和亚MIC浓度的实验组药物,起始pH 值均被调节至7.1.在37℃厌氧孵育12 h的过程中,每隔2 h测定pH 值的变化情况.
1.2.5 耐酸实验
将变形链球菌UA159在BHI培养基中培养至对数生长期(初始菌浓为1×107CFU/m L),然后加入到含有不同浓度实验组药物的TYEG 液体培养基中(10%胰蛋白胨、5%酵母提取物、3%K2HPO4和1%葡萄糖,pH 5.0).在37 ℃厌氧条件下孵育2 h后,将菌悬液稀释并涂布在BHI固体平板上,24 h后对存活细菌进行计数.
1.2.6 结晶紫染色法
将过夜培养的变形链球菌UA159 的初始菌浓稀释至1×107CFU/m L,然后接种到含有1%(w/v)蔗糖的BHI培养基中.将黄腐酚和异黄腐酚以不同的浓度加入到上述培养基中,37 ℃厌氧孵育12 h.孵育完成后,丢弃浮游细胞,并用无菌蒸馏水冲洗,随后用0.4%的结晶紫溶液染色10 min.用无菌蒸馏水再次冲洗后,加入33%的冰醋酸溶液.通过酶标仪测定590 nm 处的吸光度以定量生物被膜的形成情况.
1.2.7 扫描电子显微镜(scanning electron microscope,SEM)
将无菌盖玻片(φ10 mm)放置到24孔板中,随后如1.2.6所述将不同浓度的实验组药物和变形链球菌UA159加入每个到孔中,并在37℃厌氧条件下孵育12 h.孵育完成后,用无菌蒸馏水轻轻洗涤盖玻片上形成的变形链球菌生物膜,并用2.5%戊二醛固定,最后用不同浓度的乙醇溶液依次进行脱水.将处理好的盖玻片镀金并通过SEM 以5 000和20 000倍的放大倍数进行观察.
1.2.8 统计学方法
数据采用SPSS统计软件(IBM SPSS Statistics 25,USA)进行单因素方差分析(ANOVA).所有实验重复3次,结果以均数±标准差(SD)表示.当P<0.05时认为差异有统计学意义.
2 结果与讨论
2.1 黄腐酚与异黄腐酚对变形链球菌浮游细胞生长的影响
黄腐酚和异黄腐酚对变形链球菌的MIC值分别为32μg/m L和1 024μg/m L(如表1所示).生长曲线显示(如图1(a)、(b)所示),与未经处理的对照组相比,黄腐酚和异黄腐酚在MIC 浓度下明显抑制了变形链球菌浮游细胞的生长.通过流式细胞术结合荧光染料SYTO 9和PI来分析黄腐酚和异黄腐酚处理后变形链球菌浮游细胞的存活比例.与未处理的对照组相比(如图2(e)所示),随着黄腐酚和异黄腐酚浓度的提高,Q2区域的活菌比例逐渐增加,而Q3区域的活菌比例则逐渐下降.32μg/m L和16μg/m L的黄腐酚处理后存活细菌的百分比为30%~50%(如图2(a)、(b)所示),而1 024μg/m L和512μg/m L的异黄腐酚处理后存活细菌的百分比为25%~60%(如图2(c)、(d)所示).

表1 黄腐酚和异黄腐酚的MIC值
目前,关于天然药物在龋齿防治领域的研究主要集中在对口腔细菌(特别是变形链球菌)的生长抑制方面[7].由于龋齿是一种细菌感染性疾病,因此抗菌活性实验是筛选抗龋药物的重要途径之一.本研究通过MIC和生长曲线测定了黄腐酚与异黄腐酚对变形链球菌浮游细胞生长的抑制作用(如图1所示).结果表明,当黄腐酚与异黄腐酚的浓度低于MIC时,二者对浮游细胞生长的抑制效果逐渐减弱.对比来说,黄腐酚的抑菌活性强于异黄腐酚.此外,还采用流式细胞术来确定黄腐酚与异黄腐酚处理后活/死细菌的分布情况(如图2 所示).SYTO 9是一种绿色荧光染料,可以穿透活细胞和死细胞,而红色荧光染料PI只能穿透死细胞.流式细胞术的结果显示黄腐酚与异黄腐酚处理后PI染色或双染色的细菌细胞比例较高.以上结果共同证实了黄腐酚与异黄腐酚能够抑制变形链球菌浮游细胞的生长.
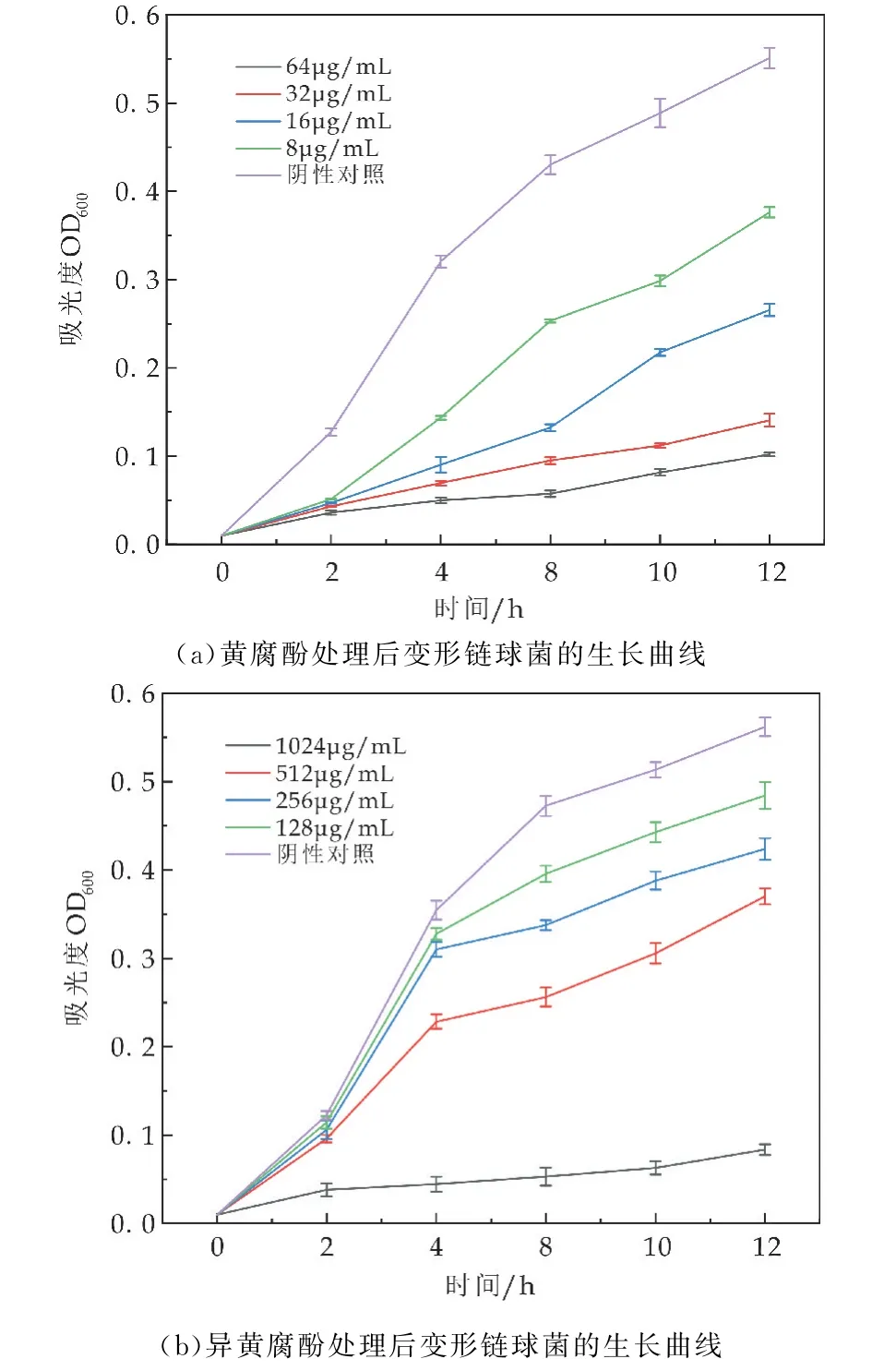
图1 黄腐酚与异黄腐酚对变形链球菌浮游细胞生长的影响

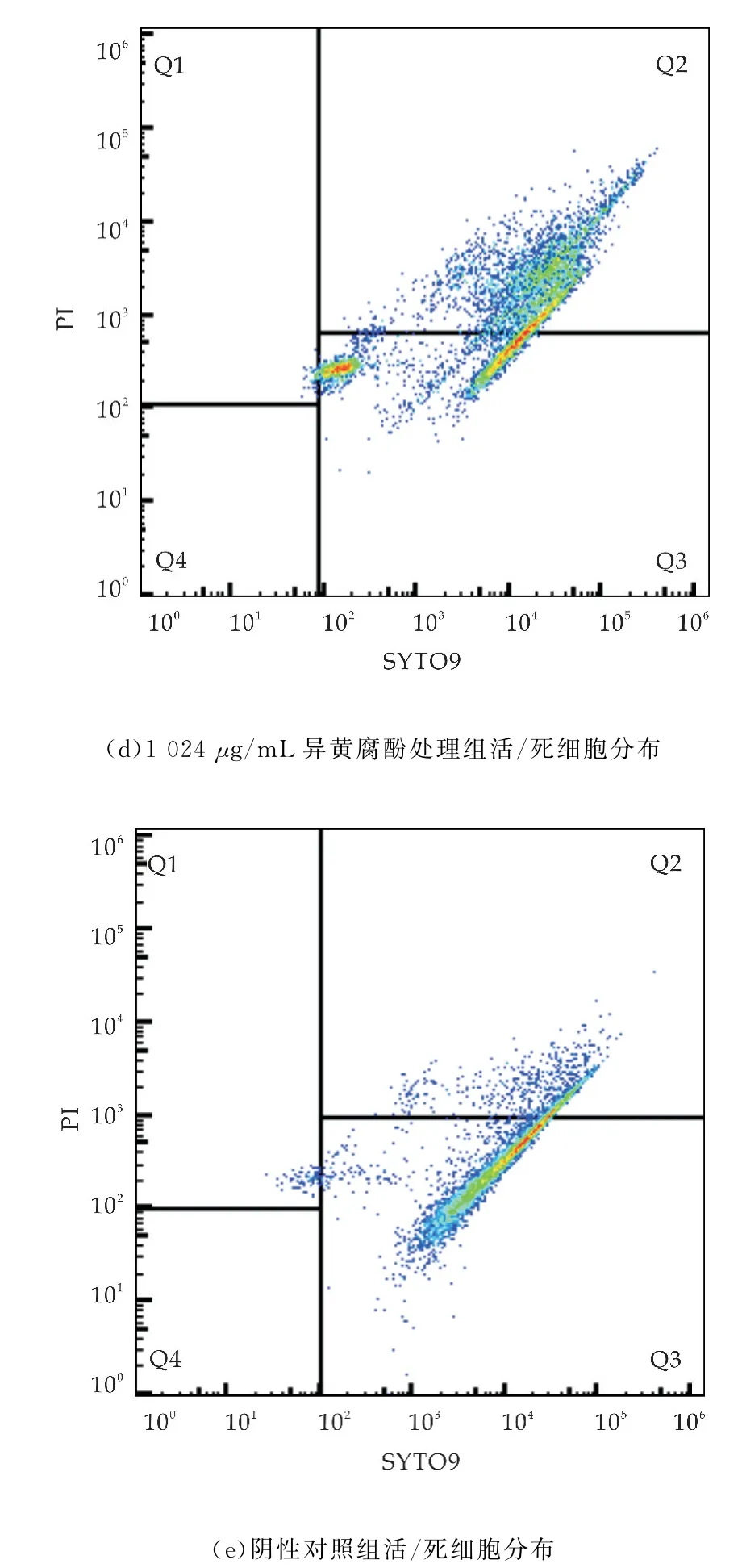
图2 流式细胞术结果(Q1代表仅被PI染色的细菌细胞,Q2代表同时被SYTO9和PI染色的细菌细胞,Q3代表仅被SYTO9染色的细菌细胞,Q4代表未被SYTO9和PI染色的细菌细胞)
2.2 黄腐酚与异黄腐酚对变形链球菌产酸性的影响
通过测定pH 值的变化来确定亚MIC 浓度的黄腐酚和异黄腐酚是否抑制了变形链球菌的产酸性,结果如图3所示.孵育12 h后,未处理对照组的pH 值从7.1降低到4.2.1/2MIC 浓度的黄腐酚(16μg/m L)和异黄腐酚(512μg/m L)对pH 值的下降具有显著的抑制作用(最终pH 为6.0~6.5).但是这两种化合物在1/4MIC及更低的浓度下对变形链球菌的产酸性几乎没有影响.

图3 黄腐酚与异黄腐酚对变形链球菌产酸性的影响
2.3 黄腐酚与异黄腐酚对变形链球菌耐酸性的影响
如图4 所示,与未处理的对照组相比,用1/2MIC和1/4MIC 浓度的黄腐酚(16μg/m L 和8μg/m L)处理2 h后变形链球菌在酸性条件下的存活率降低了85%~95%.同样地,1/2MIC 浓度的异黄腐酚(512μg/m L)处理后也使变形链球菌的存活率降低了85%.以上结果表明亚MIC 浓度的黄腐酚与异黄腐酚对变形链球菌的耐酸性也有一定的影响.
在牙菌斑生物被膜形成的过程中,pH 值是主要的影响因素之一.当临界pH 值达到5.0~5.5时,牙釉质表面的脱矿化率就超过再矿化率,进而导致牙釉质的硬度明显降低[11].变形链球菌可以通过快速发酵食物中的糖类产生有机酸(例如乳酸、甲酸、乙酸等),这些酸性物质会使牙菌斑的pH 降低至5.0以下(产酸性)[12,13].同时变形链球菌具有在酸性条件下生长并代谢碳水化合物的能力(耐酸性)[14].变形链球菌的产酸性及耐酸性有利于其在牙齿生物被膜中的持续存活和定植,是变形链球菌致龋性的关键毒力因子[15].
天然药物对变形链球菌产酸性和耐酸性的影响已有相关的报道[16].然而,许多化合物抑制变形链球菌产酸性和耐酸性的能力主要与其对浮游细胞生长的抑制作用有关.在本研究中,使用亚MIC浓度的黄腐酚与异黄腐酚以消除因其抗菌活性而导致的假阳性结果.糖酵解pH 下降实验的结果显示,黄腐酚与异黄腐酚通过抑制细菌的糖酵解途径,在1/2MIC浓度下减少了变形链球菌有机酸的产生,但在其他浓度下的抑制作用并不明显(如图3所示).耐酸实验的结果显示,亚MIC 浓度的黄腐酚与异黄腐酚可以显著减少p H5.0时存活的变形链球菌的数量(如图4所示).
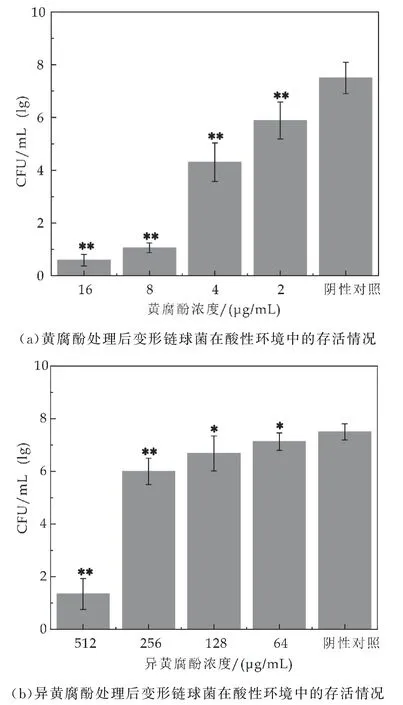
图4 黄腐酚与异黄腐酚对变形链球菌耐酸性的影响(与对照组比较,*表示p<0.05;**表示p<0.01)
2.4 黄腐酚与异黄腐酚对变形链球菌生物被膜形成的影响
结晶紫染色的结果表明(如图5所示),黄腐酚与异黄腐酚对变形链球菌生物被膜的形成具有抑制作用.具体来说,512μg/m L和256μg/m L的黄腐酚处理12 h 后,细菌生物被膜的形成减少了80%~90%.相同浓度的异黄腐酚对生物被膜形成的抑制作用稍弱,处理12 h后细菌生物被膜的形成减少了65%~85%.通过SEM 观察黄腐酚与异黄腐酚处理后变形链球菌生物被膜的结构,对照组中生物被膜的外观相对均匀,细胞排列紧密(如图6(c1)、(c2)所示).128μg/m L 的黄腐酚与异黄腐酚处理后盖玻片上形成的生物被膜减少,但是细胞形态没有发生明显的变化(如图6(a3)、(a4)、(b3)和(b4)所示).值得注意的是,512μg/m L 的黄腐酚与异黄腐酚处理后,变形链球菌的数量显著减少,生物被膜的结构也被严重破坏(如图6(a1)、(a2)、(b1)和(b2)所示).
由于具有定植在牙齿坚硬表面上的能力,变形链球菌在口腔中大多以生物被膜而不是浮游细胞的状态生存[4].考虑到牙菌斑生物被膜在变形链球菌致龋性中的重要作用,本研究分析了黄腐酚与异黄腐酚对生物被膜形成的影响.结晶紫染色的结果显示,两种化合物都可以有效减少变形链球菌生物被膜细胞的数量(如图5所示).此外,通过SEM 观察到对照组中的变形链球菌形成了多层并且覆盖整个表面的生物被膜,而药物处理组中形成的生物被膜完整性遭到了破坏且细胞较为分散(如图6所示).

图5 黄腐酚与异黄腐酚对变形链球菌生物被膜形成的影响(与对照组比较,*表示p<0.05;**表示p<0.01)
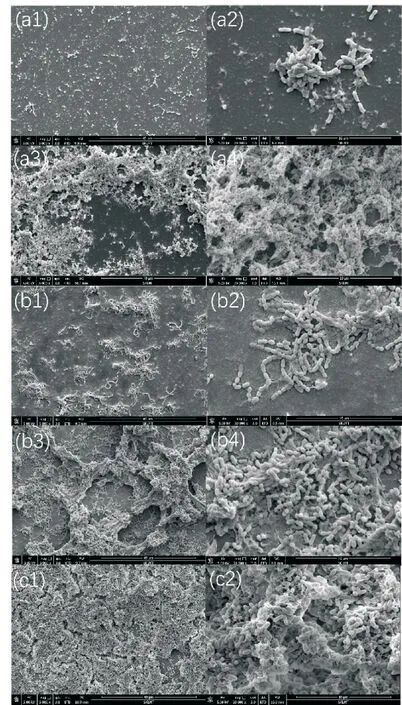
图6 扫描电镜观察结果
黄腐酚抑制生物被膜形成所需的浓度要远大于抑制浮游细菌生长所需的浓度,这主要归因于生物被膜基质的有限扩散或者排斥性致使大多数抗菌药物渗透效果较差,从而减少了生物被膜内部细胞与抗菌药物的直接接触[14].有趣的是,异黄腐酚在生物被膜实验中所用的浓度对浮游细菌的生长几乎没有影响,这意味着异黄腐酚对变形链球菌生物被膜的影响并不是由于其对浮游细菌生长的抑制作用.结合二者的化学结构,推测黄酮母核结构(2-苯基色原酮)的开环以及C2-3位双键的氢化可能是造成二者活性差异主要的原因.未来尚需开展更加深入的研究,揭示这两种化合物发挥作用的关键靶点,并进一步阐明其作用机理,为抗龋天然药物的研发提供新的思路.
3 结论
黄腐酚与异黄腐酚是从植物中发现的天然化合物,在亚MIC浓度时对变形链球菌的多种致龋毒力因子具有抑制作用.本研究为这两种化合物作为可抑制致龋细菌生理活性的新型天然产物奠定了基础.但是,目前尚未研究其在口腔中的毒性,这在临床应用之前是非常有必要的.此外龋齿的形成并不是单由某一种特殊细菌引起的,牙菌斑生物被膜内的不同细菌之间通常存在复杂的相互作用[17].未来需要使用多菌种生物被膜模型尽可能的拟合真实口腔内微生物群落之间的生态关系,同时进一步的研究将有助于了解这两种化合物治疗和预防龋齿的具体分子机制.
