MiR-421靶向调控KDM5A基因对卵巢癌细胞增殖和侵袭能力的影响
2021-10-22李彩瑜马源蔚杨思远
任 芳,韩 品,李彩瑜,马源蔚,杨思远,温 静,孙 怡
郑州大学第一附属医院妇科 郑州 450052
卵巢癌是女性癌症相关死亡的第五大恶性肿瘤。据美国癌症协会最新统计数据,预计2021年美国卵巢癌新确诊21 410例,死亡13 770例[1-2]。由于发病隐匿、筛查手段有限,80%卵巢癌患者在确诊时已处于进展期,伴随腹胀、食欲不振、盆腹腔大量积液等转移症状[1]。除了肿瘤细胞减灭术辅以紫杉醇联合铂类化疗药物的传统综合治疗方案,近几年分子靶向治疗如抗血管生成药物[3]、PARP抑制剂[4-5]也在临床上崭露头角,但仍有3/4的卵巢癌患者最终面临着复发和耐药的风险[6],因此临床上迫切需要为卵巢癌的诊疗开发新的靶点。
微小RNA(miRNA)是非编码RNA家族的重要组成部分,通过介导靶基因转录后沉默来调节基因表达[7]。目前已证实,miRNA通过影响肿瘤微环境、细胞信号通路等参与了肿瘤的发生与发展[8-9]。有研究[10]认为,胰腺癌组织中miR-142-5p表达下调,可通过抑制PI3K/AKT信号通路,从而抑制胰腺癌细胞的恶性生物学行为。miR-421可调控靶基因MTA1的表达,抑制大肠癌细胞的增殖、侵袭、迁移和上皮间质转化,从而有效抑制大肠癌进展[11]。组蛋白赖氨酸去甲基化酶(histone lysine demethylase,KDM)可参与表观修饰,脱去组蛋白N末端赖氨酸残基上的甲基进而参与细胞多项生命活动。其中KDM5A,也称为视网膜母细胞瘤结合蛋白-2,可通过促进血管生成、协同肿瘤细胞增殖、激活信号通路、产生耐药性等途径在肺癌、胃癌、乳腺癌等多种恶性肿瘤的形成和进展中发挥作用[12-15]。
目前关于miRNA是否参与卵巢癌发生及其分子机制的探讨尚不充分。本研究通过观察miR-421过表达对卵巢癌细胞增殖及侵袭能力的影响,探讨miR-421作为治疗卵巢癌候选靶点的可能性。
1 材料与方法
1.1 临床标本选取郑州大学第一附属医院2010年3月至2014年12月因卵巢恶性肿瘤行手术治疗并经病理学确诊的卵巢癌组织标本和因子宫良性疾病要求行子宫双附件切除的正常卵巢组织标本各51例。样本切除后立即置于-80 ℃液氮中保存。排除术前接受其他治疗者。该研究经医学伦理委员会审核通过(伦理号2020-KY-359),患者及家属知情同意。
1.2 主要药品与试剂OVCAR-8、SKOV3、293T细胞购自美国ATCC公司,Trizol试剂购自美国Invitrogen 公司,miRNA反转录试剂盒、SYBR Green荧光定量PCR试剂盒购自日本TaKaRa公司,转染试剂脂质体Lipofectamine 3000购自美国Thermo公司,miR-421 mimic购自上海吉玛基因有限公司,pMIR-REPORT载体购自美国Ambion公司,双荧光素酶报告基因检测试剂盒购自美国Promega公司,DMEM培养基、特级胎牛血清购自美国Gibco公司,DMSO购自美国Sigma-Aldrich公司。
1.3 卵巢组织中miR-421和KDM5A mRNA表达检测从临床收集的标本中剪取绿豆大小卵巢组织,参照说明书加入Trizol试剂提取细胞RNA并测定纯度,反转录得到cDNA,以其为模板并参照SYBR Green荧光定量PCR试剂盒说明书进行扩增。KDM5A引物序列:上游5’-CCGTCTTTGAGC CGAGTTG-3’,下游5’-GGACTCTTGGAGTGAAACGAAA-3’;miR-421引物序列:上游5’-CTCACTCA CATCAACAGACATTAATT-3’,下游5’-TATGGTT GTTCTGCTCTCTGTGTC-3’;β-actin引物序列:上游5’-CATGTACGTTGCTATCCAGGC-3’,下游5’-CTC CTTAATGTCACGCACGAT-3’。反应体系20 μL:cDNA模板 2.0 μL,10 μmol/L上、下游引物各 0.4 μL,2×SYBR Premix Ex Taq 10.0 μL,5×ROX Reference Dye Ⅱ 0.4 μL,Nuclease-free H2O 6.8 μL。β-actin为内参。采用2-ΔΔCt法计算目的基因相对表达量。
1.4 细胞实验
1.4.1双荧光素酶报告实验验证miR-421与KDM5A的靶向关系 TargetScan在线数据库预测miR-421同KDM5A 3’端非翻译区(Untranslated Regions,UTR)存在可结合序列。将设计合成的KDM5A野生型(KDM5A-wt)和突变型(KDM5A-mut)3’UTR双荧光素酶报告质粒分别连接到pMIR-REPORT载体上,构建pMIR-KDM5A-3’UTR和pMIR-KDM5A-MUT-3’UTR。取生长状态良好的293T细胞接种到24孔板中,分为miR-421组和miR-NC组。接种24 h后采用Lipofectamine 3000将pMIR-KDM5A-3’UTR分别与miR-421和miR-NC共转染至293T细胞,同法将pMIR-KDM5A-MUT-3’UTR分别与miR-421和miR-NC共转染。细胞培养箱培养48 h后收集各组细胞,参照双荧光素酶报告实验检测试剂盒检测各组细胞荧光素酶活性。实验重复3次。
1.4.2过表达miR-421对细胞KDM5A mRNA表达的影响 取处于对数生长期、生长状态良好的SKOV3、OVCAR-8细胞接种至12孔板中,分为空白对照组、转染无关序列的阴性对照组和转染miR-421 mimic的miR-421过表达组,每孔设3个复孔。采用Lipofectamine 3000进行转染。空白对照组未处理,阴性对照组转染无关序列,miR-421过表达组转染40 mmol/L的miR-421 mimic。采用qRT-PCR测定细胞中KDM5A mRNA水平。提取细胞RNA并测定含量,反转录获取cDNA后进行qRT-PCR。反应体系:模板 1 μL,上、下游引物各0.5 μL,dNTP mix 12.5 μL,dH2O 10.5 μL。扩增条件:预变性95 ℃,1 min,变性95 ℃,5 s,退火60 ℃,10 s,延伸72 ℃,15 s,共40个循环。以 β-actin为内参。采用2-ΔΔCt法计算目的基因相对表达量。
1.4.3细胞增殖能力的检测 应用MTT法检测。以细胞密度2×105个/mL接种至96孔板,每孔150 μL。分组处理同1.4.2。每组设3个复孔。细胞转染48 h后,对细胞增殖情况进行检测。按照20 μL/孔的体积向各组细胞加入MTT溶液(5 g/L),继续培养4 h后弃去上清液,按照150 μL/孔的体积加入二甲基亚砜。将96孔板至于摇床上低速振荡20 min后,使用酶标仪测定各组细胞在492 nm处的吸光度(A)值,用以表示细胞的增殖能力。实验重复3次。
1.4.4细胞侵袭能力的检测 采用Transwell小室法。取处于对数生长期、生长状态良好的OVCAR-8和SKOV3细胞接种至12孔板,NC组转染无关序列,miR-421过表达组转染40 nmol/L miR-421 mimic,每组设3个复孔。将Matrigel胶按20 μL/孔加入Transwell小室。下室加入500 μL完全培养基(含体积分数20%胎牛血清),调整生长细胞密度至5×105个/mL,取200 μL于上室接种后密封培养12~24 h。经固定、染色、流水浸洗后擦去Matrigel胶和细胞,风干后倒置于显微镜下观察并计数侵袭细胞数并取平均值。实验重复3次。
1.5 统计学处理利用GraphPad Prism 5处理实验数据。卵巢癌和正常卵巢组织中miR-421和KDM5A mRNA相对表达量的比较采用两独立样本t检验;各组KDM5A mRNA表达和A值的比较采用单因素方差分析和Turkey检验;NC组、miR-421过表达组侵袭能力的比较采用两独立样本t检验。检验水准α=0.05。
2 结果
2.1 两种卵巢组织中miR-421和KDM5A mRNA的表达结果见表1。

表1 正常卵巢与卵巢癌组织中miR-421和KDM5A mRNA表达水平的比较
2.2 miR-421和KDM5A的靶向调控关系miR-421和KDM5A-wt共转染的293T细胞荧光素酶活性降低(表2),初步验证了miR-421和KDM5A mRNA的靶向调控关系。
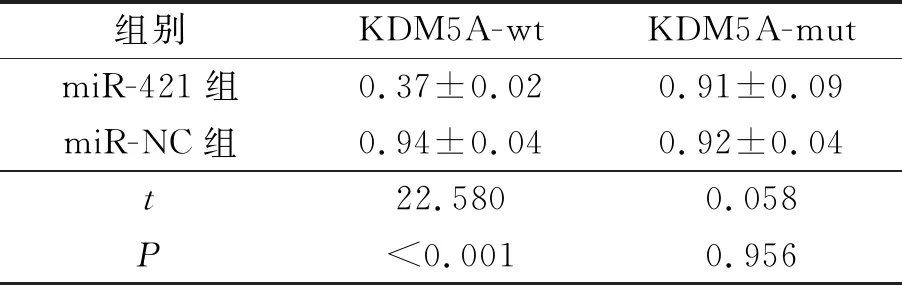
表2 双荧光素酶报告基因结果(n=3)
2.3 各组卵巢癌细胞中KDM5A mRNA表达量比较见表3。
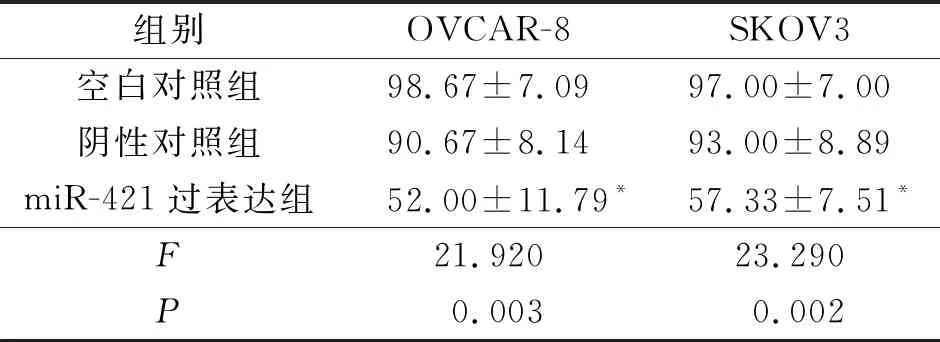
表3 各组卵巢癌细胞中KDM5A mRNA表达量比较(n=3)
2.4 各组卵巢癌细胞增殖及侵袭能力比较结果见表4、5。
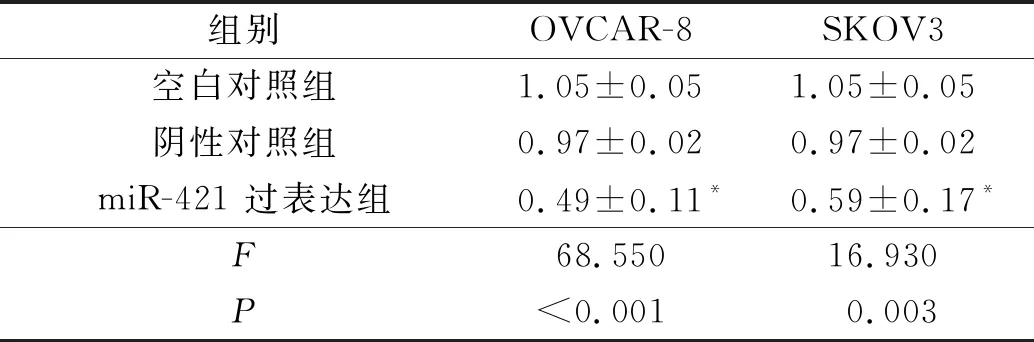
表4 各组卵巢癌细胞A值(n=3)
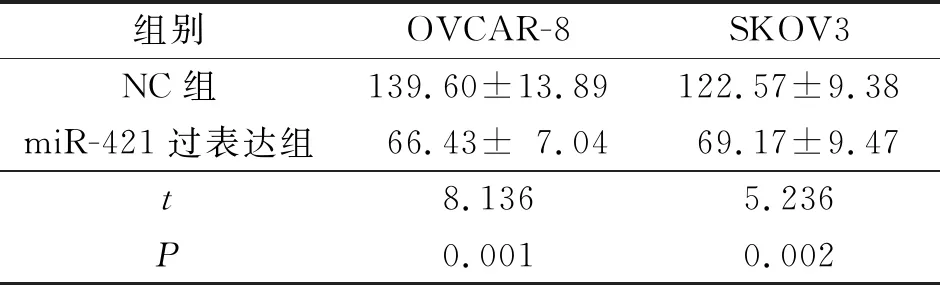
表5 各组卵巢癌侵袭细胞数比较(n=3) 个
3 讨论
miRNA是一类长度为19~25个核苷酸、高度保守的单链非编码RNA,可通过与下游目标基因的转录产物互补结合调控其表达,从而参与生命活动。随着近几年生物信息学的发展,miRNA在解释发病机制尤其是恶性肿瘤的诊疗方面显示出巨大了潜能。最新一项研究[16]指出,齐墩果酸衍生物K73-03可使胰腺癌中miR-421表达上调,而miR-421又可靶向结合SPINK1抑制其表达,诱导线粒体损伤从而引起胰腺癌细胞自噬和凋亡,为胰腺癌治疗提供了新思路;而由EZH2介导的miR-421表观沉默则通过激活上皮间质转化和干细胞特性驱动了SPINK1阳性的前列腺癌[17]。此外,miR-421在高级别胶质瘤细胞中的表达水平也显著降低,通过体外实验和动物模型证明,miR-421可靶向调控MEF2D表达而抑制胶质瘤的细胞活性、血管生成及放射敏感性[18]。
表观遗传学是指遗传物质的碱基序列不变,基因表达发生可遗传改变,是机体代谢、免疫应答、细胞分化与衰老、肿瘤发生发展及凋亡的重要机制[19-23]。其中组蛋白修饰是表观遗传的重要组成部分。表观遗传机制以及致癌基因和抑癌基因的表达失衡有可能成为卵巢癌诊疗的新靶点。Oser等[24]人设计小鼠实验证实,KDM5A通过靶向抑制NOTCH2和NOTCH基因,促进神经内分泌转录因子ASCL1的表达进而促进了小细胞肺癌的神经内分泌表型并协同癌细胞增殖;Cui等[12]发现KDM5A可靶向结合线粒体丙酮酸载体-1启动子并抑制其表达,通过调控线粒体丙酮酸代谢最终导致胰腺导管腺癌细胞的生长、侵袭和迁移。
本研究结果表明,卵巢癌组织中KDM5A转录水平显著升高,而miR-421表达水平明显下降。我们利用生物信息学工具预测miR-421与KDM5A可能存在的结合位点,并利用双荧光素酶报告基因实验证实了miR-421与KDM5A之间确实存在靶向结合位点。本研究结果亦表明,过表达miR-421组的KDM5A表达减少,细胞增殖及侵袭能力受到明显抑制,提示miR-421对卵巢癌细胞肿瘤活性的抑制可能是通过靶向抑制KDM5A实现的。
综上所述,miR-421在卵巢癌组织中表达水平下降,可能具有抑癌特性; miR-421-KDM5A轴有望为卵巢恶性肿瘤诊断与治疗提供新的思路。
