浆液性卵巢癌进展及预后关键分子的生物信息学筛选
2021-10-22饶玉梅张微微李留霞郭瑞霞
饶玉梅,张微微,张 颖,赵 倩,李留霞,郭瑞霞
郑州大学第一附属医院妇科 郑州 450052
卵巢癌病死率位居女性生殖系统恶性肿瘤之首[1]。 卵巢癌确诊时往往期别较晚,预后差,5 a生存率约为47%[2]。因此,研究卵巢癌的发病机制,能为该疾病的诊治提供理论和实践依据,具有重要意义。本研究从GEO数据库中,获取浆液性卵巢癌与正常卵巢组织基因芯片数据,经过分析获得二者间差异表达基因(differentially expressed gene,DEG),通过对DEG进一步分析,得到与卵巢癌患者生存期相关的关键基因,有助于我们更好地探索卵巢癌发病机制。
1 资料与方法
1.1 数据提取从GEO数据库(http://www.ncbi.nlm.nih.gov/geo)中筛选下载数据集GSE54388、GSE105437,数据集分析平台均为GPL(gene platform)570。GSE54388包含16例浆液性卵巢癌和6例正常卵巢组织,GSE105437包含10例高级别浆液性卵巢癌和 5例正常卵巢组织。
1.2 DEG筛选利用GEO分析工具GEO2R(http://www.ncbi.nlm.nih.gov/geo/geo2r)分别筛选出两个数据集中两组之间的DEG。筛选标准为校正后P<0.05,|lgFC|>1。下载所得原始DEG数据,去除没有对应基因符号的探针组或同一基因对应多个探针等情况。然后应用Venn软件(http://bioinformatics.psb.ugent.be/webtools/Venn/)分析并作图,得出交集。
1.3 GO和KEGG富集分析用DAVID 6.8数据库(http://david.ncifcrf.gov/)对筛选出的DEG进行功能富集,主要包括GO和KEGG富集分析。设P<0.05为富集差异有统计学意义。
1.4 蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络及模块分析用String 11.0数据库(http://string-db.org)构建DEG的PPI网络。利用String检索DEG中的交互基因。然后用Cytoscape 3.7.1软件中的MCODE 1.5.1对筛选基因进行重塑,构建调控网络模块[3]。
1.5 关键基因筛选分析应用Kaplan Meier plotter(http://kmplot.com/analysis)网站分析关键基因,进一步筛选出在卵巢癌组织中表达与总生存率有关的关键基因(P<0.05)。再利用GEPIA 数据库(http://gepia.cancer-pku.cn)分析所获得的关键基因,再一次筛选出表达异常的基因(P<0.05)。
2 结果
2.1 DEG的筛选从GSE105437、GSE54388两个数据集分别得到1 959个(上调1 399个、下调560个)、3 147个(上调1 881个、下调1 266个)DEG。Venn软件对二者取交集获得322个DEG,包括174个上调和 148个下调基因(图1)。
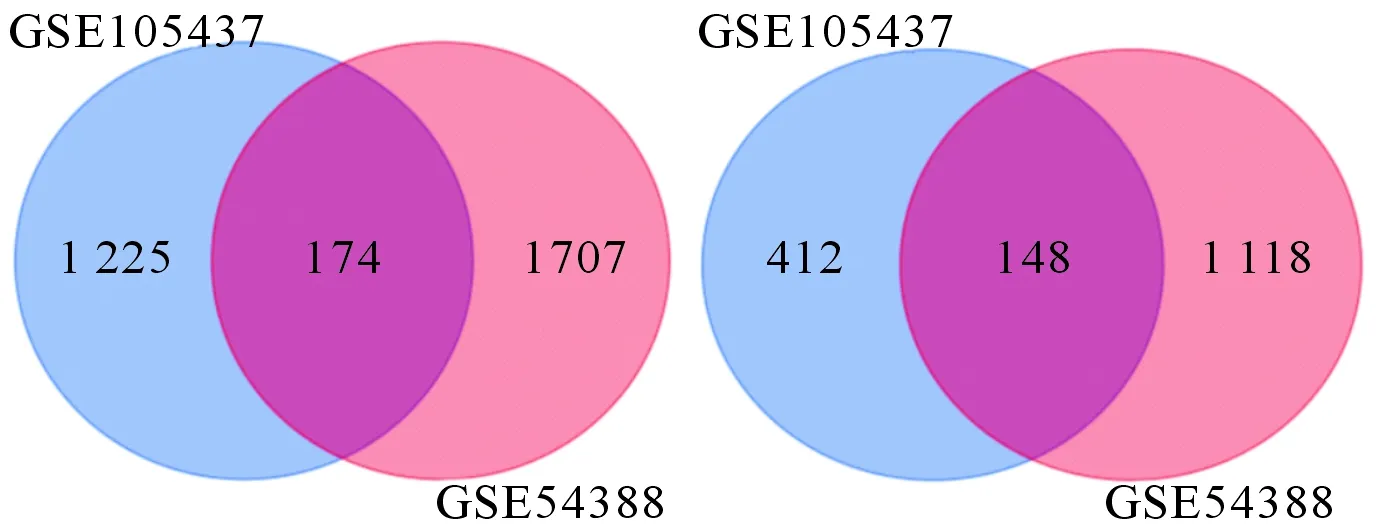
左:上调基因;右:下调基因
2.2 GO和KEGG富集分析结果对322个DEG进行GO和KEGG富集分析。GO分析结果见表1,表内基因数为对应GO的DEG数目,结果分为生物学过程、细胞组分和分子功能3个方面。DEG的生物学过程:上调基因主要集中在染色体分离、血管平滑肌发育、上皮细胞分化等方面(仅列出前3位);下调基因主要集中在平滑肌细胞增殖负调节、蛋白分泌正调节、RNA聚合酶Ⅱ启动子转录负调控等方面。细胞组分:上调基因主要集中在染色体、膜结合细胞器、膜封闭管腔等部位;下调基因主要集中在Z盘、膜的外部成分、高尔基管腔等部位。分子功能:上调基因涉及蛋白质结合;下调基因涉及氧化还原酶活性、核酸结合、肌动蛋白丝结合等方面。KEGG富集分析结果见表2:上调基因富集于细胞周期、癌症通路、ECM作用受体3条信号通路;下调基因富集于干细胞多能性的信号通路调节、酪氨酸代谢、癌症蛋白多糖等信号通路。
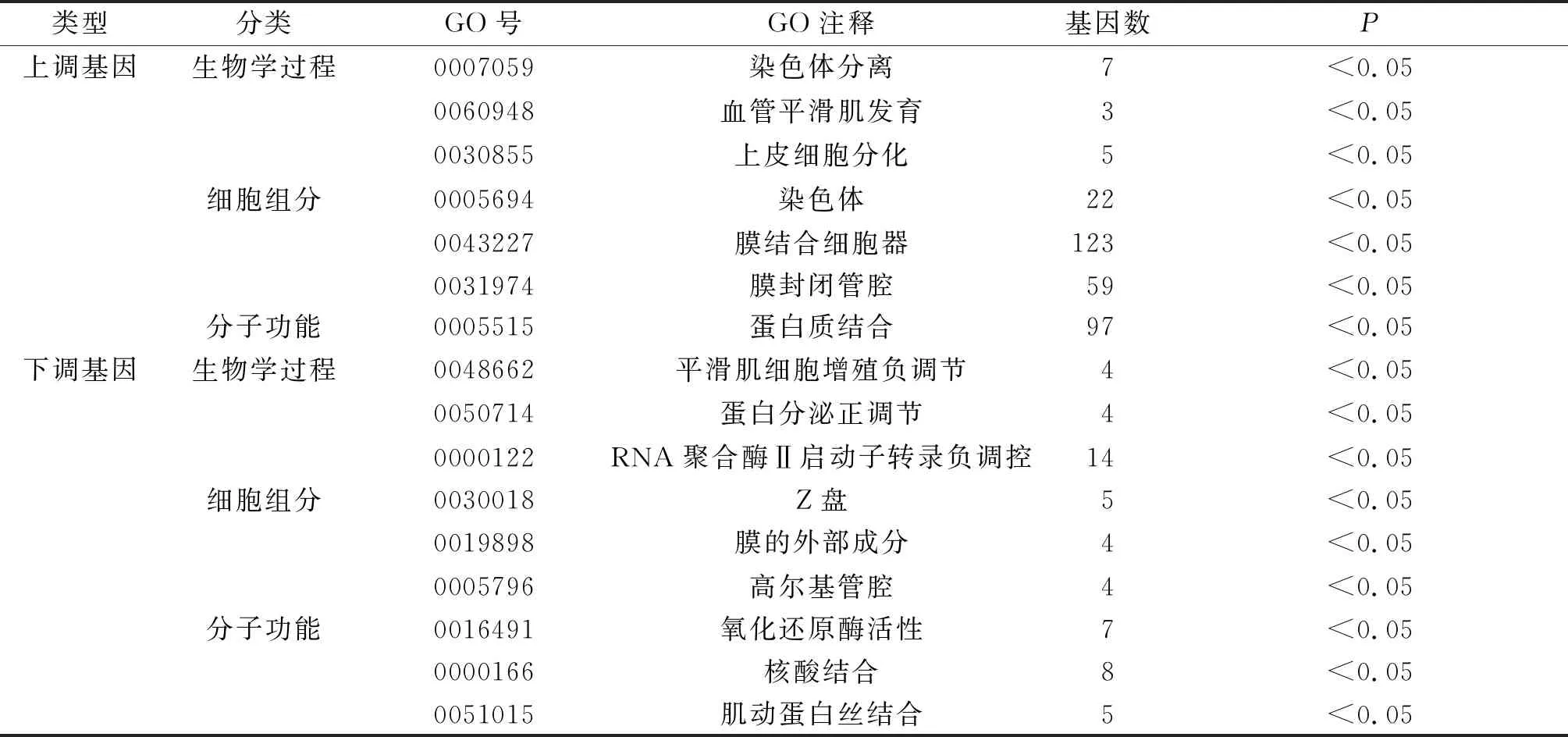
表1 卵巢癌DEG的GO分析结果

表2 卵巢癌DEG的KEGG富集分析结果
2.3 PPI网络构建及关键基因选择的结果对322个DEG分析后制作的PPI网络图见图2。对筛选的关键基因进行网络模块构建,得到MCM10、 MCM4、GINS2、BRCA1、FANCD2、TOP2A、KIF4A、MKI67、ESPL1、CDCA3、NEK2、KPNA2、ASF1B、ESCO2 14个关键基因,均为上调基因(图3)。
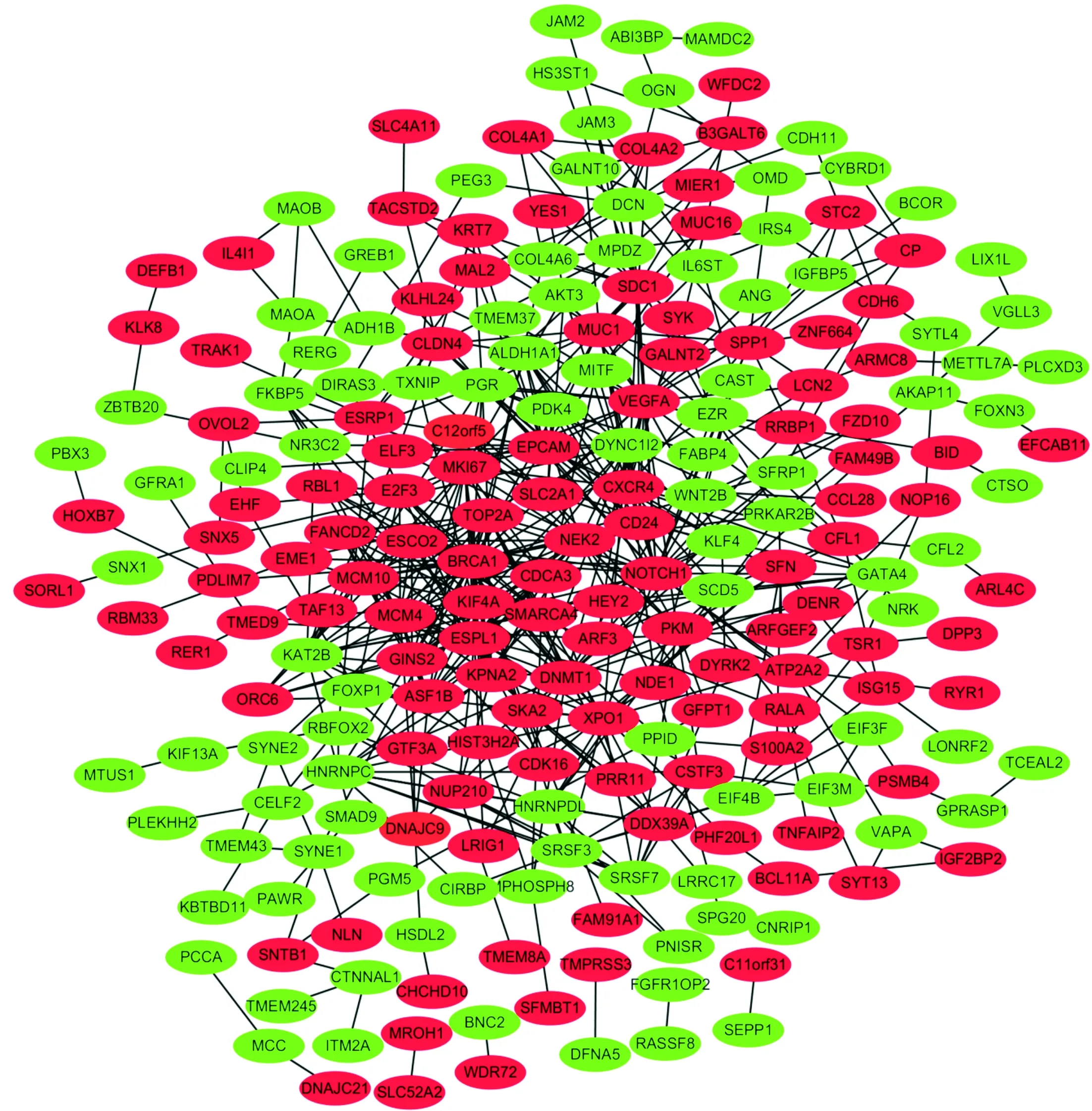
红色:上调基因;绿色:下调基因
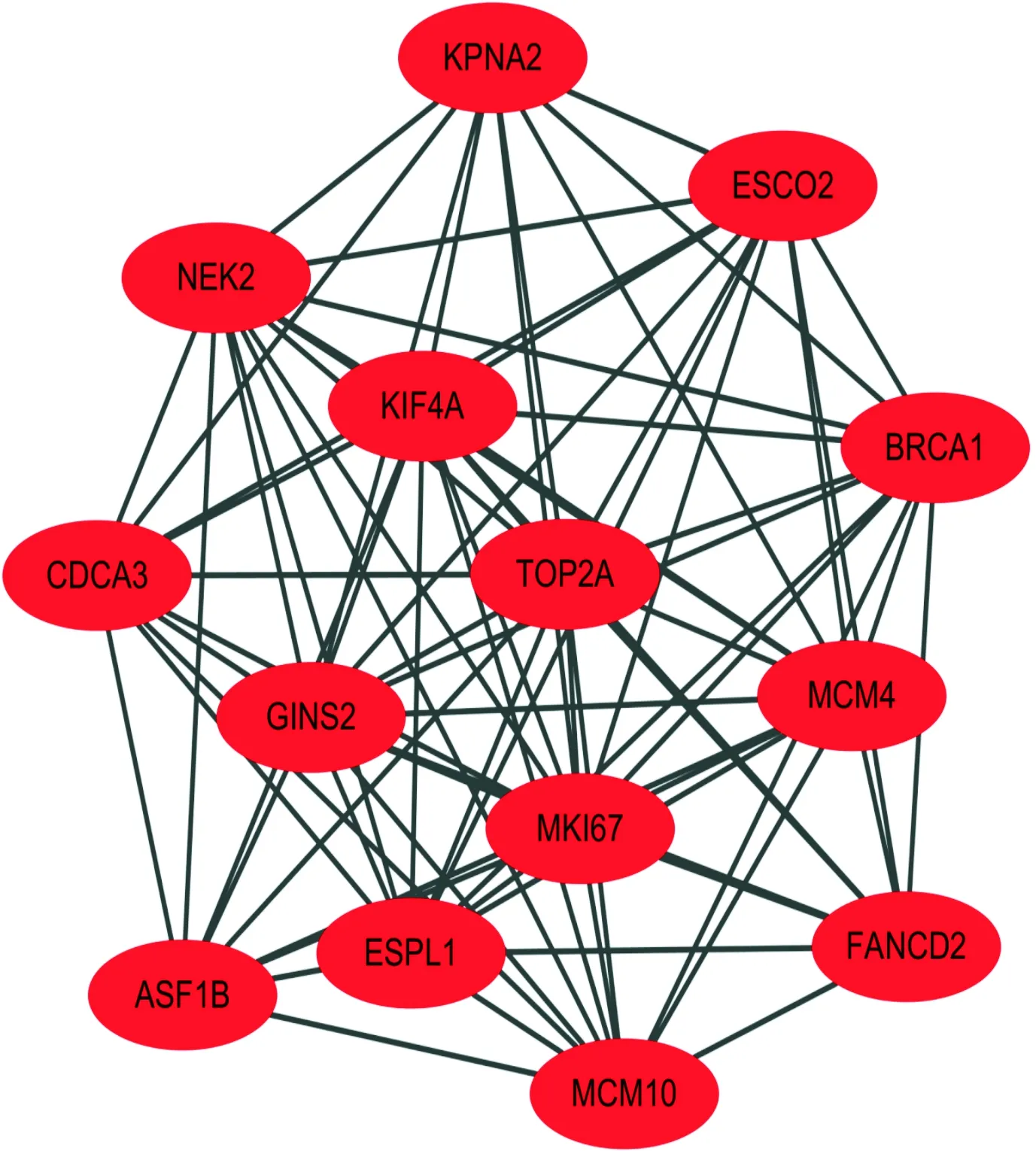
图3 关键基因的模块图
2.4 关键基因分析结果用Kaplan Meier plotter网站分析14个关键基因表达与卵巢癌患者总生存率之间关系,其中MCM10、FANCD2、TOP2A、ESPL1、CDCA3、NEK2、ESCO2等7个基因高表达及BRCA1低表达与患者总生存率不良有关(图4)。用GEPIA数据库分析这8个关键基因在卵巢癌和正常卵巢组织中表达情况,结果显示卵巢癌组织中MCM10、TOP2A、ESPL1、CDCA3、NEK2、ESCO2等6个基因的表达水平高于正常卵巢组织中的表达水平(图5)。
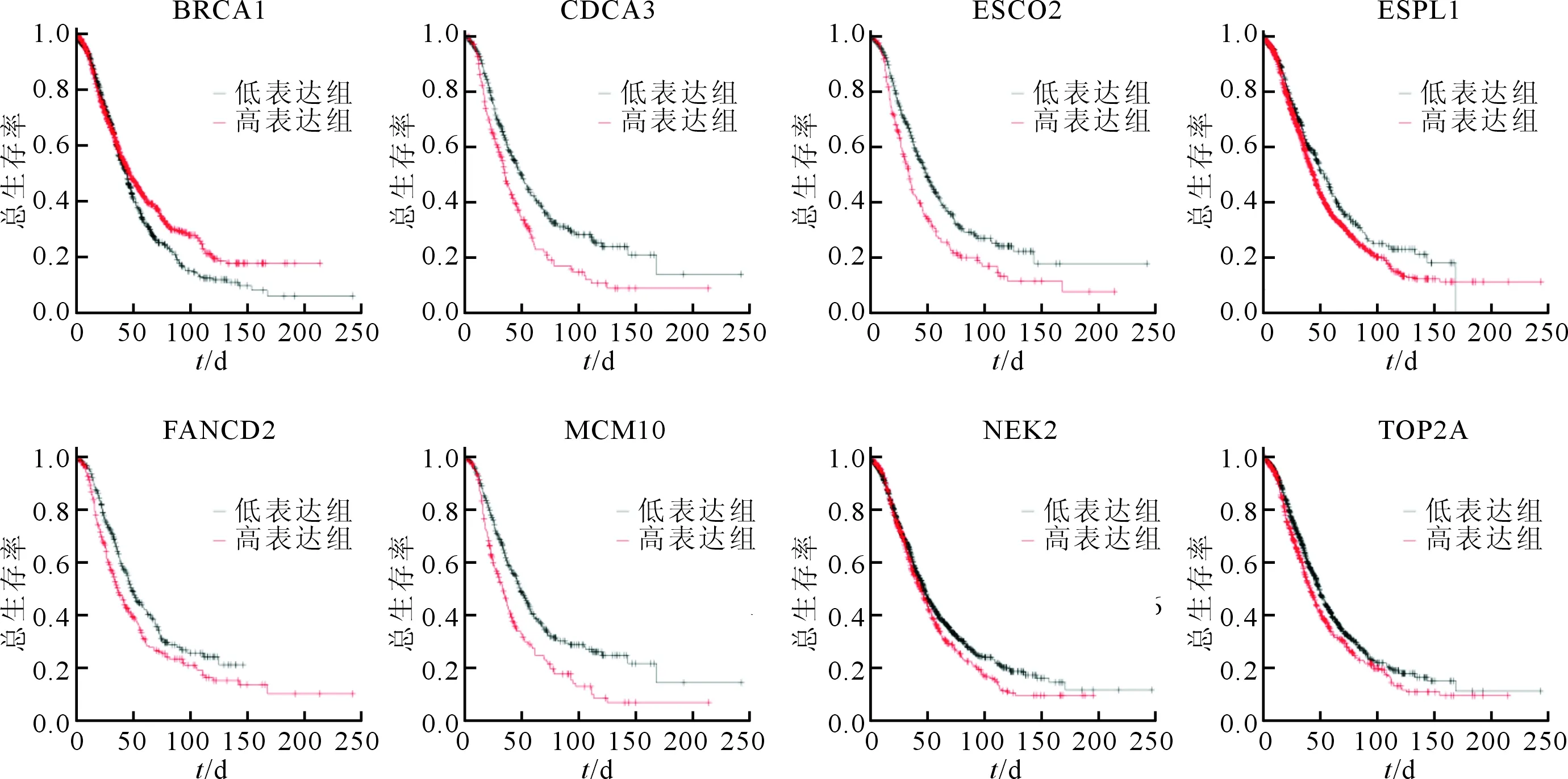
图4 卵巢癌组织中8个关键基因表达水平与患者总生存曲线关系
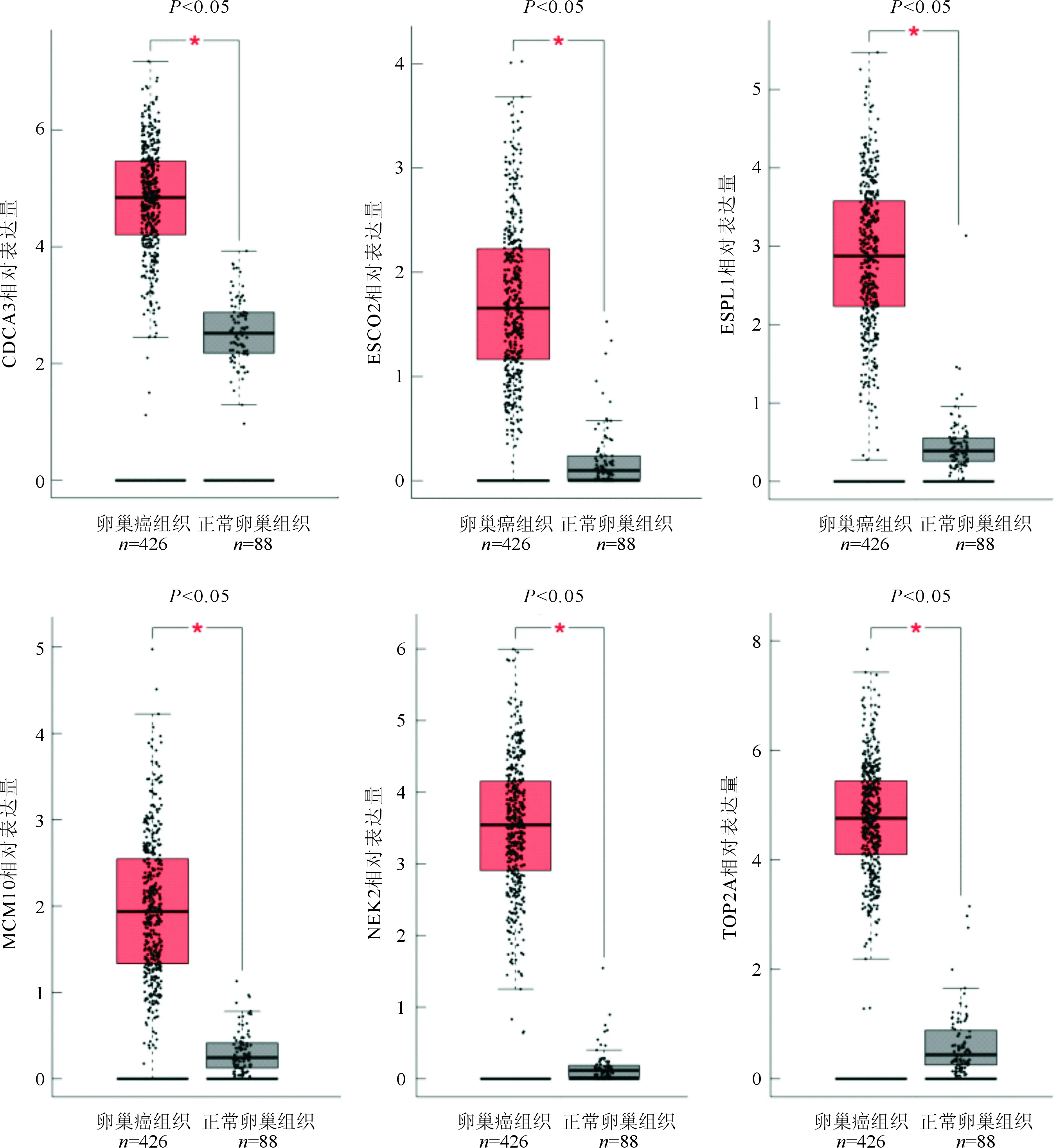
图5 6个关键基因在卵巢癌与正常卵巢组织中的表达情况
3 讨论
我国每年死于卵巢癌的女性约为2.5万,而且呈上升趋势[4]。浆液性卵巢癌早期诊断困难,患者就诊时往往已发生盆腹腔广泛转移[5]。因此,寻找能早期诊断、预后预测、靶向治疗的分子靶标,成为目前分子肿瘤学研究重点之一。为此,本研究提取GSE105437、GSE54388两个数据集中卵巢癌和正常卵巢组织资料,运用生物信息学分析方法,最终获取了MCM10、TOP2A、ESPL1、CDCA3、NEK2、ESCO2等6个关键基因。
MCM10高表达与前列腺癌[6]、乳腺癌[7]等肿瘤预后不良或恶性行为有关。MCM10在染色体复制的S期使DNA松解,其核心序列含有进化保守的结构域,由寡核苷酸-糖和相邻的锌指结构组成。其异常表达致肿瘤患者预后不良机制未明。ESCO2对细胞染色体凝聚及基因组稳定性有重要作用,其在肾细胞癌[8]、乳腺癌[9]组织或细胞中高表达。ESCO2表达失调能够抑制基质金属蛋白酶2表达,从而影响结肠癌的转移[10]。在胃癌细胞中抑制ESCO2的表达,能通过影响AMPK信号通路而抑制肿瘤细胞的增殖并诱导肿瘤细胞凋亡[11]。而CDCA3高表达与结肠癌预后不良有关,在结肠癌细胞SW480中降低CDCA3表达,能影响P21通路使肿瘤细胞阻滞在G1/S期,导致细胞增殖受抑[12]。同样在胃癌组织中CDCA3高表达也促进肿瘤恶性行为[13]。ESPL1编码一种分离酶,在细胞有丝分裂过程中切割染色体,其高表达不仅使乳腺癌细胞容易受到因染色体错聚,而致染色体非整倍体出现,而且还使细胞容易受到其他不稳定性遗传因素的影响,包括DNA损伤和关键抑癌基因位点的丢失。这些变化叠加起来,能导致肿瘤发生发展[14]。MCM10、ESPL1、CDCA3、ESCO2在多种恶性肿瘤发生发展中有重要作用,但其在卵巢癌中的研究鲜有报道。我们的研究显示这4种基因在卵巢癌组织中都是高表达,且高表达的患者生存期缩短。
有研究显示:NEK2在卵巢癌组织中高表达[15],且与卵巢癌的紫杉醇耐药有关[16]。抑制卵巢癌细胞中NEK2表达,能抑制肿瘤细胞的侵袭和增殖[17]。TOP2A在细胞有丝分裂中集聚于染色质,作用于着丝点,在DNA稳定性中发挥作用。它也是化疗药蒽环类和依托泊苷类药物的作用靶点之一[18]。研究[19]发现TOP2A在浆液性卵巢癌组织中表达上调,并通过TGF-β/Smad途径加速卵巢癌进展。复发性上皮性卵巢癌组织中TOP2A表达升高,患者对脂质体阿霉素的敏感性更高[20]。表明TOP2A在预测卵巢癌患者对脂质体阿霉素敏感性方面有良好的价值。
总之,虽然本研究发现了一些有意义的结果,但也有一些局限性。比如缺乏实验验证,以及这6个基因如何影响卵巢癌的发生发展,尚需进一步研究。
