ASA处理对苹果果实抗坏血酸
——谷胱甘肽循环和膜脂过氧化水平的影响
2021-10-21邓惠文王应强孟建刚
邓惠文,王应强,韩 雍,孟建刚
(1.陇东学院 农林科技学院,甘肃 庆阳 745000;2.天池乡农业服务中心,甘肃 环县 745700)
苹果是我国大宗类水果之一主要以鲜食为主[1-2]。富士苹果以其营养丰富,色泽鲜艳、香气怡人、肉质甜脆而深受消费者的喜爱[3-4]。霉心病、青霉病、灰霉病和炭疽病是苹果贮藏期的主要病害,粉红单端孢(Trichotheciumroseum)是引起霉心病造成果实烂损的主要的病害之一[5]。霉心病主要发生在果实贮藏期,包括干腐和湿腐,其发病症状表现为果肉呈现水渍状、褐色、味苦[6]。目前主要采用化学杀菌剂控制,但长期使用化学杀菌剂对人体健康、环境存在危害并且会产生病原物抗药性增加[7-8]等问题。
乙酰水杨酸(Acetyl Salicylic Acid,ASA)在植物体内转换为SA,作为小分子信号物质在诱导植物抗病性方面有着明显的效果[9-11]。研究显示:采前ASA喷洒处理通过促进苯丙烷代谢和抗氧化酶活性诱导活性氧代谢,能够有效诱导采后哈密瓜果实的抗病性[12]。此外,甜瓜抗病性研究中发现诱导抗病与果实膜脂过氧化及丙二醛的积累密切相关[13]。然而,关于ASA对苹果抗坏血酸-谷胱甘肽循环和膜脂过氧化水平的影响尚未见报道。本文以陇东地区“富士”苹果为材料,探究采后ASA处理对损伤接种T.roseum苹果果实果肉及果心病斑直径的影响,旨在探讨ASA处理对抗坏血酸-谷胱甘肽循环及果实膜脂过氧化的影响,以期为苹果霉心病的防治提供基础理论基础。
1 材料与方法
1.1 试验材料
本试验以“红富士”苹果为材料,采自甘肃省庆阳市西峰区温泉乡,于2018年9月底采摘无机械损伤和病虫害、大小均一的果实。
供试粉Troseum分离于自然发病的富士苹果,在马铃薯葡萄糖琼脂(potato dextrose agar,PDA)上保存待用。
本试验用的ASA分析纯,三氯乙酸(TCA)、2-硫代巴比妥酸(TBA)、亚油酸、NaOH、HCL、硼酸等均为国产分析纯。
1.2 仪器与设备
GY-Ⅰ型水果硬度计,杭州托普仪器有限公司;WYT-Ⅱ型阿贝折光仪,郑州南北仪器设备有限公司;UV-1800紫外可见分光光度计,北京瑞利分析仪器公司;Thermo8600超低温冰箱,杭州明凯科技有限公司;TGL-16低温离心机,湖南湘仪实验仪器开发有限公司。
1.3 试验方法
2mmol/L ASA浸泡处理,以自来水为对照(CK),在温度20±2℃、RH60±5%条件下贮藏10d。贮藏期间每隔2d取样一次测定相关指标。
1.4 测定指标与方法
果心病斑直径:参照Serdani M的方法[14]。无菌条件下,将表面消毒后的苹果纵切,每个苹果用牙签在心皮刺孔2次,接种1×105个/mLT.roseum孢子悬浮液10μL;无菌水为对照,保鲜膜密封后,在无光照25℃条件下培养,十字交叉法测定病斑直径。果肉病斑直径:参照葛永红的方法[15]。
丙二醛(MDA)含量:参照Hodges等的方法[16],3.0g果肉组织中加入5mL100g/L三氯乙酸(TCA)提取液研磨成匀浆,4℃12,000×g条件下离心20min。取2mL上清液,加入2mL0.67%的2-硫代巴比妥酸(TBA)溶液,混合后煮沸20min,对照空白管中加入2mL100g/L TCA溶液代替提取液。分别测定反应液在450nm、532nm和600nm处的吸光度值,MDA含量用(nmol/g FW)表示。
脂氧合酶(LOX)活性:参照刘欢等的方法[13]。
AsA和DHA含量的测定:分别参照Tanaka的方法[17]和Arakawa的方法[18],取果肉组织3.0g加5mL预冷的100mmol/L盐酸提取液冰浴研磨,然后在4℃、7800r/min条件下离心10min,上清液立即用于AsA和DHA的测定。AsA的测定:取100μL上清液加入2mL 100mmol/L磷酸钾缓冲液(pH6.0)再加入0.5mL蒸馏水在265nm下测定其吸光度值。总ASA的测定:取100μL上清液加入2mL 100mmol/L磷酸钾缓冲液(pH6.0)再加入0.5mL 2mmol/L DTT置于室温下(25℃)反应8min使DHA全部还原为AsA,之后在265nm下测定其吸光度值。则DHA含量=总AsA含量-AsA含量。结果以μg·gFw-1表示。
GSH和GSSG含量的测定:参照Griffith[19]的方法。取3g果肉组织,加入5mL冰冷的6%的偏磷酸(pH2.8),冰浴研磨,匀浆液于4℃、12500r/min离心20min,取上清液来立即测定GSH和GSSG的含量或储存在-20℃下等待测定。总的GSH和GSSG含量测定:500μL提取液加2.5mL反应液包含800μL反应液1(110mmol·L-1Na2HPO4·7H20,40mmol·L-1NaH2PO4·H2O,15mmol·L-1EDTA,0.3mmol·L-1DTNB,0.04%BSA)、800μL反应液2(1mmol·L-1EDTA,50mmol·L-1咪唑和0.02%BSA)、800μL反应液3(5%Na2HPO4,pH7.5的溶液稀释50倍)和100μL 9.0mmol·L-1NADPH。以6%的偏磷酸(pH2.8)代替提取液作为对照,蒸馏水作参比,在412nm下测其吸光值,则OD总GSH+GSSG=OD样品-OD对照。GSSG含量测定:500μL提取液加入2.5mL乙烯吡啶(稀释50倍)在25℃下水浴1h,以6%的偏磷酸(pH2.8)代替提取液作为对照,蒸馏水作参比,在412nm下测其吸光值,则ODGSSG=OD样品-OD对照。GSH的=总的GSH和GSSG含量-GSSG。
GR活性的测定:参照Foyer和Halliwell[20]的方法。APX和DHAR活性的测定:参照Nakano和Asada[21]的方法。MDHAR活性的测定:参照Hossain等[22]的方法。试验中各测定指标均重复测定3次。
1.5 数据分析
数据采用SPSS 17.0数据分析软件和EXCEL软件进行统计分析。
2 结果与分析
2.1 ASA处理对损伤接种T.roseum果肉和果心组织病斑直径的影响
由图1A可知,对照和ASA处理在贮藏6-15d病斑直径均呈现上升趋势。ASA处理的果实在整个贮藏期间病斑直径均显著(P<0.05)低于对照组果实。ASA处理可以抑制由T.roseum侵染引起霉心病在果肉组织病斑的扩展。
由图1B可知,对照和ASA处理果实的果心在贮藏4-7d病斑直径均呈现上升趋势。在整个贮藏期间,ASA处理果实的果心病斑直径显著(P<0.05)低于对照组果实果心。ASA处理可以降低由T.roseum侵染引起霉心病在果心病斑直径。
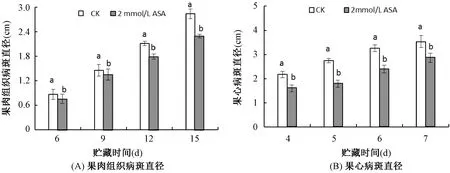
图1 ASA处理对损伤接种T.roseum果肉病斑直径(A)和果心组织病斑直径(B)的影响
2.2 ASA处理对果实丙二醛(MDA)含量的影响
由图2可知,对照组果实在贮藏0-8d MDA含量迅速上升。ASA处理的果实MDA含量上升较为缓慢。经过ASA处理的果实在整个贮藏期间MDA含量显著(P<0.05)低于对照组果实。ASA处理通过延缓丙二醛含量的上升,抑制膜脂过氧化程度。
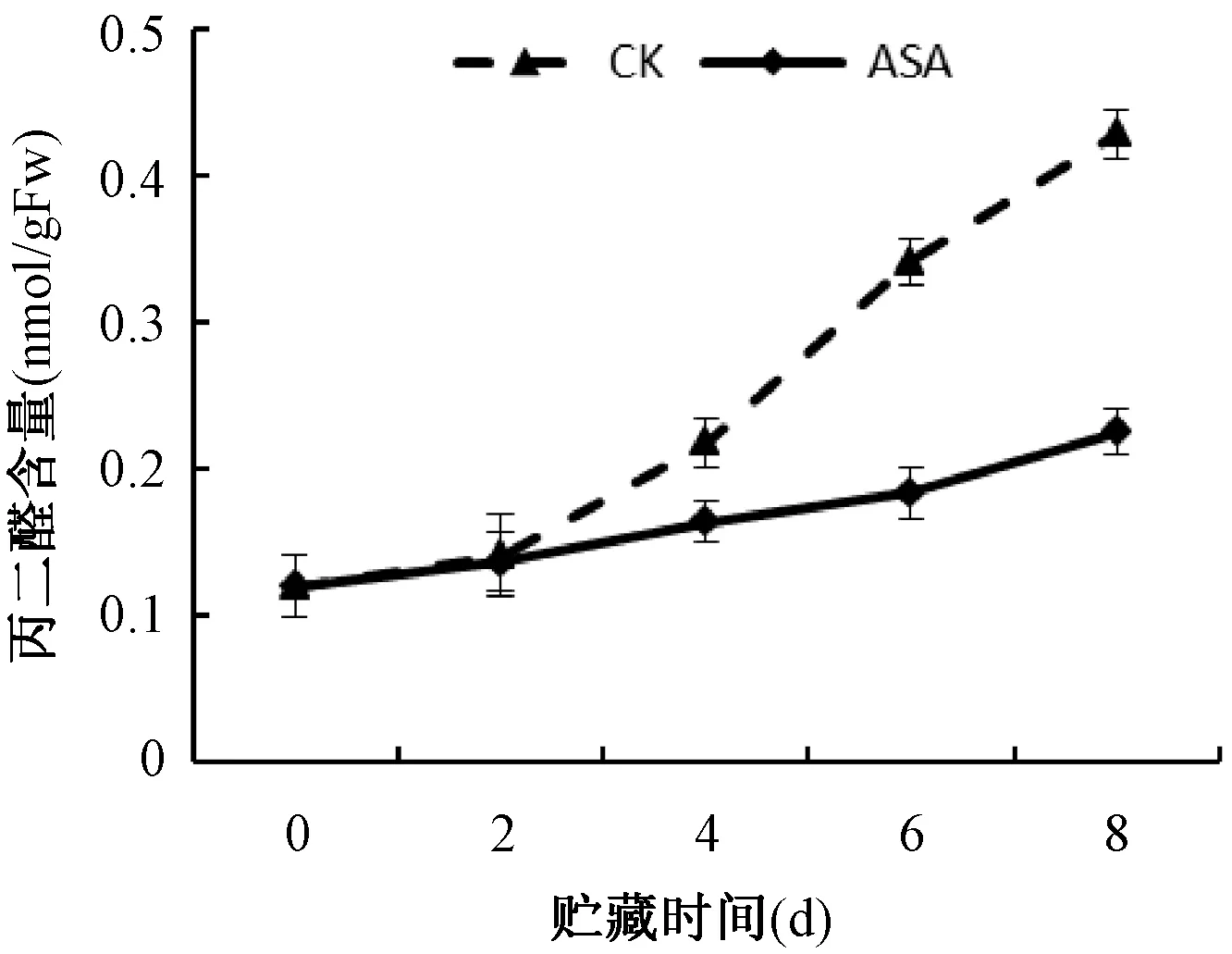
图2 ASA处理对苹果果实丙二醛(MDA)含量的影响
2.3 ASA处理对果实脂氧合酶(LOX)活性的影响
由图3可知,对照组果实在贮藏0-6d LOX活性快速上升,随后下降。ASA处理的果实0-6d LOX活性相对缓慢,6-8d下降。ASA处理的果实在同一贮藏时间LOX酶活显著(P<0.05)低于对照组果实。ASA处理通过降低苹果果实LOX活性,抑制膜脂过氧化。
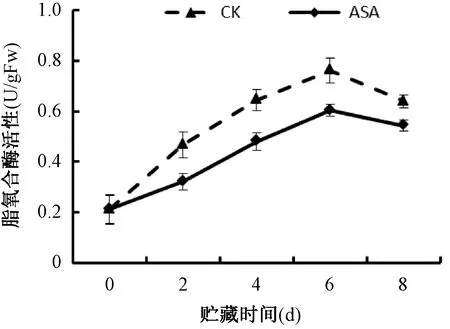
图3 ASA处理对脂氧合酶(LOX)活性的影响
2.4 ASA处理对果实非酶抗氧化物质含量的影响
由图4A可知,贮藏期间ASA处理组果实AsA含量均显著(P<0.05)高于对照组果实。AsA含量对照组果实在贮藏0-6d上升速度较快,6-8d呈现缓慢下降的趋势。ASA处理组果实0-2d上升迅速,随后2-6d缓慢上升,最后下降。由图4B可知,对照组和ASA处理组苹果果实贮藏期间DHA含量均呈现上升趋势,并且ASA处理组果实DHA含量均显著(P<0.05)低于对照组果实。由图4C可知,贮藏期间ASA处理组果实GSH含量均显著(P<0.05)高于对照组果实。对照组果实和处理组果实GSH含量在贮藏0-6d上升迅速,之后缓慢下降。由图4D可知,贮藏期间ASA处理组果实GSSG含量均显著(P<0.05)低于对照组果实。0-8d对照组果实和处理组果实GSSG含量均呈现下降趋势,但相对于对照组果实ASA处理下降较为缓慢。上述结果表明,ASA处理可有效地提高苹果果实AsA和GSH含量,降低果实中DHA和GSSG含量。AsA和GSH作为抗氧化物质能够直接清除果实中积累的活性氧,从而抵御外界伤害。
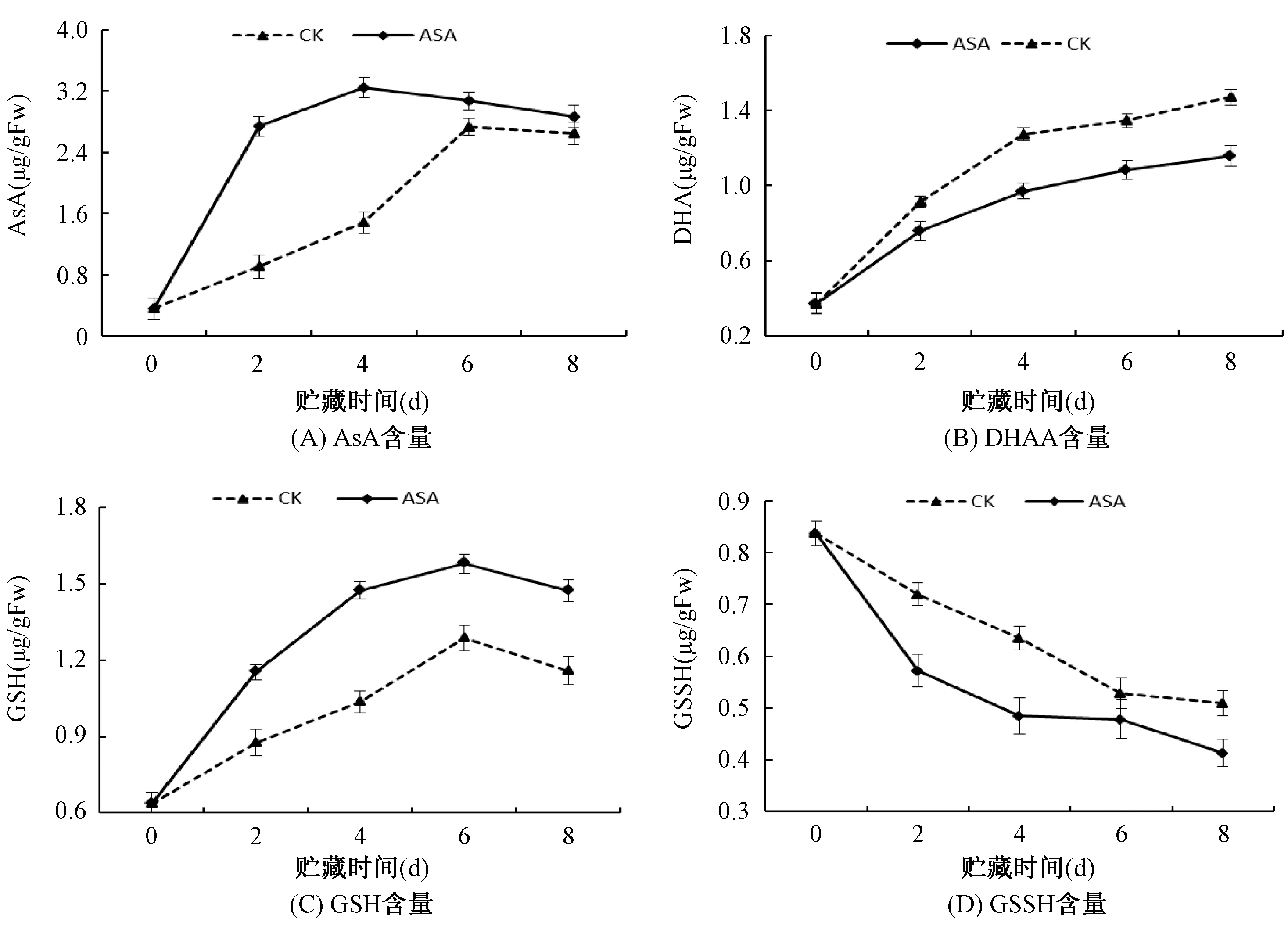
图4 ASA处理对苹果果实抗坏血酸含量(A)、脱氢抗坏血酸(B)、还原型谷胱甘肽(GSH)和氧化型谷胱甘肽(GSSG)含量的影响
2.5 ASA处理对果实抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性的影响
由图5A可知,在贮藏期间ASA处理组果实APX活性均显著(P<0.05)高于对照组果实。对照组果实和处理组果实APX酶活在贮藏0-6d呈上升趋势,随后下降;由图5B可知,贮藏期间ASA处理组果实GR活性均显著(P<0.05)高于对照组果实。对照组果实和处理组果实APX酶活在贮藏0-8d整体呈现较缓慢的上升趋势。ASA处理组果实0-2d上升速度较快,2-6d逐渐上升,之后下降。上述结果表明,ASA处理可提高苹果果实APX和GR活性。APX和GR作为AsA-GSH循环中重要抗氧化酶,通过提高APX和GR活性,提高果实的抗氧能力,使ASA-GSH循环维持平衡。
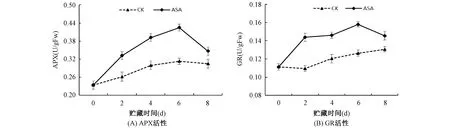
图5 ASA处理对苹果果实抗坏血酸过氧化物酶(APX)和谷胱甘肽还原酶(GR)活性的影响
2.6 ASA处理对果实脱氢抗坏血酸还原酶(DHAR)和单脱氢抗坏血酸还原酶(MDHAR)活性的影响
由图6A可知,贮藏期间ASA处理组果实DHAR活性均显著(P<0.05)高于对照组果实。对照组果实和处理组果实DHAR活性在贮藏0-6d呈上升趋势,6-8d逐渐下降。由图6B知,贮藏期间ASA处理组果实MDHAR活性均显著(P<0.05)高于对照组果实。对照组果实和MDHAR活性在贮藏0-4d逐渐上升,4-8d缓慢下降。ASA处理组果实0-2d迅速上升,随后下降。上述结果表明,ASA处理可使DHAR和MDHAR活性维持在一个较高的水平。DHAR和MDHAR是促进AsA-GSH循环有效运转的酶,使得活性氧能够及时被清除。
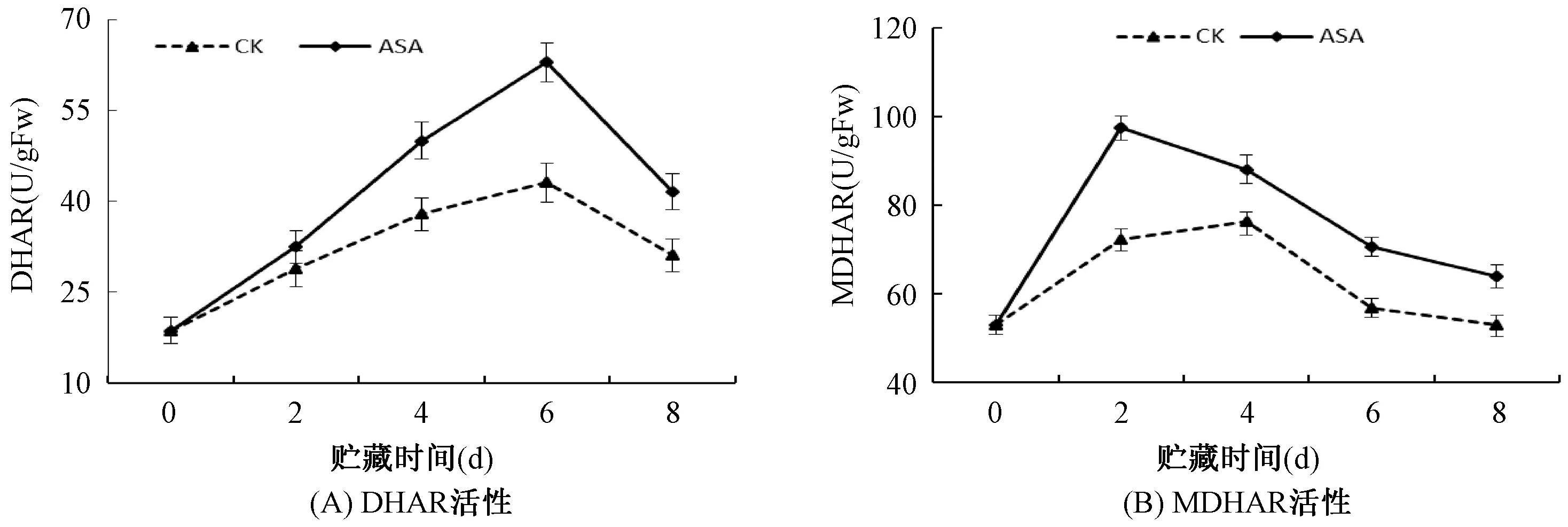
图6 ASA处理对苹果果实脱氢抗坏血酸还原酶(DHAR)和单脱氢抗坏血酸还原酶(MDHAR)活性的影响
3 讨论
先前试验显示[23]ASA能够诱导果实的抗病性,降低果实采后病斑直径,从而显著降低采后烂损。本研究显示ASA处理通过促进抗坏血酸-谷胱甘肽循环,抑制膜脂过氧化程度增加果实抗病性,从而有效抑制损伤接种T.Roseum苹果果实果肉及果心组织病斑直径的扩展。
马玄等[24]在杏子果实,以及前期试验结果[23]显示ASA采后诱导抗病性与活性氧代谢密切相关。外界生物或诱抗剂胁迫下,活性氧(Reactive oxygenspecies,ROS)瞬间大量积累使细胞膜损伤,植物体内存在一套完整的抗氧化体系能够迅速将ROS的水平降低到正常水平,其中抗坏血酸谷胱甘肽循环(AsA-GSH)是主要的清除系统。AsA-GSH循环主要由4种抗氧化酶和4种非酶抗氧化物质组成。试验结果表明,ASA处理能够提高抗坏血酸过氧化物酶(APX)、谷胱甘肽还原酶(GR)、脱氢抗坏血酸还原酶(DHAR)、单脱氢抗坏血酸还原酶(MDHAR)活性,增加抗坏血酸(AsA)、还原型谷胱甘肽(GSH)含量,而一定程度上降低脱氢抗坏血酸(DHA)和氧化性谷胱甘肽(GSSG)含量。由于ASA处理组果实较对照组果实能够维持较高的APX、GR、DHAR、MDHAR活性,从而促进AsA-GSH循环高效运转,增加果实活性氧的清除能力;AsA、GSH含量增加,DHA和GSSG含量将低,增大AsA/DHA和GSH/GSSG比值,从而使AsA-GSH循环中抗氧化物质维持在较高的还原态,能够有效猝灭瞬间氧爆产生的ROS。
ROS代谢和细胞膜质过氧化息息相关。果实体内ROS大量积累会导致膜脂过氧化,从而破坏细胞膜的结构的完整性和功能[25]。LOX是植物脂肪酸氧化途径中的关键酶,LOX不仅对质膜产生破坏,并且催化产生的过氧化物等还对有机体的活性物质造成损伤[26]。MDA积累是反映植物组织膜脂过氧化程度的重要指标[26,27]。试验结果显示,ASA处理果实能够抑制MDA含量升高,降低LOX酶活性,从而减缓果实膜脂过氧化程度,保持细胞膜结构完整性,增加耐贮性。
4 结论
ASA处理有效控制由T.Roseum引起的苹果霉心病;提高果实中AsA和GSH含量,降低DHA、GSSG的含量,增加APX、GR、DHAR和MDAR酶的活性,增强果实的ROS清除能力;降低果实MDA含量和LOX酶活性,减少过量ROS对细胞膜的造成的伤害。
