低载脂蛋白A1 水平与腹膜透析患者全因死亡及心血管事件死亡的相关性
2021-10-20许灵苍周芳芳李梦戴智威林海雪朱蓓霞罗群
许灵苍,周芳芳,李梦,戴智威,林海雪,朱蓓霞,罗群
腹膜透析(PD)是终末期肾病患者有效的肾脏替代治疗方法,具有价格低廉、操作简单、对血流动力学影响小,且能很好保护残肾功能等优点[1]。但PD患者的长期临床预后较差,且影响其预后的因素也较为复杂。心血管事件(CVD)是PD 患者死亡的重要因素[2]。血浆中的载脂蛋白A1 水平与高脂血症、动脉粥样硬化、心脑血管疾病的发生密切相关,且它能更好地预测心血管疾病的发生[3]。本文分析PD 患者的载脂蛋白A1 水平,研究其对PD 患者全因死亡和CVD 死亡的相关性,报道如下。
1 资料与方法
1.1 一般资料 选取2007 年3 月至2020 年5 月在中国科学院大学宁波华美医院肾内科留置腹膜透析管开始PD治疗的患者,均符合:年龄≥18岁,PD治疗时间≥3 个月且规律随访。排除外院留置腹膜透析管患者,既往有肾移植病史,既往接受血液透析时间≥3 个月,PD后3 个月内死亡或发生CVD者,有风湿性、器质性心脏者,有慢性肝病及严重肝功能异常者,合并妊娠或恶性肿瘤者,在研究前3 个月内接受输血治疗者,临床资料不全者。
1.2 数据收集 所有患者通过门诊、电话、微信等方式随访至死亡、转血液透析治疗、转肾移植、转至其他透析中心、失访或截至2020 年10 月31 日。收集患者透析3 个月后的临床基线数据,包括人口统计学资料[性别、年龄、吸烟史、饮酒史、收缩压、舒张压、心率、体质量指数(BMI)、高血压、糖尿病、心脏病及脑血管病等] 和实验室生化指标[载脂蛋白A1、血红蛋白、血清白蛋白、碱性磷酸酶、血肌酐、尿素氮、尿酸、血钙、血磷、C 反应蛋白、血清总胆红素、门冬氨酸氨基转移酶、丙氨酸氨基转移酶、甲状旁腺激素、高密度脂蛋白、低密度脂蛋白、三酰甘油、总胆固醇、24 h 尿量、肾小球滤过率(eGFR)]。记录患者临床转归和死亡原因等信息,死亡诊断判定以CVD因素为直接死因者归为CVD 死亡。
1.3 统计方法 采用SPSS 25.0 统计软件进行分析,符合正态分布的计量资料用均数±标准差表示,采用t 检验;不符合正态分布的计量资料用M(P25,P75)表示,采用Mann-Whitney U 检验;计数资料比较采用2检验;影响因素采用多因素Logistic 回归分析;生存预后比较采用Kaplan-Meier 生存分析;相关性采用多因素COX 回归分析。P <0.05 为差异有统计学意义。
2 结果
2.1 两组基线资料比较 共纳入患者392 例,根据载脂蛋白A1 水平的中位值将患者分为低载脂蛋白A1 水平组(<1.235g/L,n=196)和高载脂蛋白A1 水平组(≥1.235g/L,n=196)。与高载脂蛋白A1 水平组相比,低载脂蛋白A1 水平组高密度脂蛋白、总胆固醇、血红蛋白、血清白蛋白、门冬氨酸氨基转移酶、24 h尿量均较低,而男性比例和C 反应蛋白水平较高(均P <0.05)。见表1。
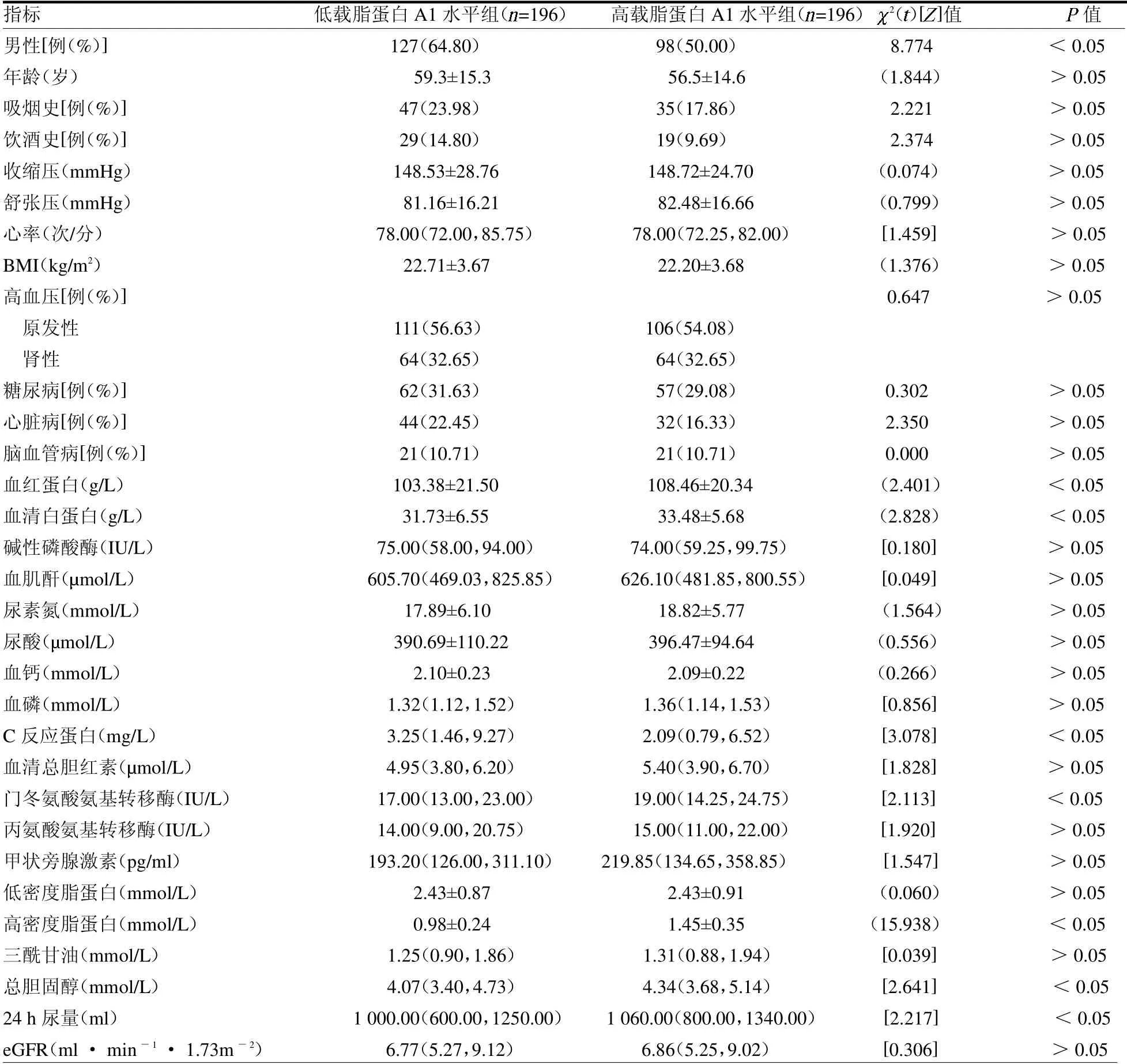
表1 两组基线资料比较
2.2 低载脂蛋白A1 水平相关因素的多因分析 高高密度脂蛋白水平、高甲状旁腺激素水平和高24 h 尿量水平是低载脂蛋白A1 水平发生的保护因素(均P<0.05)。见表2。
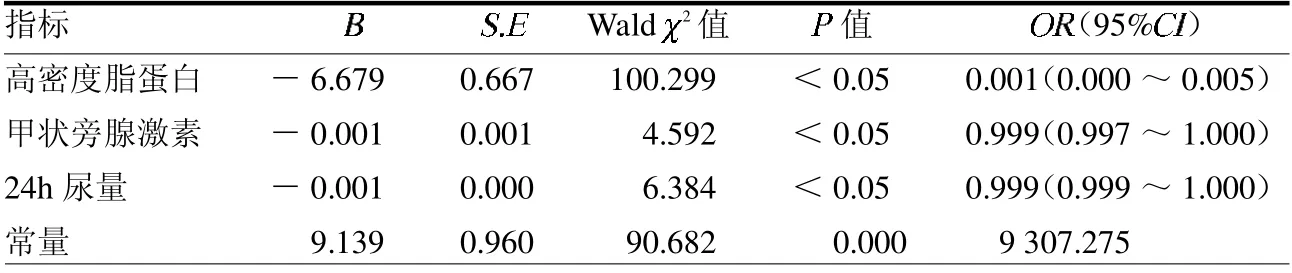
表2 低载脂蛋白A1 水平相关因素的多因素Logistic 回归分析结果
2.3 不同载脂蛋白A1 水平患者全因死亡及CVD 死亡的生存分析 死亡71例,接受肾移植12例,转血液透析41例,失访5 例,转至其他透析中心51 例,剩余212 例患者继续在本中心随访。在71例死亡患者中,因CVD 44 例,感染10例,消化道出血1 例,营养不良5 例,其他11 例。PD 开始后的第1、3、5 年累积全因死亡率在低载脂蛋白A1 水平组患者中分别为7.65%(15/196)、14.80%(29/196)、18.37%(36/196),在高载脂蛋白A1 水平组分别为3.06%(6/196)、7.65%(15/196)、9.69%(19/196)。在全因死亡方面,低载脂蛋白A1 水平组累积生存率较低(2=11.309,P<0.05),见封二彩图1。PD 开始后第1、3、5 年累积CVD 死亡率在低载脂蛋白A1 水平组患者中分别为4.59%(9/196)、7.65%(15/196)、10.71%(21/196),在高载脂蛋白A1 水平组分别为2.55%(5/196)、5.61%(11/196)、6.12%(12/196)。在CVD 死亡方面,低载脂蛋白A1 水平组累积生存率较低(2=6.461,P <0.05),见封二彩图2。
2.4 低载脂蛋白A1 水平对PD 患者预后的预测价值 对患者人口统计学及重要实验室指标进行校正后,低载脂蛋白A1 水平是PD 患者全因死亡的独立危险因素(HR=0.310,95%CI:0.119 ~0.811,P <0.05);同时,低载脂蛋白A1水平也是PD 患者CVD 死亡的独立危险因素(HR=0.271,95%CI:0.079 ~1.202,P <0.05)。
3 讨论
PD 患者普遍存在严重的脂质代谢紊乱[4-5],以载脂蛋白A1、三酰甘油、高密度脂蛋白等变化尤为严重。载脂蛋白A1主要分布于高密度脂蛋白中,并且是它的核心组成成分[6]。因此,载脂蛋白A1的表达可能很大程度上决定了血浆中高密度脂蛋白水平[7]。本文发现高载脂蛋白A1 水平组患者的高密度脂蛋白水平也相对较高,且高高密度脂蛋白是低载脂蛋白水平发生的保护因素,这也验证了它们间存在密切相关性。研究表明甲状旁腺激素和尿毒症患者的脂质代谢紊乱相关[8]。Lim 等[8]发现甲状旁腺激素水平与载脂蛋白A1 水平呈负相关。但本文却发现高甲状旁腺激素水平是低载脂蛋白A1 水平发生的保护因素。这可能与样本量、透析方式及人群差异等因素相关。本文还发现低载脂蛋白A1 水平组的24 h 尿量比高载脂蛋白A1 水平组低,且高24 h尿量水平是低载脂蛋白A1水平发生的保护因素。Goek 等[9]研究发现高载脂蛋白A1 水平与慢性肾脏病的低发生率及较好的肾功能显著相关。24h尿量又是衡量PD 患者残肾功能的指标之一,推测24 h 尿量和载脂蛋白A1 水平存在相关性。
本文发现在全因死亡及CVD死亡方面,低载脂蛋白A1 水平组累积生存率均低于高载脂蛋白A1 水平组。多项临床研究也发现载脂蛋白A1 能够更好地预测心血管疾病的发生[3]。这也提示载脂蛋白A1 水平与PD 患者预后密切相关。
本文发现低载脂蛋白A1 水平是PD患者全因死亡和CVD 死亡的独立危险因素。Zhan 等[4]研究发现载脂蛋白B/载脂蛋白A1 比值的增加与PD患者全因死亡和CVD 死亡独立相关。但Sato 等[10]研究表明载脂蛋白A1 水平并不是PD患者全因死亡及CVD 死亡的独立危险因素。产生不同结果的原因可能与研究人群和随访时间的差异有关。载脂蛋白A1 具有激活卵磷脂-胆固醇脂酰转移酶的作用,促使血管内皮中巨噬细胞来源的泡沫细胞内的多余胆固醇流出细胞,减少胆固醇在血管内皮细胞内沉积,从而阻止血管粥样硬化形成,减少CVD的发生[6]。由此可以得知载脂蛋白A1 水平异常可直接影响PD患者的血脂代谢,从而影响PD 患者的生存预后。
