基于网络药理学探讨苦参治疗骨癌痛的分子机制
2021-10-19龙慎豪刘亚丽
龙慎豪 张 炜 刘亚丽 胡 卫
(1. 三峡大学 医学院, 湖北 宜昌 443002; 2. 宜昌市中医医院 肿瘤科, 湖北 宜昌 443002)
骨癌痛是一种严重的癌症并发症,常出现在原发性骨肿瘤,或源于乳腺癌和前列腺癌等的继发骨转移。研究表明,约有1/3的骨转移患者存在过骨癌痛,骨癌痛也被认为是最难治疗的疼痛症状之一,严重影响着患者的生活质量[1,2]。到目前为止,骨癌痛的治疗效果仍不理想,如何有效控制骨癌痛已然成为亟需解决的临床问题。
现代医学控制骨癌痛的方法主要集中在抗肿瘤方面,辅助以三阶梯止痛疗法。但这种方案对中晚期癌症患者的疼痛症状改善不明显,且存在着严重的副作用,比如恶心、便秘、头昏、呼吸抑制、嗜睡以及阿片类镇痛药引起的耐药性和成瘾性等[3,4]。中医药在治疗骨癌痛方面与西医药有着独特区别,一方面中药疗效持久且副作用小,另一方面中药还能改善患者精神状态,提高患者生存质量[5]。中药苦参是豆科槐属植物苦参(sophoraflavescens)的干燥根,始载于《神农本草经》,是我国历史悠久的传统中药之一。苦参在中药中按功效分类属于清热药中的清热燥湿药,功效清热燥湿、杀虫、利尿等。常用于治疗热痢、黄疸、尿闭、湿疹、湿疮、疼痛等疾病。对苦参的现代药理学研究发现,苦参具有抗免疫抑制、抗肿瘤、抗炎、镇痛等药理作用[6]。研究表明,复方苦参注射液对骨癌痛疗效确切,并能明显缓解疼痛,提高患者的生活及生存质量[7]。然而,关于复方苦参注射液的主要组成成分——苦参治疗骨癌痛研究仍较少。因此,在本研究中,我们将运用网络药理学和生物信息学方法来预测苦参治疗骨癌痛的潜在药理学机制。
1 材料与方法
1.1 苦参的活性成分收集与筛选
以“苦参”或“kushen”为关键词,分别检索中医系统药理学数据库(TCMSP, http://tcmspw.com/tcmsp.php)和中药分子机制的生物信息学分析工具(BATMAN,http://bionet.ncpsb.org/batman-tcm/)。剔除重复结果后,初步获取苦参成分。研究证明,当化合物分子的口服生物利用度 (oral bioavailability,OB) ≥30%,类药性 (drug likeness, DL) ≥0.18时能很好地被人体吸收,也具有更好的药理特性[8,9]。因此,利用TCMSP数据库中的药代动力学工具,以OB≥30%同时DL≥0.18作为标准,筛选得到待研究的活性化合物。
1.2 活性成分的潜在靶点预测
以上述每个活性化合物的名称作为关键词,逐一对医学文献检索服务系统PubMed (https://pubmed.ncbi.nlm.nih.gov/)数据库进行检索,将每一个活性成分分子的3D结构以结构数据文件 (Structure Data File, SDF)格式保存。然后,将所有活性分子的SDF文件上传到Swiss (http://www.swisstargetprediction.ch/)数据库[10],设置物种为“Homo sapiens”,只保留可能性大于0的靶点,作为活性成分的预测靶点集。
1.3 骨癌痛的已知治疗靶点
骨癌痛的已知治疗靶点,通过检索关键词“cancer induced bone pain”、“bone cancer pain”和“cancer pain”,从治疗靶点数据库(therapeutic target database,TTD, http://db.idrblab.net/ttd/)及GeneCards数据库(https://www.genecards.org/)中获得[11]。同样,设置物种为“Homo sapiens”,并剔除重复项后作为疾病已知治疗靶点集。最后,将上述预测靶点集合疾病已知治疗靶点集导入唯一蛋白靶点数据库(unique protein, UniProt, https://www.uniprot.org/)中进行命名标准化,再取这两个靶点集的交集部分,作为候选靶点[12]。
1.4 网络构建与分析
将上述候选靶点上传至到蛋白质相互作用在线分析平台STRING(https://string-db.org/)数据库,设置物种为“Homo sapiens”,获取核心靶标之间的蛋白相互作用关系,并将筛选条件设置为最高可信度“highest confidence(≥0.7)”,其余参数默认。剔除掉游离于网络的靶点后,剩下的即为网络核心靶点。再采用Cytoscape (http://www.cytoscape.org/) 软件来构建“药物-成分-靶点-疾病”网络,进行数据的可视化分析[13]。
1.5 靶点的GO-BP(基因生物学功能)和KEGG信号通路富集
为了更好地说明上述网络核心靶点的生物学过程(biological process)及其所涉及的信号通路富集情况,我们利用CTD(http://ctdbase.org/)数据库对这些核心靶点进行了基因本体论-生物学过程 (Gene Ontology-Biological Process,GO-BP)与京都基因与基因组百科全书 (Kyoto Encyclopedia of Genes and Genomes,KEGG)信号通路富集分析,以错误发现率(FDR)≤0.01为筛选条件,并根据FDR值由小到大排序[14,15]。
2 结果
2.1 活性成分信息
通过对TCMSP和BATMAN数据库检索共得到45个唯一化合物,其中符合TCMSP数据库中药代动力学筛选条件OB≥30%、 DL≥0.18的,且能以其化合物3D分子结构反向预测靶点的活性成分共有34个。苦参中活性成分详细信息见表1。

表1 苦参活性化合物相关信息
2.2 核心靶点鉴定
通过分子反向预测,共得到预测靶点3 400个,剔除重复项后共775个唯一值。检索TTD和GeneCards数据库共得到129个骨癌痛的已知治疗靶点。将靶点预测集与已知集取交集后导入STRING数据库,得到靶蛋白之间的交互作用图(图1)。按照上述标准筛选,最后保留了32个网络核心靶点作为后续研究对象。核心靶点的基本信息见表2。

表2 网络核心靶点基本信息
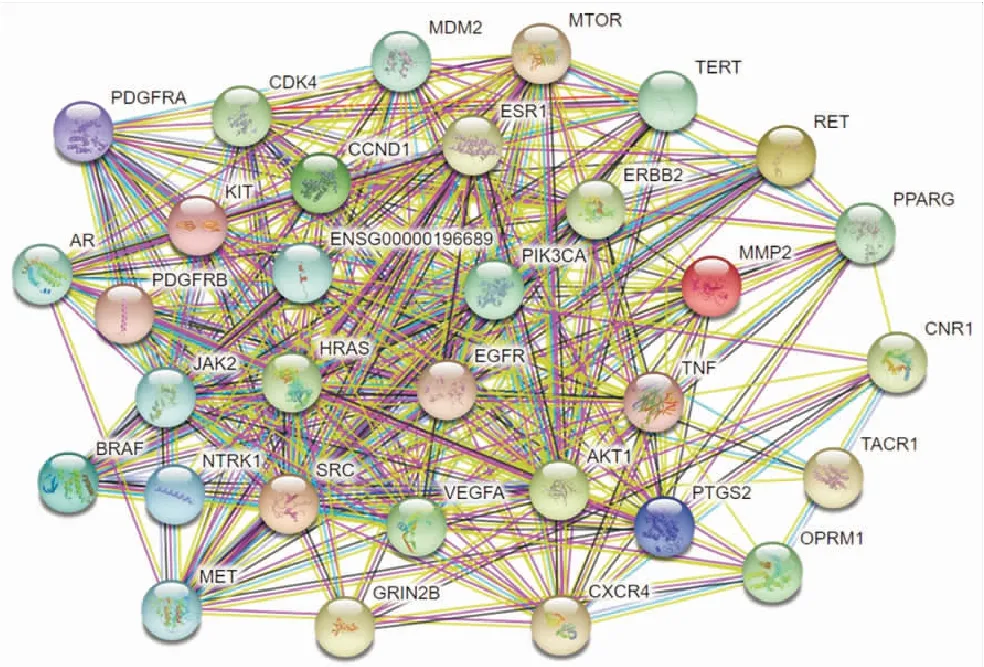
图1 核心靶点之间的蛋白互作关系网络
2.3 “药物-成分-靶点-疾病”网络与分析
由于中药具有多成分、多靶点、多重药理作用的特性,通过网络分析探讨中药治疗复杂疾病的潜在机制具有现实意义。为了说明苦参、活性成分、靶标和骨癌痛之间的关系,采用excel文件格式分别定义各节点及各连线的属性和关系,通过Cytoscape软件构建了“苦参-活性成分-靶标-骨癌痛”的复合网络。其中,各节点的大小按照其在网络中的度 (degree)值由小到大渐变,各节点的颜色则依据其在网络中的临近中心性 (neighborhood connectivity),由浅色向深色渐变,如图2所示。

图2 网络核心靶点基本信息
2.4 富集分析结果
通过CTD数据库对24个候选靶点进行GO富集分析(FDR≤0.01),得到GO (biological process)条目895条,其中核心靶基因主要参与调节神经再生、炎症反应、神经分化、化学突触传递、疼痛感受、神经炎症反应等生物学过程,见图3。
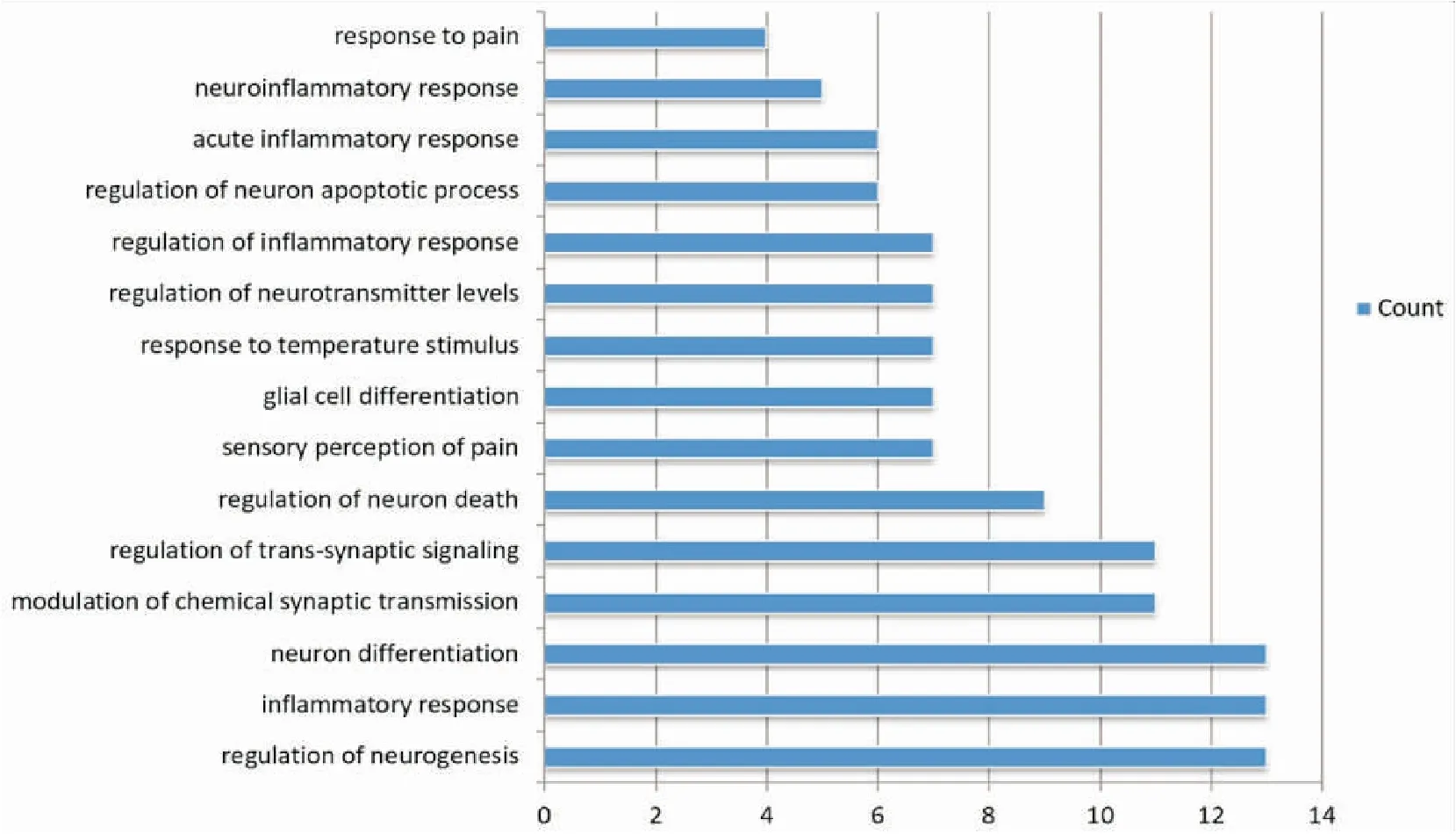
图3 靶点的生物学过程富集分析
此外,根据通路注释富集 (FDR≤0.01)结果,共得到信号通路196条。通过分析发现,核心靶点主要富集在破骨细胞分化、神经生长因子的跨膜转运、PI3K-Akt信号通路、轴突导向、癌症中的胆碱代谢、与配体-受体接触、钙离子转运、神经递质绑定及转运等多种生物信号途径,见图4。

图4 核心靶点的信号通路富集分析
3 讨论
骨癌痛作为转移性肿瘤的常见并发症,不仅难以有效控制,而且还严重影响患者的生活及生存质量[16]。本研究采用了网络药理学的方法来探究苦参治疗骨癌痛的潜在作用机制。通过检索相关数据库和应用药代动力学筛选,共鉴定出苦参中的34种活性成分,包括薯蓣皂素、苦参碱、去甲苦参醇、毛地黄黄酮、多种氧化性苦参碱(如7,11-dehydromatrine、(+)-7,11-dehydromatrine、5α,9α-dihydroxymatrine)、苦参素、谷甾醇、槲皮素等。一项关于氧化苦参碱的研究表明,氧化苦参碱可能通过调控TLR4/NF-κB信号通路,抑制背根神经节中星形胶质细胞的活化,从而抑制炎症因子释放,缓解乳腺癌转移大鼠模型的骨癌痛[17]。另外一项关于谷甾醇的报道也证明苦参能减轻癌症相关性疼痛[18,19]。此外,还有研究发现,槲皮素可通过调节核因子-κB受体活化因子配体 (receptor activator of NF-κB ligand, RANKL)/ 核因子-κB受体活化因子 (receptor activator of NF-κB,RANK)/ 骨保护素(osteoprotegerin,OPG)信号通路和炎症反应,抑制骨癌疼痛模型中的破骨细胞活化,减少骨破坏。还通过调节瞬时受体电位香草酸受体1 (transient receptor potential vanilloid subfamily member1, TRPV1)信号通路抑制骨癌疼痛的外周敏化和中枢敏化[20]。除了直接止痛作用外,还有一些成分,比如薯蓣皂素、大豆抗毒素、柚皮素等,均被报道具有直接的抗肿瘤或抑制肿瘤转移的作用[21-23]。基于上述事实,我们推断苦参可能通过其含有的多种活性成分协同作用治疗骨癌痛,这也与网络药理学中的“多成分”共同作用机制的内涵相吻合。
结合Cytoscape软件生成的关于“苦参-成分-靶点-骨癌痛”网络(见图2)的拓扑性质数据发现,该网络中靶点的度雄激素受体 (androgen receptor, AR)(度值17)、雌激素受体1 (estrogen receptor 1, ESR1)(度值16)、基质金属蛋白酶2 (matrix metallopeptidase 2, MMP2)(度值13)、速激肽受体1 (tachykinin receptor 1, TACR1)(度值13)和肝细胞生长因子受体 (mesenchymal-epithelial transition, MET)(度值12),而网络中靶点的临近中心性 (neighborhood connectivity) top5则分别是瞬时感受器电位辣椒素通道(transient receptor potential vanilloid channel type 1,TRPV1)(临近中心性17)、血小板衍生生长因子受体β (platelet-derived growth factor receptor β, PDGFRB)(临近中心性16.8)、血小板衍生生长因子受体α (platelet-derived growth factor receptor α, PDGFRA)(临近中心性16)、酪氨酸激酶受体2 (receptor tyrosine kinase 2, ERBB2)(临近中心性14.6)和哺乳动物雷帕霉素靶蛋白 (mammalian target of rapamycin, mTOR)(临近中心性14.5)。这表明仅就该复合网络本身的拓扑性质而言,这些靶点处于枢纽地位,因此也将作为后续的重点讨论对象。在这些靶点之中,TRPV1被众多研究报道参与调控骨癌痛的发生与发展。有报道证实,肿瘤组织的内源性甲醛能够通过TRPV1激活并诱导骨癌痛[24]。此外,有研究报道通过下调Janus激酶/磷脂酰肌醇3-激酶 (Janus kinase/Phosphatidylinositol 3-kinase,JAK/PI3K)信号通路来抑制背根神经节中神经元TRPV1的功能,可降低骨癌大鼠背根神经节神经元的高兴奋性和痛觉过敏状态[25]。还有研究发现,通过抑制骨癌痛大鼠模型体内胰岛素样生长因子1 (insulin-like growth factor 1,IGF-1)受体的表达,可以逆转骨癌痛大鼠的机械触痛和热痛觉过敏状态[26]。除了TRPV1之外,ERBB2分子也被报道能阻断蛋白激酶α、丝裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)介导的信号转导从而实现对骨癌痛的抑制作用[27]。其他靶分子如ESR1、MMP2、TARC1、MET、mTOR等也被证明具有抗炎、抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡及抑制肿瘤细胞转移等多方面作用[28-31]。
为了更好地理解核心靶点与骨癌痛之间的联系,我们采用CTD数据库进行基因功能的生物学过程GOBP及信号通路富集情况分析。基因功能富集结果表明,这些靶基因主要参与调控神经再生、神经胶质细胞分化、炎症反应、神经炎症反应、感受疼痛刺激、外界物理(温度、压力等)刺激反应等。此外,信号通路分析结果发现,这些核心靶点主要富集于PI3K-Akt信号通路、mTOR信号通路、钙离子信号通路、趋化因子信号通路等,并协调参与了包括癌症中胆碱代谢、细胞因子受体相互结合、炎症介质调控瞬时受体电位(transient receptor potential,TRP)通路、神经受体-配体互作、破骨细胞分化等在内的多种生物学过程。目前关于骨癌痛的发病机制研究中,多倾向于认为骨癌痛的发生发展与神经敏化、肿瘤微环境衍生物刺激、炎症细胞分泌物刺激和成骨-破骨动态平衡打破等相关[32-35],这与我们的GOBP和KEGG富集结果一致。
综上所述,本研究采用网络药理学的研究方法,揭示了苦参通过其多种活性成分靶向多基因治疗骨癌痛的潜在分子机制,为骨癌痛的临床治疗提供了理论基础。当然,由于数据库的更新情况限制,本研究中所涉及的成分和靶点数据均缺乏一定的完整性,相关机制也有待后续进一步的验证。
