覆盆子饮片标准汤剂制备及质量评价方法研究
2021-10-14吴远波刘宇政吴靓吴克勤冷红文焦涛张鸿
吴远波 刘宇政 吴靓 吴克勤 冷红文 焦涛 张鸿
【摘要】目的:制备覆盆子饮片标准汤剂,并建立质量评价方法。方法:按技术要求制备12批覆盆子标准汤剂,测定鞣花酸成分含量并计算其转移率,测定出膏率,并建立标准汤剂HPLC指纹图谱分析方法。结果:通过对12 批覆盆子标准汤剂进行测定,鞣花酸转移率为49.9%~82.8%,出膏率为13.2%~15.5%;指纹图谱中标定了9 个共有峰,指认了其中3 个峰,12 批覆盆子标准汤剂相似度均>0.9。结论:本研究可为覆盆子配方颗粒制备提供标准参考。
【关键词】覆盆子;标准汤剂;质量评价;指纹图谱
【中图分类号】R283 【文献标志码】 A【文章编号】1007-8517(2021)23-0039-06
Preparation and Quality Evaluation of Rubi Fructus Standard Decotion
WU Yuanbo1LIU Yuzheng1WU Jing1WU Keqin1LENG Hongwen1JIAO Tao2ZHANG Hong1*
1. Jiangxi Academy of Medical Science, Nanchang 330006, China;
2.Drug Detection Department, Dandong Market Supervision Service Center, Dandong 118002, China
Abstract:Objective To prepare Rubi Fructus standard decotion, and to establish the method for the quality evaluation. Methods 12 batches of Rubi Fructus standard decotion were prepared according to technical requirement. Ellagic acid was determined and the transfer rate was calculated. The extraction rate was determined. The HPLC fingerprint chromatogram analysis method of the standard decotion were established. Results According to the detection of 12 batches of Rubi Fructus standard decotion, the transfer rate ranged from 49.9% to 82.8% and the extraction rate ranged from 13.2% to 15.5%. 9 common peaks were determined and 3 of them were identified in the fingerprint chromatogram. Moreover, the similarities of 12 batches of Rubi Fructus standard decotion were all over 0.9. Conclusion This study can provide a standard reference for the preparation of Rubi Fructus formula granules.
Key words:Rubi Fructus; Standard Decotion; Quality Evaluation; Fingerprint Chromatogram
中药配方颗粒既继承了传统汤剂的优点,又具有服用方便、易于贮藏、质量稳定、便于调剂等优势[1],被广泛关注,也越来越多地被医生和患者接受。然而,中药配方颗粒与传统中药饮片汤剂在临床应用中是否等效备受争议[2-3],且尚无统一的制备工艺和质量标准[4-5],仍需进一步规范和完善。为解决中药配方颗粒发展面临的问题,2021年1月,国家药品监督管理局在征求意见稿的基础上正式发布《中药配方颗粒质量控制与标准制定技术要求》 (以下简称《技术要求》),提出标准汤剂为衡量单味中药配方颗粒是否与其相对应的单味中药饮片临床汤剂基本一致的物质基准,并提出中药配方颗粒的所有药学研究均须与标准汤剂进行对比[6-7]。
覆盆子为蔷薇科植物华东覆盆子Rubus chingii Hu的干燥果实,夏初果实由绿变绿黄时采收,为常用中药,具有益肾固精缩尿、养肝明目的功效,用于遗精滑精,遗尿尿频,阳痿早泄,目暗昏花[8]。覆盆子含有萜类、黄酮、甾体类、香豆素和酚酸等活性化合物[9-14],具有抗腫瘤、降血糖血脂、抗氧化、抗衰老等作用[15-20]。研究选用主产区、且符合药典要求的12批覆盆子饮片制备标准汤剂,以鞣花酸为指标成分,对其进行含量测定,计算出膏率和鞣花酸转移率范围,并对标准汤剂进行HPLC指纹图谱研究,为覆盆子饮片标准汤剂的作为物质基准的应用奠定基础。
1 仪器与材料
1.1 仪器 Thermo Scientific UltiMate 3000高效液相色谱仪(包括四元梯度泵,WPS-3000SL自动进样器,TCC-3000RS柱温箱,DAD-3000检测器,ThermoFisher公司);LGJ-10冷冻干燥机(四环福瑞科仪科技发展有限公司);RE-52AA旋转蒸发器(上海亚荣生化仪器厂); EX125ZH电子天平(奥豪斯仪器有限公司,感量0.01mg);FR124CN电子天平(奥豪斯仪器有限公司,感量0.1mg);SHB-Ⅲ循环水式多用真空泵(郑州长城科工贸有限公司);KQ-500E超声波清洗器(昆山市超声仪器有限公司);DKM610C干燥箱(重庆雅马拓科技有限公司);DK-98-ⅡA电热恒温水浴锅(天津市泰斯特仪器有限公司)。
1.2 试药 鞣花酸对照品(批号:wkq19010702,含量以99.8%计)、椴树苷(批号:wkq18122702,含量以98.0%计)均购自四川省维克奇生物科技有限公司。山柰酚-3-O-芸香糖苷对照品(批号:S-065-180314,含量以99.3%计)购自成都瑞芬思生物科技有限公司。乙腈、甲醇为色谱纯,水为娃哈哈纯净水,甲醇、乙醇、磷酸等其他试剂均为分析纯。
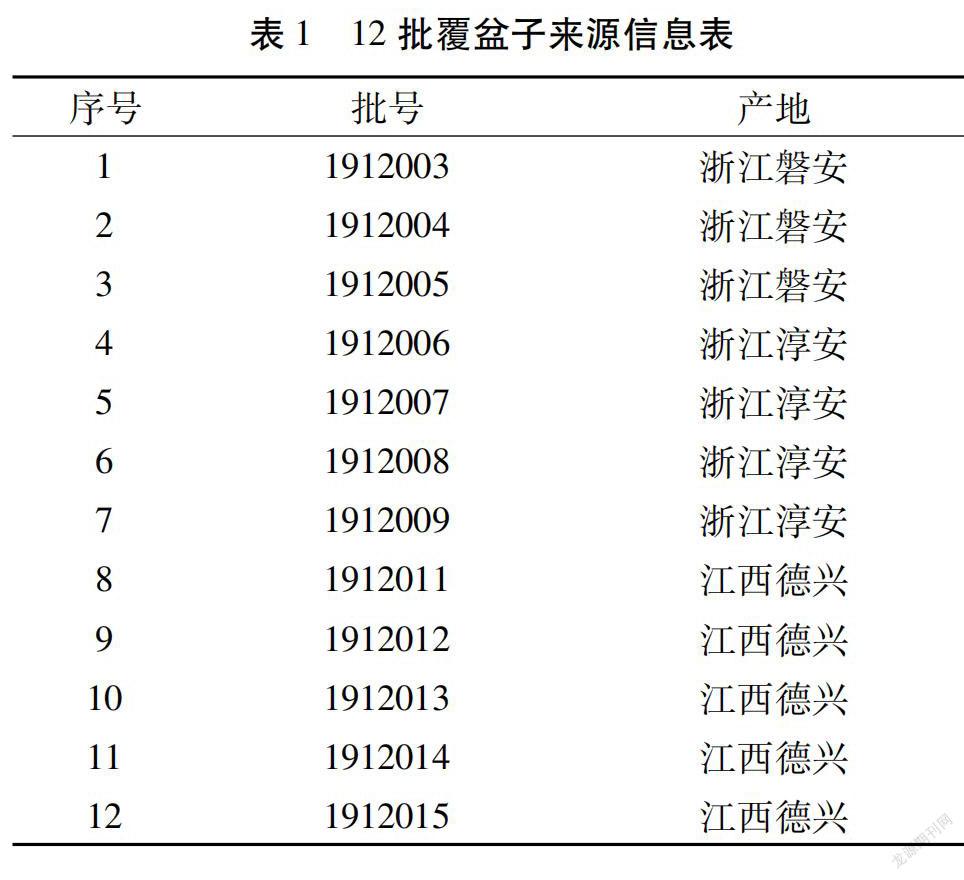
12批不同来源覆盆子药材,经丹东市市场监管事务服务中心药检部焦涛主管中药师鉴定为蔷薇科植物华东覆盆子Rubus chingii Hu的干燥果实,覆盆子信息见表1。
2 方法与结果
2.1 覆盆子饮片的检测 取覆盆子饮片按《中国药典》2015年版一部“覆盆子”饮片项下[21]標准进行检测,结果符合药典规定。
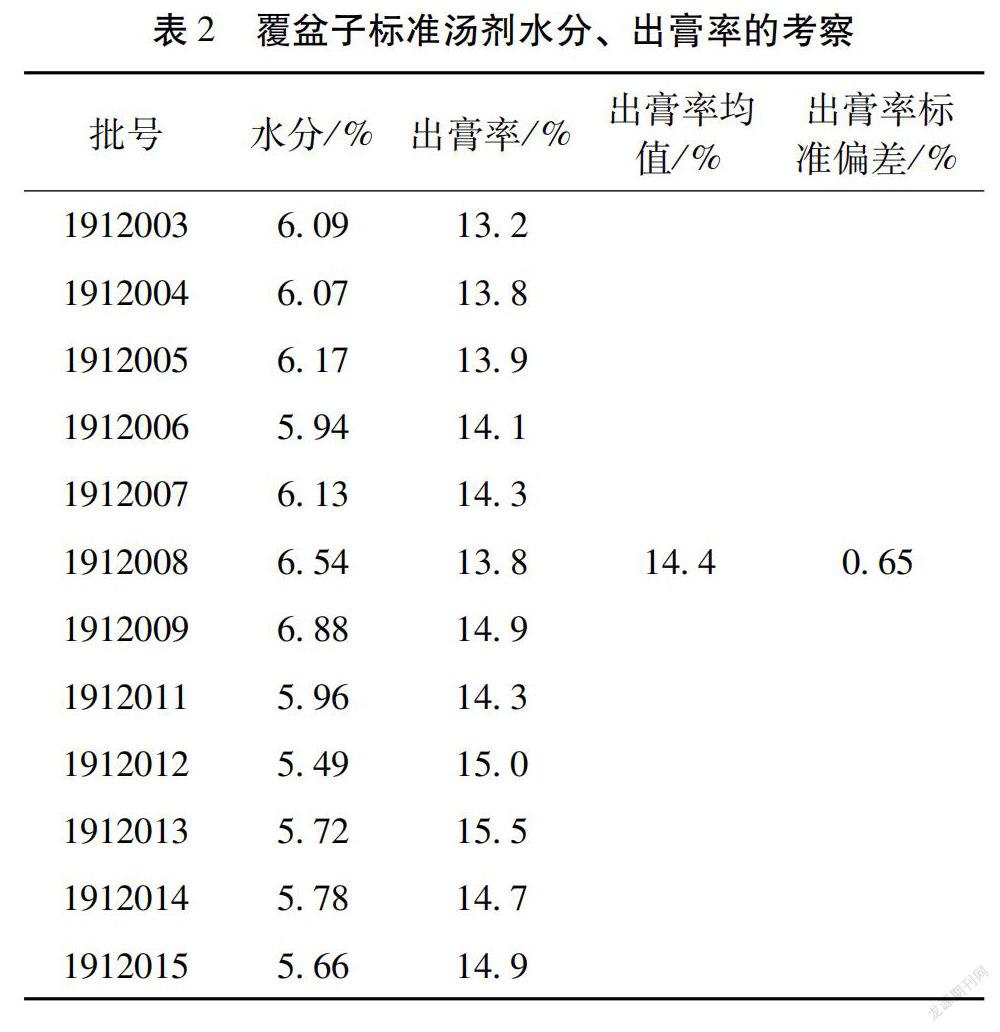
2.2 覆盆子饮片标准汤剂的制备 取覆盆子饮片,敲破,称取100.0 g,加水煎煮二次,第一次加800 mL水,浸泡30 min,煎煮30 min,趁热用200 目不锈钢筛网滤过,滤液应迅速冷却,第二次加600 mL水,煎煮20 min,趁热用200 目不锈钢筛网滤过,滤液迅速冷却,合并两次的药液。将药液采用减压浓缩的方法进行低温浓缩,控制浓缩温度不超过50℃,将水煎滤液体积浓缩至约200 mL(0.5 g生药/mL)。将浓缩液放置到冷冻干燥机的干燥盘中,再放置到冷冻干燥机上进行冷冻干燥,得标准汤剂样品。测定标准汤剂样品的水分,并计算出膏率。标准汤剂的样品信息见表2。
2.3 覆盆子标准汤剂鞣花酸含量测定 《中国药典》2020年版一部“覆盆子”项下将鞣花酸作为含量测定项的控制指标,规定覆盆子饮片含量不得少于0.20%[8],本文选择鞣花酸为覆盆子标准汤剂含量测定的指标成分。
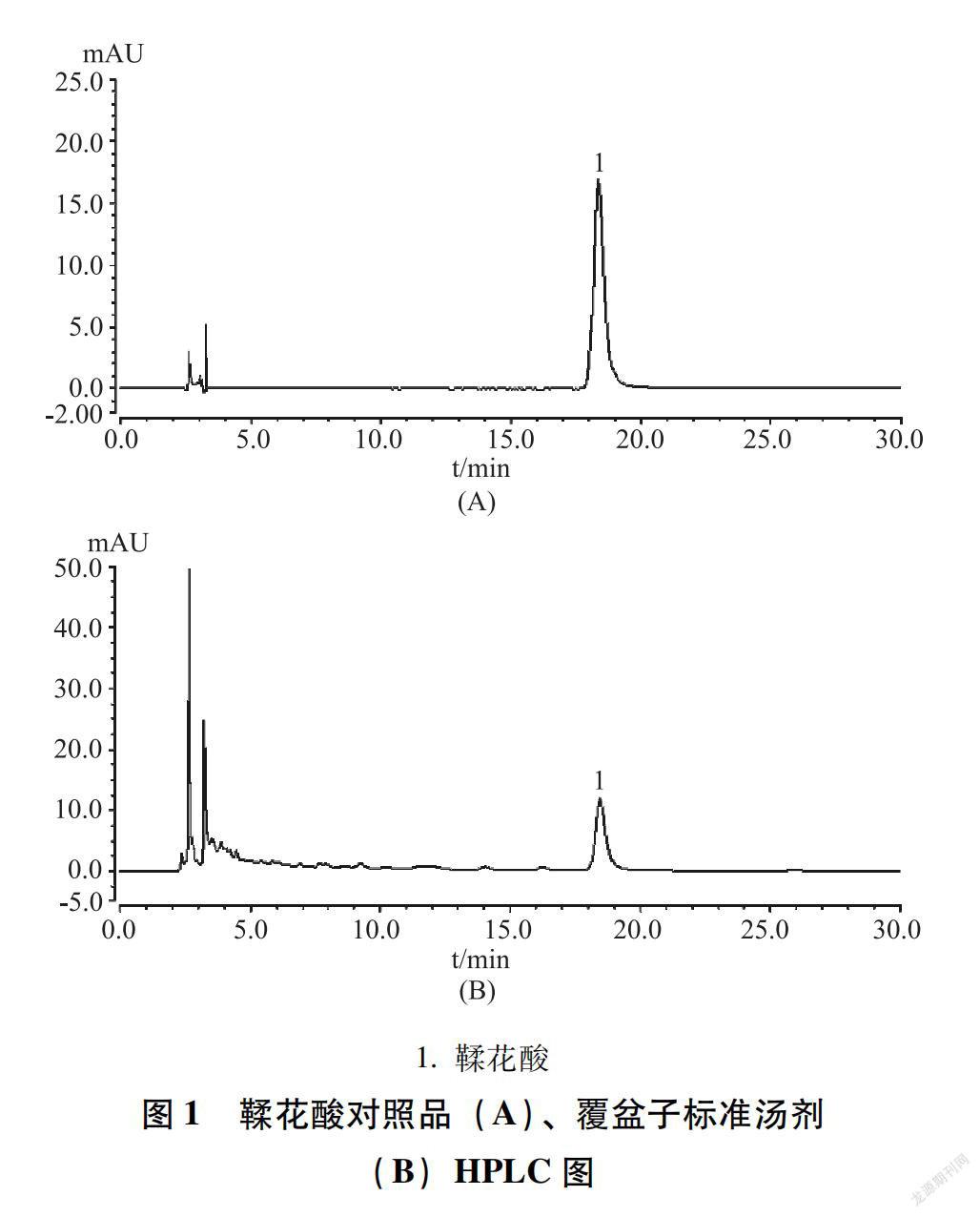
2.3.1 色谱条件 色谱柱为Capcell Pak C18(4.6 mm×250 mm,5 μm);流动相为乙腈-0.2%磷酸溶液(15∶85);检测波长为254 nm;柱温为30℃;流速为1.0 mL/min;进样量为10 μL。该色谱条件下,供试品溶液鞣花酸峰分离良好。如图1所示。
1.鞣花酸
2.3.2 对照品溶液的制备 取鞣花酸对照品适量,精密称定,加甲醇溶解并制成含鞣花酸4.97μg/mL的对照品溶液。
2.3.3 供试品溶液的制备 取覆盆子标准汤剂冻干粉适量,置碾钵中研细,取约0.15 g,精密称定,置具塞锥形瓶中,精密加入70%甲醇50 mL,将锥形瓶密塞,称定重量,超声处理(功率500W,频率40 KHz)30 min,放冷,再称定重量,用70%甲醇补足减失的重量,摇匀,滤过,取续滤液,即得供试品溶液。
2.3.4 线性关系考察 分别精密吸取鞣花酸对照品溶液(49.68 μg/mL)0.2、0.4、1、1.6、2、4 mL,置于10 mL容量瓶中,加甲醇稀释至刻度线,摇匀,即得系列浓度的对照品溶液。按“2.3.1”项下的色谱条件测定,分别进样10 μL,记录鞣花酸的峰面积。以对照品的进样量(X,μg)为横坐标,以峰面积(Y)为纵坐标,进行线性回归,得线性回归方程:Y=1.6562X+0.2975(r=0.9994)。结果表明,鞣花酸的进样量在0.009936~0.1987 μg范围内与峰面积有良好的线性关系。
2.3.5 仪器精密度试验 精密吸取“2.3.2”项下对照品溶液10 μL,按“2.3.1”项下的色谱条件,连续进行6 次的进样测定,记录鞣花酸的峰面积。按峰面积计算,鞣花酸的RSD为0.9%。结果表明仪器精密度良好。
2.3.6 重复性 取同一批样品(批号:1912004),按“2.3.3”项下的方法制备供试品溶液6 份,按“2.3.1”项下的色谱条件进行测定,记录鞣花酸的峰面积,计算待测目标成分的含量。结果鞣花酸的平均含量为1.12%,RSD为1.2%,表明该含量测定方法的重复性良好。
2.3.7 稳定性试验 取覆盆子标准汤剂同一份供试品溶液,分别在制备后0、2、4、8、12、24 h,按“2.3.1”项下的色谱条件进样10 μL,记录鞣花酸的峰面积,考察样品溶液的稳定性。计算得鞣花酸峰面积的RSD为1.0%,结果表明供试品溶液在24 h内稳定。
2.3.8 加样回收率试验 取已知含量的样品(批号:1912004)适量,研细,取6份,每份约0.075 g,精密称定,根据标准汤剂中鞣花酸的含量按1∶1的比例添加鞣花酸对照品,按“2.3.3”项下的方法制备,按“2.3.1”项下的色谱条件测定,计算得鞣花酸平均回收率为97.9%,RSD为1.5%。结果表明本法具有良好的回收率。
2.3.9 样品测定 取覆盆子标准汤剂12批样品,置碾钵中研细,取约0.15 g,精密称定,按“2.3.3”项下的方法制备,按“2.3.1”项下的色谱条件测定,记录鞣花酸峰面积,计算12批覆盆子饮片标准汤剂中鞣花酸的含量,并计算含量转移率,结果见表3。
2.4 覆盆子标准汤剂HPLC指纹图谱测定
2.4.1 色谱条件 色谱柱为Capcell Pak C18(4.6mm×250 mm,5 μm);流动相为乙腈(A)-0.2%磷酸(B),梯度洗脱(0~10 min,10%A;10~25 min,10%~15%A;25~40 min,15~20% A;40~55 min,20%~45% A;55~60 min,45% A;60~61 min,45%~10% A;61~73 min,10% A);检测波长为340 nm;柱温为35℃;流速为1.0 mL/min;进样量为5 μL。混合对照品与标准汤剂色谱图见图2。
5.鞣花酸;6.山柰酚-3-O-芸香糖苷;8.椴树苷
经查阅文献[8,22],并对比对照品色谱图,判别5、6、8号峰分别为鞣花酸、山柰酚-3-O-芸香糖苷、椴树苷。其中鞣花酸峰含量高、稳定性较好、分离度较好,且《中国药典》2020年版一部“覆盆子”项下鞣花酸为其含量测定项的控制指标,故选择鞣花酸峰为参照峰(S)[23],计算覆盆子标准汤剂中主要共有峰的相对保留时间、相对峰面积。
2.4.2 对照品溶液的制备 取鞣花酸对照品、山柰酚-3-O-芸香糖苷对照品、椴树苷对照品适量,精密称定,加甲醇溶解并制成含鞣花酸84.79 μg/mL、山柰酚-3-O-芸香糖苷32.58 μg/mL、椴树苷7.74 μg/mL的混合对照品溶液。
2.4.3 供试品溶液的制备 取覆盆子标准汤剂冻干粉适量,置碾钵中研細,取约0.1 g,精密称定,置具塞锥形瓶中,精密加入50%乙醇25 mL,将锥形瓶密塞,称定重量,超声处理(功率500 W,频率40 KHz)30 min,放冷,再称定重量,用50%乙醇补足减失的重量,摇匀,滤过,取续滤液,即得供试品溶液。
2.4.4 仪器精密度试验 精密吸取覆盆子标准汤剂同一份供试品溶液5 μL,按“2.4.1”项下的色谱条件,连续进行6 次的进样测定,记录液相色谱图,以鞣花酸峰为参照峰,计算各共有峰的相对保留时间和相对峰面积的RSD。结果显示相对保留时间RSD<0.5%,相对峰面积RSD<3%,表明仪器精密度良好。
2.4.5 稳定性试验 取覆盆子标准汤剂同一份供试品溶液,分别于制备后0、2、4、8、12、24 h,按“2.4.1”项下的色谱条件进样5 μL,以鞣花酸峰为参照峰,计算各共有峰相对保留时间和相对峰面积的RSD。结果显示相对保留时间RSD<0.5%,相对峰面积RSD<3%,表明供试品溶液在24 h内稳定。
2.4.6 重复性试验 取同一批覆盆子标准汤剂样品,按“2.4.3”项下方法平行制备6 份供试品溶液,按“2.4.1”项下色谱条件进样测定,以鞣花酸峰为参照峰,计算各共有峰相对相对保留时间和相对峰面积的RSD。结果显示相对保留时间RSD<0.5%,相对峰面积RSD<3%,表明该方法重复性良好。
2.4.7 样品测定与分析 取12 批覆盆子饮片标准汤剂,按“2.4.3”项下方法分别制备供试品液,按“2.4.1”项下色谱条件进行测定,记录12批液相色谱图,用“中药色谱指纹图谱相似度评价系统(2012.130723版)”进行分析[24],生成对照指纹图谱,见图3,图4,相似度结果见表4。覆盆子标准汤剂指纹图谱中确定了9 个共有峰,12 批覆盆子标准汤剂与对照图谱之间的相似度均>0.9。
3 讨论
3.1 标准汤剂样品制备 本实验所采用的覆盆子饮片标准汤剂制备工艺是参照国家药品监督管理局公布的《技术要求》和卫生部、国家中医药管理局共同下发的《医疗机构中药煎药室管理规范》[25],选取合格的覆盆子饮片,以水为提取溶剂,按照临床汤剂煎煮方法规范化煎煮[6-7],过滤,低温减压浓缩,冷冻干燥,制得样品。为抑制热敏性成分的分解,减少成分损失,确保与饮片临床汤剂基本一致,严格按《技术要求》,煎煮结束后趁热进行过滤,滤液迅速冷却,控制浓缩温度不超过50℃,采用冷冻干燥的方法对浸膏进行干燥。冷冻干燥方法不仅可使标准汤剂有效成分的分解和损失最小,而且可以改进汤剂悬浊液状态难以保证均匀取样和不易贮藏的缺点。
3.2 鞣花酸含量测定方法的建立 供试品制备方法通过对提取溶剂(50%甲醇、70%甲醇、甲醇)、提取方式(超声处理和加热回流)和超声处理时间(20、30和40 min)的考察,最后选择正文的提取方法。比较了不同的色谱柱(Capcell Pak C18、Agilent ZORBAX SB C18、Thermo Scientific Syncronis C18),结果供试品液在3种色谱柱上均能得到较好的分离。
3.3 指纹图谱分析方法的建立 供试品制备方法通过对提取溶剂(50%甲醇、50%乙醇、70%甲醇、甲醇),提取方式(超声处理和加热回流)的考察,最后选择正文的提取方法。研究比较了甲醇和乙腈作为有机相,0.2%磷酸、0.5%醋酸作为无机相,经过优化流动相洗脱条件,最终选择乙腈-0.2%磷酸的梯度洗脱系统,各色谱峰分离效果好,色谱峰数量多、基线较平稳。本研究使用DAD检测器在190~400 nm全紫外波长扫描样品光谱图,提取254、280、310、340 nm处的色谱图进行比对,并参考相关文献[22],综合考虑色谱峰数、色谱信号、分离情况、基线平稳情况等方面因素,最终确定340 nm作为测定波长。同时考察 25℃、30℃、35℃柱温对色谱分离的影响,结果显示柱温对色谱分离效果有较大影响,35℃时所得指纹图谱的分离效果较好,故建议柱温设定为35℃。
本研究选取合格的12 批覆盆子饮片作为研究用样品,建立了质量评价方法,得出鞣花酸的转移率范围为49.9%~82.8%,出膏率范围13.2%~15.5%,均符合《技术要求》的范围要求;建立了HPLC指纹图谱,标定了9 个共有峰,指认了鞣花酸、山柰酚-3-O-芸香糖苷和椴树苷峰,各标准汤剂图谱与对照指纹图谱的相似度均大于0.9。本文研究的标准汤剂出膏率、指标成分转移率和指纹图谱三个参数是其作为物质基准的重要依据。本文的研究结果可为覆盆子配方颗粒后续的工艺研究、质量控制方法制定等提供标准参考。
参考文献
[1] 田红艳.浅析中药配方颗粒的优势[J]. 中国中医基础医学杂志,2012,18(4):443.
[2]吕朝耕,康传志,周良云,等.中药配方颗粒标准化研究现状与思路探讨[J]. 中国现代中药,2017,19(6):748-752.
[3]崔景朝,赵自明.中药配方颗粒研究进展(Ⅱ)—中药单煎与合煎对比研究概况[J]. 中国实验方剂学杂志,2011,17(4):240-245.
[4]陈培胜,朱月信. 中药配方颗粒行业标准研究思路[J].中医杂志,2012, 53(6):469-472.
[5]孙博,常阿倩,朱广伟,等.基于传统煎药工艺的川牛膝饮片标准汤剂制备及质量评价方法研究[J].世界中医药,2019,14(12):3144-3149.
[6]国家药品监督管理局.中药配方颗粒质量控制与标准制定技术要求(征求意见稿)[EB/OL].[2019-11-07].https://www.nmpa.gov.cn/xxgk/zhqyj/zhqyj yp/20191108160401438.html
[7]国家药品监督管理局.中药配方颗粒质量控制与标准制定技术要求[EB/OL].[2021-01-26].https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/202102101454531 81.html
[8]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2020:399.
[9]肖洪明,祖灵博,李石平,等.掌叶覆盆子化学成分的研究[J].中国药物化学杂志, 2011, 21(3):220-226.
[10]郭启雷,杨峻山.掌叶覆盆子的化学成分研究[J].中国中药杂志,2005,30(3):198-200.
[11]谢一辉,苗菊茹,刘文琴.覆盆子化学成分的研究[J].中药材,2005,28(2):99-100.
[12]郭启雷,杨峻山,刘建勋.掌叶覆盆子的化学成分研究[J].中国药学杂志,2007, 42(15):1141-1143.
[13]杜龙飞,李洁,杨龙,等.覆盆子的化学成分研究[J].天然产物研究与开发,2014,26:1957-196.
[14]籍艳秋. 覆盆子的补肾活性成分研究[J]. 中国卫生标准管理,2015,6(19):125-126.
[15]王艳春,李芳,陶蕾.覆盆子提取物对基质金属蛋白酶的体外抑制作用[J].中国临床药理学杂志,2011,27( 4):291-292.
[16]谢欣梅,庞晓斌.覆盆子提取物对2型糖尿病大鼠糖脂代谢的影响及对肝脏保护作用的研究[J].中成药,2013,35(3):460-465.
[17]朱会霞.覆盆子黄酮抗氧化活性研究[J]. 现代食品科技,2012,28(10):1302-1305.
[18]LIANA L, RIZAL R,WIDOWATI W, et al. Antioxidant and anti-hyaluronidase activities of dragon fruit peel extract and kaempferol-3-O-rutinoside[J]. Jurnal Kedokteran Brawijaya, 2019,30(4):247-252.
[19]夏軒轩,李昆,丁研华,等.覆盆子及有效部位对老年大鼠学习记忆能力的影响及机制初探[J].中药药理与临床,2015,31(3):110-113.
[20]ZENG H J,LIU Z,WANG Y P, et al. Studies on the anti-aging activity of a glycoprotein isolated from Fupenzi(Rubus chingii Hu.) and its regulation on klotho gene expression in mice kidney [J]. International Journal of Biological Macromolecules, 2018(119):470-476.
[21]国家药典委员会.中华人民共和国药典(一部)[M].北京:中国医药科技出版社,2015:382.
[22]中华人民共和国香港特别行政区卫生署.香港中药材标准(第六期)[S].2014:699.
[23]王秀文,马钊杰,靳如娜,等.蜜南葶苈子饮片及标准汤剂质量评价方法的建立[J]. 中国中药杂志,2020,45(4):884-889.
[24]陈浩,何小女.化橘红饮片标准汤剂的质量研究[J].江西中医药大学学报,2017,29(6):86-88,95.
[25]国家中医药管理局.医疗机构中药煎药室管理规范[EB/OL].[2009-03-16].http://www.satcm.gov.cn/yizhengsi/gongzuodongtai/2018-03-25/65 77.html
(收稿日期:2021-04-20 编辑:刘 斌)
