以糖蜜为原料利用双酶法制备低聚果糖
2021-09-28甄远航徐光辉谢凌波
潘 莹, 甄远航, 徐光辉, 谢凌波, 张 菡, 江 波*
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡214122;2.中粮屯河崇左糖业有限公司 广西壮族自治区认定企业技术中心,广西 崇左532200;3.中粮糖业控股股份有限公司 新疆维吾尔自治区甜菜制糖工程研究中心,新疆 昌吉831100)
糖蜜作为制糖业的加工副产品,是一种深褐色、呈黏稠状、半流动的液体,仅在蔗糖加工过程中每年就能产生350万吨的废料糖蜜。糖蜜中可溶性碳水化合物质量分数较高,含有40%~50%,蔗糖在所含糖类中质量分数超过50%,还含有质量分数8%~10%的矿物质和少量的蛋白质[1]。作为益生元的重要组成部分,低聚果糖(FOS)根据其结构可分为两类:葡萄糖-果糖型(GFn)和果糖-果糖型(Fn),GFn型FOS一般由蔗果三糖(GF2)、蔗果四糖(GF3)和蔗果五糖(GF4)组成[2]。FOS因具有良好的溶解性、热稳定性及较低的甜度,常用于提升食品口感与延长产品货架期[3]。此外,优良的保健功能和特殊的生理活性,如具有促进消化道有益菌的生长、吸附肠道病原菌、刺激机体产生免疫因子和提高饲料利用率等作用,使FOS逐渐被大众所关注,并被视为取代抗生素的可能配料之一。因此,将糖蜜作为原料利用双酶法制备低聚果糖具有重大意义[4-5]。
β-果糖基转移酶(FTase,亦称β-呋喃果糖苷酶)通过水解蔗糖分子上葡萄糖和果糖间的β(1→2)糖苷键,使果糖基与另一蔗糖分子连接而生成FOS[6]。Reddy等报道以2%(质量分数)甘蔗糖蜜和0.5%(质量分数)豆粕为底物,使Aspergillus nigerPSSF21产出的β-呋喃果糖苷酶(FFase)酶活最高,生成的主要产物为GF2和GF3[7]。以甜菜糖蜜为原料,Zhang通过发酵法制取低聚果糖,培养方法简单易行,操作方便,但该方案中仅利用微生物产生的果糖基转移酶水解糖蜜,长时间的发酵使低聚果糖含量大幅度降低,使低聚果糖在行业中的应用受到限制[8]。Khatun等鉴定出一种高效产低聚果糖的菌株Aureobasidium pullulan,以此作为全细胞生物催化剂,从而避免了昂贵的酶回收和纯化的需要[9]。但菌株的培养及活化通常需要36~72 h,二级种子液也至少需要发酵72 h,耗费时间过长。糖蜜中含有10%(质量分数)的胶体含量,其中胶体的主要成分是果胶质,较高的胶体含量引起糖蜜黏度过大,导致糖蜜利用困难,因此利用果胶酶(Pectinase)去除果胶质是糖蜜生产FOS的一个良好前提[10]。当前研究均以果糖基转移酶为单一酶,而作者以糖蜜为原料,利用果胶酶和果糖基转移酶为复合酶液,制备高转化率的低聚果糖,提高了制糖副产物的利用率及附加值,降低了饲料级低聚果糖的生产成本。
1 材料与方法
1.1 材料与试剂
糖蜜:中粮屯河崇左糖业有限公司提供;D-葡萄糖、D-果糖、蔗糖标准品:国药集团化学试剂公司产品;蔗 果 三 糖(GF2)、蔗 果 四 糖(GF3)、蔗 果 五 糖(GF4):Sigma公司产品;果胶酶(800 U/mL)、果糖基转移酶(5 000 U/mL):作者所在实验室提供;所用其他试剂均为分析纯。
1.2 仪器与设备
夹层酶反应器:上海申迪玻璃仪器有限公司产品;DF0825型浸入式高低温恒温循环装置:南京百思禾生物科技有限公司产品;RVDV-II+P型黏度计:美国Brookfield公司产品;FE20型pH计:梅特勒-托利多仪器(上海)有限公司产品;FreeZone冷冻干燥机:美国Labconco公司产品;Carbolite马弗炉:弗尔德(上海)仪器设备有限公司产品;K-360型凯氏定氮仪:瑞士Buchi公司产品;Waters e2695高效液相色谱仪:美国Waters公司产品。
1.3 实验方法
1.3.1 样品成分分析及检测方法蛋白质含量测定参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法;总糖含量测定参照GB 5009.7—2016《食品安全国家标准 食品中还原糖的测定》中直接滴定法;水分含量测定参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中直接干燥法;灰分含量测定参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》。糖组分及含量测定通过高效液相色谱仪和示差折光检测器联用测定。色谱条件如下:色谱柱为ZORBAX NH2柱(Agilent,4.6 mm×250 mm,5μm);流动相配比为V(乙腈)∶V(水)=70∶30;流量1 mL/min;进样量10μL;柱温30℃。
1.3.2 糖蜜酶解液的制备方法取一定量的糖蜜制备为水溶液,将糖蜜与水混合后搅拌至糖蜜完全溶解于水中并调整其固形物质量分数为50%,在一定的温度及pH条件下加入果胶酶和果糖基转移酶的复合酶液进行反应,定时取样,通过高效液相色谱检测溶液的糖分组成[11]。
1.3.3 不同复合酶液比例对FOS转化率的影响取1 L溶解后的糖蜜水溶液在反应温度为55℃、pH 5.5的条件下,加入12.5 mL不同比例的果胶酶和果糖基转移酶的复合酶液(果胶酶与果糖基转移酶体积比分别为10∶1、15∶1、20∶1、25∶1),并与单独加入果胶酶及果糖基转移酶的酶解液进行比较,反应过程中定时取样检测低聚果糖的转化率及黏度。
黏度测定:调节黏度计高度,使转子逐渐浸入样品中并稳定3 min后开始测量,当2号转子以100 r/min的转速在液体中旋转20圈后读数,每个样品测量3次。
1.3.4 不同反应温度对FOS转化率的影响将溶解后的糖蜜水溶液在反应温度分别为40、45、50、55、60℃,pH 5.5的条件下,加入果胶酶和果糖基转移酶的复合酶液(果胶酶与果糖基转移酶的体积比为20∶1),反应过程中定时取样检测。
1.3.5 不同反应pH对FOS转化率的影响将溶解后的糖蜜水溶液在反应温度为55℃,pH分别控制为4.5、5.0、5.5、6.0的条件下,加入果胶酶和果糖基转移酶的复合酶液(果胶酶与果糖基转移酶的体积比为20∶1),反应过程中定时取样检测。
1.3.6 冷冻干燥将所得酶解液沸水浴灭酶10 min,FOS糖浆浓缩至80%(质量分数)后放入真空冷冻干燥机内,调节真空冷冻干燥机的温度为-60℃,干燥得到固体。
1.4 数据处理
采用Origin 8.0进行曲线拟合和SPSS 21.0软件进行数据统计与分析。
2 结果与分析
2.1 糖蜜样品成分分析
对糖蜜样品的组成成分进行分析(见表1)。糖蜜中总糖的质量分数为55.03 g/hg,其中蔗糖质量分数为33.29 g/hg,占总糖质量分数的60.5%,与报道结果基本吻合[12]。
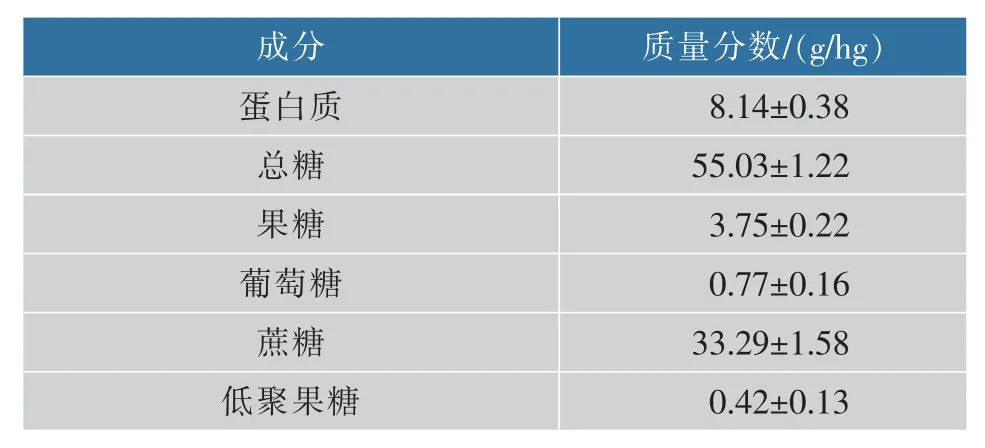
表1 糖蜜样品成分分析Table 1 Composition analysis of molasses
2.2 复合酶液比例对FOS转化率的影响
研究了果胶酶和果糖基转移酶的比例对FOS转化率的影响。由图1可知,果胶酶单独使用时对糖的组成几乎没有影响,果胶酶与果糖基转移酶的复配较单一使用果糖基转移酶可以显著提高FOS的转化率,且反应10 h后FOS转化率基本保持平衡。当果胶酶与果糖基转移酶的体积比从10∶1增加到25∶1时,FOS的转化率不断增加,最高达41.5%。而果胶酶与果糖基转移酶的体积比由20∶1增加到25∶1时,FOS的转化率增加不明显。因此,选用果胶酶与果糖基转移酶的体积比为20∶1。袁伟岗[13]利用固定化果糖基转移酶生产低聚果糖时,当蔗糖质量分数在45%~65%时,FOS的质量分数最高可达40%。而本文中底物仅含约25%(质量分数)的蔗糖即可达到相同的效果。
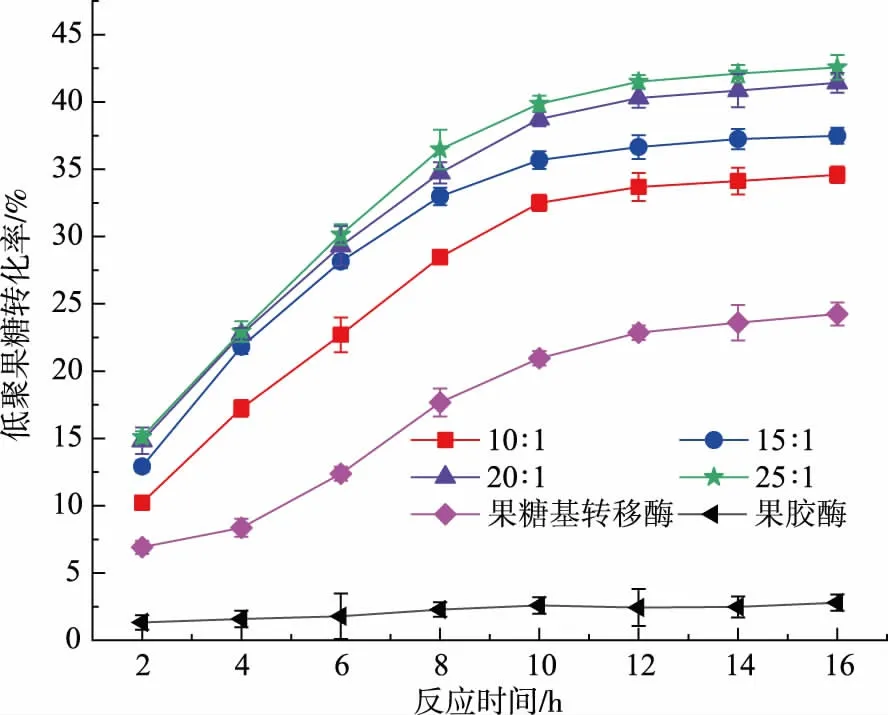
图1 果胶酶与果糖基转移酶不同添加比例对低聚果糖转化率的影响Fig.1 Effects of different ratio of pectinase to FTase on recovery of FOS
2.3 反应温度对FOS转化率的影响
温度过高会使维持酶蛋白空间构象的次级键发生断裂从而导致酶变性失活,温度太低则导致酶的转化率降低[14]。考虑到果胶酶和果糖基转移酶的最适反应温度,研究了反应温度对FOS转化率的影响。由图2可知,随着反应温度从40℃升至55℃时,FOS的转化率逐渐升高,最高达35%。而随着温度进一步升高至60℃,FOS的转化率有所下降。由此表明,酶反应的最佳温度为55℃。当温度低于55℃时,反应速率受到影响,当高于55℃时,由于酶的部分失活,产物的合成受到抑制,这也反映出酶的稳定性与温度呈一定的相关性[15]。Zhang[8]的研究结果表明,温度对FOS的产量有显著影响,发酵温度为30℃时FOS产量达到最高,而升至35℃后,FOS的产量就下降了22%。
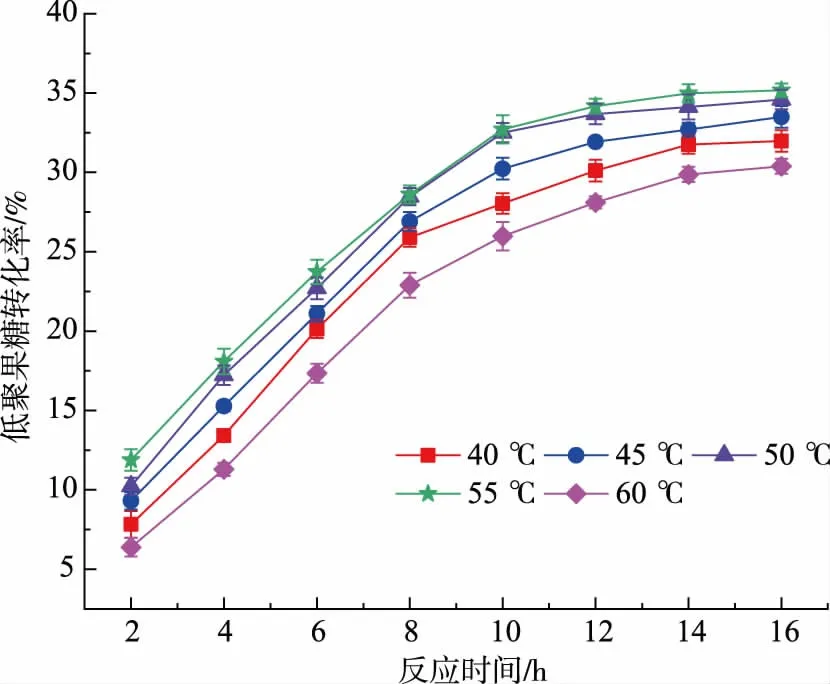
图2 不同反应温度对低聚果糖转化率的影响Fig.2 Effects of temperatures on recovery of FOS
2.4 反应pH对FOS转化率的影响
反应液的pH会影响酶和底物带电情况,从而影响酶和底物的解离和结合。因此,研究了酶反应的pH对低聚果糖转化率的影响,最终确定最适反应pH。由图3可知,pH<5.0时,过酸的反应体系导致酶活力大幅度下降,因此FOS的转化率也相应降低。同时,pH为6.0的反应环境对酶活力也有一定的影响,对生产高转化率的FOS并无提高作用。因此,确定该反应的最适宜pH为5.0~5.5,这与Mouelhi等[16]的实验结果相符。
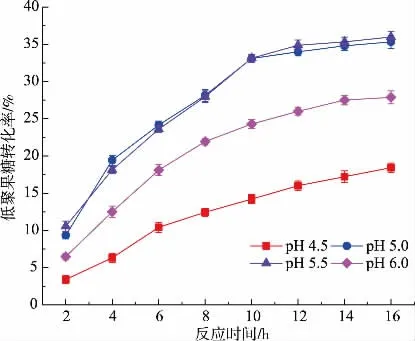
图3 不同反应p H对低聚果糖转化率的影响Fig.3 Effects of p H on recovery of FOS
2.5 反应过程中黏度变化
流体黏度是液体流动时不同速度层分子间的动量传递及分子间引力作用所产生的内摩擦的表现,与流体内部的微观分子作用有关[17]。在反应温度55℃、pH 5.5的条件下,调节果胶酶和果糖基转移酶的体积比在最适条件下,测定不同反应时间下溶液黏度的变化。由图4可知,在反应初期,酶解液的黏度仍有2.9 mPa·s,随着反应时间的延长,酶解液的黏度下降较快,当反应8 h后,反应体系黏度变化趋势变缓,并趋于一个定值,其中一个原因是果胶酶的存在引起这一现象的发生[18]。可溶性树胶作为糖蜜的成分之一,由于两者之间的相互结合,形成一种相对稳定的可溶性状态液体。果胶酶可以通过降解其中的果胶物质破坏其混合胶体的结构,使其转变为不可溶状态,此时体系黏度则呈现较大幅度下降[19]。由反应进程可知,体系黏度的下降更易于酶反应的进行,传质状况良好,使得反应过程中酶解液中FOS转化率上升。
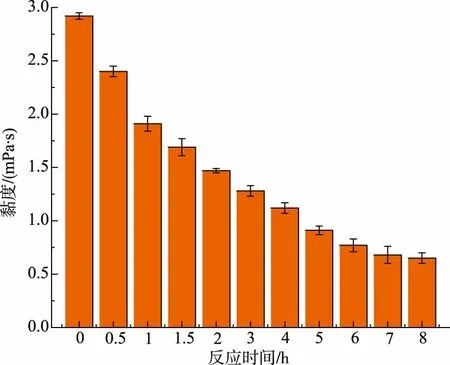
图4 不同时间下反应体系黏度的变化曲线Fig.4 Viscosity curve of reaction system under different times
2.6 FOS固体粉末成分分析
在上述研究所得的最优条件下反应制备所得的酶反应液,经冷冻干燥后得到饲料级FOS固体粉末,并对其成分进行分析,结果如表2所示。与原样品相比,经过酶反应后,蔗糖占总糖质量分数降低而低聚果糖占总糖质量分数升高,蛋白质质量分数与其他研究结果相似[20]。因此,所制备的FOS可以作为一种优质的无抗生素饲料资源。
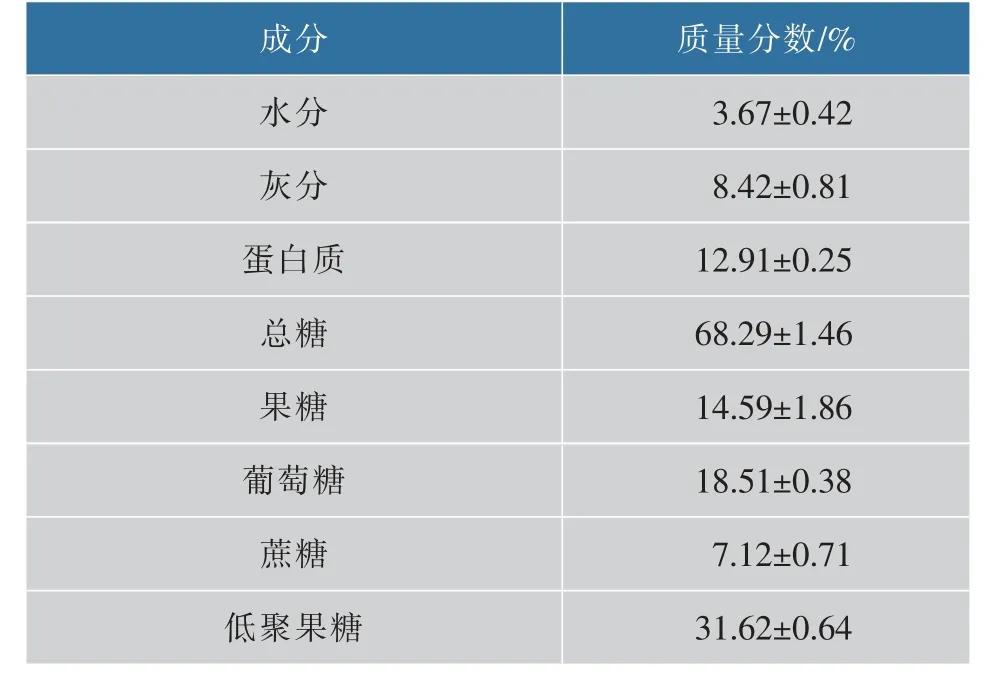
表2 FOS固体粉末成分分析Table 2 Composition analysis of FOSsolid powder
3 结语
为了提高糖蜜的加工价值,扩大其应用范围,作者利用果胶酶和果糖基转移酶的复合酶液,确定了酶解糖蜜生产FOS的最佳条件,并通过真空冷冻干燥制备低聚果糖固体粉末。该法的最优反应条件为果胶酶与果糖基转移酶体积比为20∶1、反应温度55℃、pH 5.5、酶解时间10 h,FOS转化率可达45%。干燥后的固态低聚果糖粉,比液态低聚果糖更利于运输,因而减少了运输成本,具有更广泛的应用范围;该固态低聚果糖可以作为食品和饲料的添加剂,具有优质的加工性能,从而提高制糖工业经济效益,为废弃物的进一步综合利用提供较好的途径,符合国家提倡的循环经济发展理念。
