肾脏疾病患者继发免疫缺陷与侵袭性肺曲霉病
2021-09-18许书添叶胜兵袁冬梅李世军
李 喆 罗 松 王 杨 许书添 叶胜兵 袁冬梅 李世军
侵袭性肺曲霉病(IPA)曾多见于以血液系统恶性肿瘤为代表的中性粒细胞缺乏人群[1],近年来慢性阻塞性肺疾病(COPD)[2]、糖尿病[3]、器官移植[4]等非中性粒细胞缺乏患者开始受到关注,来自重症监护病房(ICU)的研究认为肾功能不全、连续性肾脏替代治疗(CRRT)是IPA患者预后不佳的独立危险因素[5]。由于免疫抑制剂在慢性肾脏疾病(CKD)患者中的广泛应用,报道了狼疮性肾炎[6]、抗中性粒细胞胞质抗体(ANCA)相关性肾炎[7]、抗肾小球基膜病[8]等CKD继发免疫缺陷合并IPA的个案。目前针对CKD患者发生IPA尚无大样本的临床研究,各IPA指南均未关注CKD人群。本研究回顾性分析CKD患者治疗过程中诊断IPA的临床和影像学特征及预后,以期为CKD患者IPA的预防、早期识别、诊断和判断预后提供参考。
对象和方法
研究对象在国家肾脏疾病临床医学研究中心电子病历系统中,通过国际疾病分类ICD-10诊断编码检索出2009年1月至2020年1月诊断的CKD并发IPA患者。所有患者均符合KDIGO-CKD诊断标准。IPA诊断依据2019年欧洲癌症研究和治疗组织/侵袭性真菌感染协作组[9]以及2016年美国感染病学会[10]制定的诊断标准。根据宿主因素、临床及影像学表现、病理学和微生物学证据,将IPA分为确诊、临床诊断、拟诊3个级别。排除标准:(1)呼吸科医师重新评估,诊断证据不充分;(2)拟诊级别;(3)临床资料不完整。本研究最终纳入符合上述标准的患者46例(图1)。
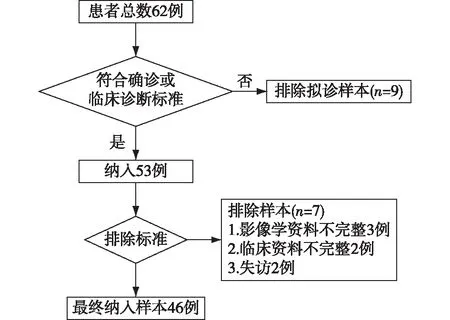
图1 慢性肾脏病合并侵袭性肺曲霉病患者筛选流程
临床资料及实验室指标记录患者的年龄,性别,曲霉感染的微生物学、病理学证据,肾脏病理,实验室指标,治疗方案。CT影像学特征由呼吸科和影像科医师共同评估。随访时间定为1年。
统计学方法数据分析使用《SPSS 20.0》软件,正态分布计量资料以均数±标准差表示,偏态分布计量资料以中位数(四分位间距)表示。根据数据是否符合正态分布,组间比较用t检验或Mann-Whiteny 非参数检验。以百分比表示计数资料,组间比较采用χ2检验或者Fisher精确检验。生存率利用Kaplan-Meier法分析,生存曲线间的差异比较用Log-Rank检验。采用单因素COX回归模型计算各个因素的风险比值(HR),并将单因素P<0.1的变量纳入多因素COX回归模型,以进一步明确独立预后因素。P<0.05为差异有统计学意义。
结 果
一般资料46例患者中男性27例(58.70%),IPA起病平均年龄52.15±16.53岁。出现IPA症状至诊断IPA中位时间16.52±10.77d。39例非肾移植患者CKD起病至诊断IPA中位时间7(2,38)个月。肾移植术后患者7例,肾移植术至诊断IPA中位时间89(11,168)个月。IPA起病时间春季(3~5月)5例,夏季(6~8月)10例,秋季(9~11月)6例,冬季(12~2月)25例。
基础疾病与危险因素43例曾接受肾活检,其中狼疮性肾炎8例,糖尿病肾病、移植肾慢性排斥反应各7例,ANCA相关性肾炎、膜性肾病、足细胞病各4例,IgA肾病3例,冷球蛋白血症肾损害2例,局灶节段性肾小球硬化、过敏性紫癜性肾炎、IgG4相关性肾病、流行性出血热肾损害各1例。41例接受免疫抑制剂治疗,其中泼尼松41例、吗替麦考酚酯14例、雷公藤多苷12例、他克莫司10例、环孢素8例、环磷酰胺5例、硫唑嘌呤和硼替佐米各1例。累计使用免疫抑制剂数目1种14例、2种12例、3种和4种各7例、5种1例。IPA传统危险因素中肾移植7例,60d内泼尼松剂量≥0.3 mg/kg持续≥3周37例,90d内使用T细胞免疫抑制剂22例,1例患者中性粒细胞数目<0.5×109个/L。非传统危险因素中糖尿病20例(2型糖尿病11例、类固醇性糖尿病9例),COPD 8例[11]。
IPA起病临床表现及实验室检查本研究患者39例痰培养、1例肺泡灌洗液(BALF)培养发现曲霉,8例血液、3例BALF、1例脑脊液通过宏基因组二代测序(mNGS)发现曲霉序列。3例行肺穿刺,显微镜下可见真菌菌丝(图2)。共确认烟曲霉20例,烟曲霉合并黄曲霉3例,黄曲霉合并米曲霉3例,黑曲霉2例,黄曲霉1例,余17例未明确曲霉种类。患者均送检血液真菌半乳甘露聚糖检测(GM试验),中位值为1.08(0.49,2.32),阳性率76.09%。血液真菌(1-3)-β-D葡聚糖检测(G试验)中位值113.30(24.54,263.63)pg/ml,阳性率63.04%。7例送检BALF真菌GM试验,中位值为5.71(1.90,17.29),阳性率100%(表1)。IPA时主诉症状见表2。最终IPA确诊4例,临床诊断42例。
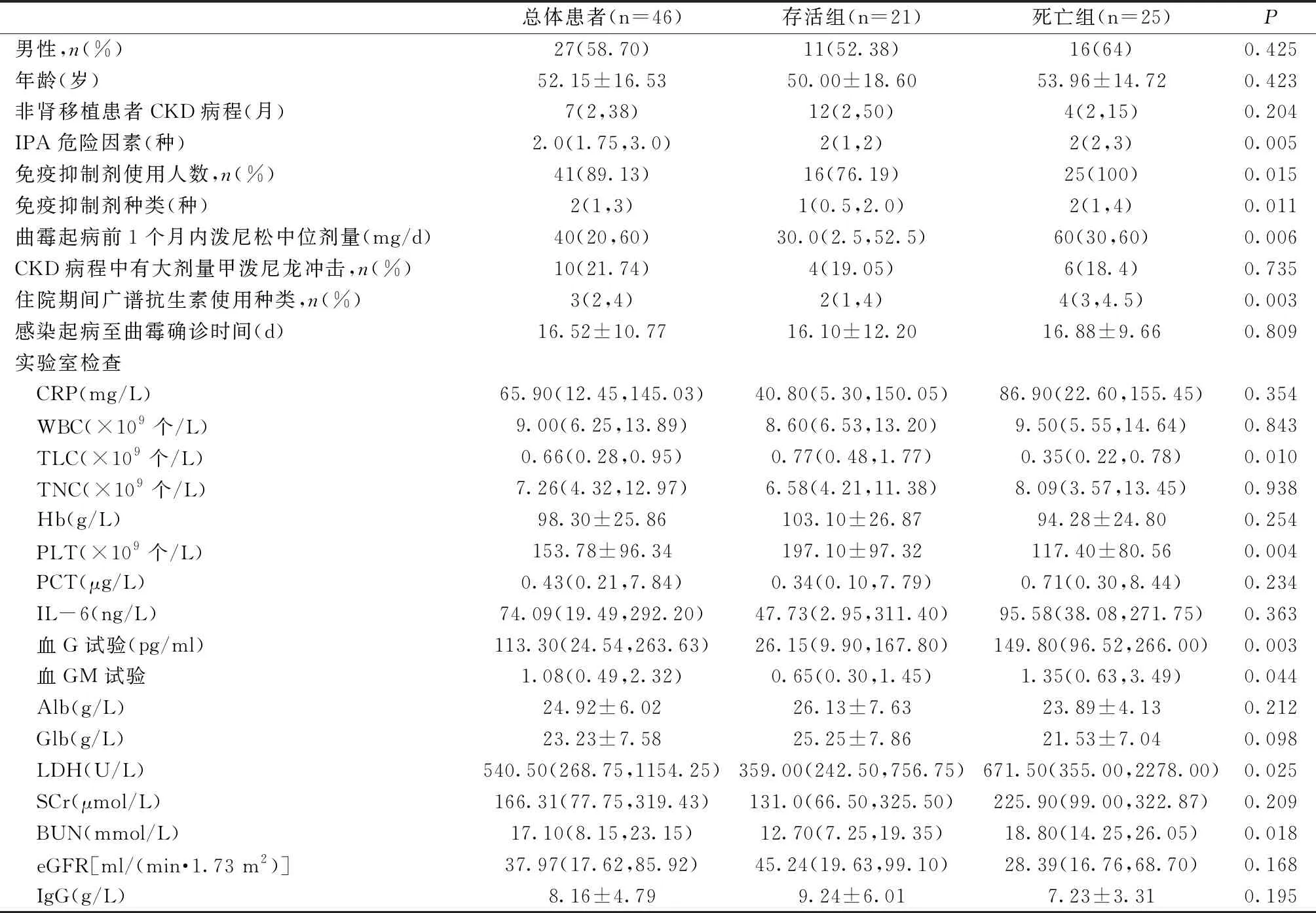
表1 CKD合并IPA患者的临床特征和实验室检查对比
胸部CT本研究患者均完善了胸部CT,最常见的影像学征象见表2和图3。以感染起病至IPA诊断时间进行分组,诊断时间>14d的患者胸部CT征象中沿支气管多发小结节影、空洞、晕轮征的比例较高(P<0.05)。
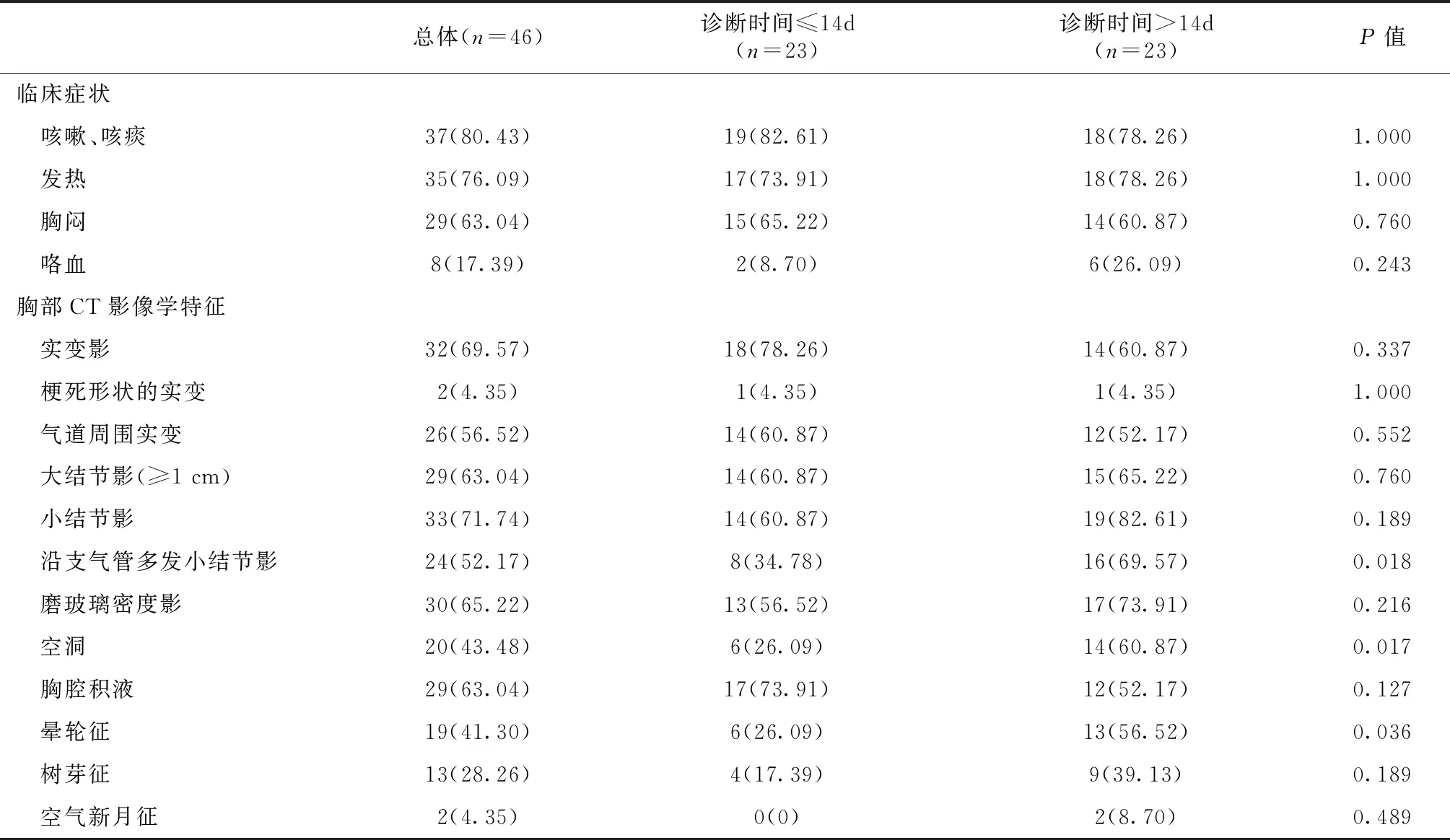
表2 CKD合并IPA患者临床症状和胸部CT征象对比
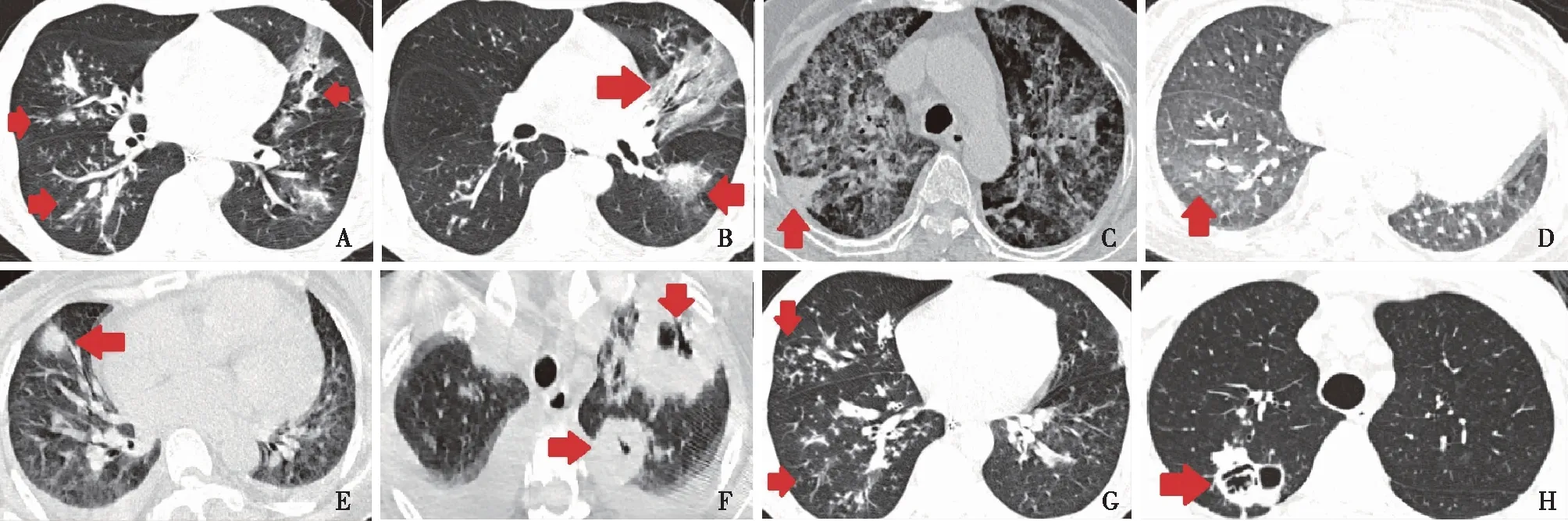
图3 CKD合并IPA患者的CT影像学表现
治疗及随访情况所有患者IPA起病前均未接受曲霉预防治疗。确诊IPA后治疗方案:伏立康唑15例,卡泊芬净7例,伏立康唑联合卡泊芬净21例,伏立康唑联合两性霉素B脂质体3例。住院期间使用其他广谱抗生素中位数为3(2,4)种。IPA救治期间接受CRRT 22例,血管活性药物20例,16例接受机械通气(其中无创4例,有创12例)。10例出现急性肝损伤。IPA起病30d死亡21例(45.65%),随访1年死亡25例(54.35%)。死亡组患者接受CRRT(64%vs28.57%,P=0.17)、血管活性药物(76%vs4.76%,P=0.000)、机械通气(56%vs9.52%,P=0.002)治疗的比例显著高于存活组。以IPA起病前1个月内泼尼松中位剂量进行分组,0 mg/d组累计死亡率为0;5~35 mg/d组累计死亡率50%;40~120 mg/d组累计死亡率68%,泼尼松40~120 mg/d组的预后明显差于0 mg/d组(Log-Rank检验χ2=5.495,P=0.019)(图4)。
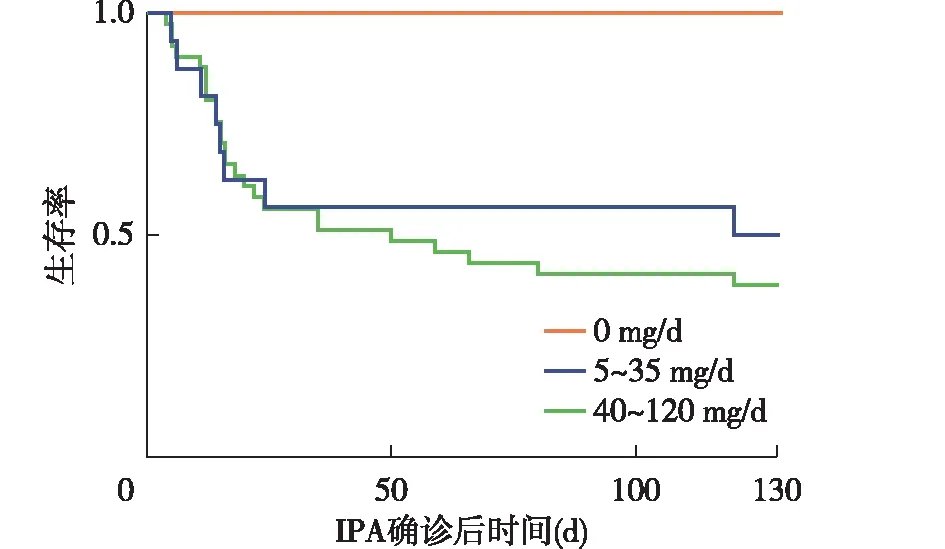
图4 本研究患者曲霉感染前1个月不同泼尼松剂量组的生存曲线对比
预后分析以随访1年内预后情况进行分组,发现死亡组患者IPA危险因素个数、IPA起病前1个月内泼尼松中位剂量、IPA救治期间血压下降需要血管活性药物、机械通气、广谱抗生素种类、血液真菌G试验值均显著高于存活组(P<0.01),IPA救治期间接受CRRT、免疫抑制剂使用人数和种类、血液真菌GM试验、乳酸脱氢酶(LDH)、血尿素氮(BUN)水平也高于存活组(P<0.05)。而血总淋巴细胞计数(TLC)和血小板数低于存活组(P<0.05)(表1)。单因素COX回归分析显示,IPA危险因素数目、IPA起病前1个月内泼尼松中位剂量、血压下降需要血管活性药物、机械通气、广谱抗生素种类、TLC、血小板数是CKD合并IPA患者死亡的危险因素。多因素COX模型发现,IPA起病前1个月内泼尼松中位剂量、IPA救治期间血压下降需要血管活性药物是CKD合并IPA患者死亡的独立危险因素(表3)。
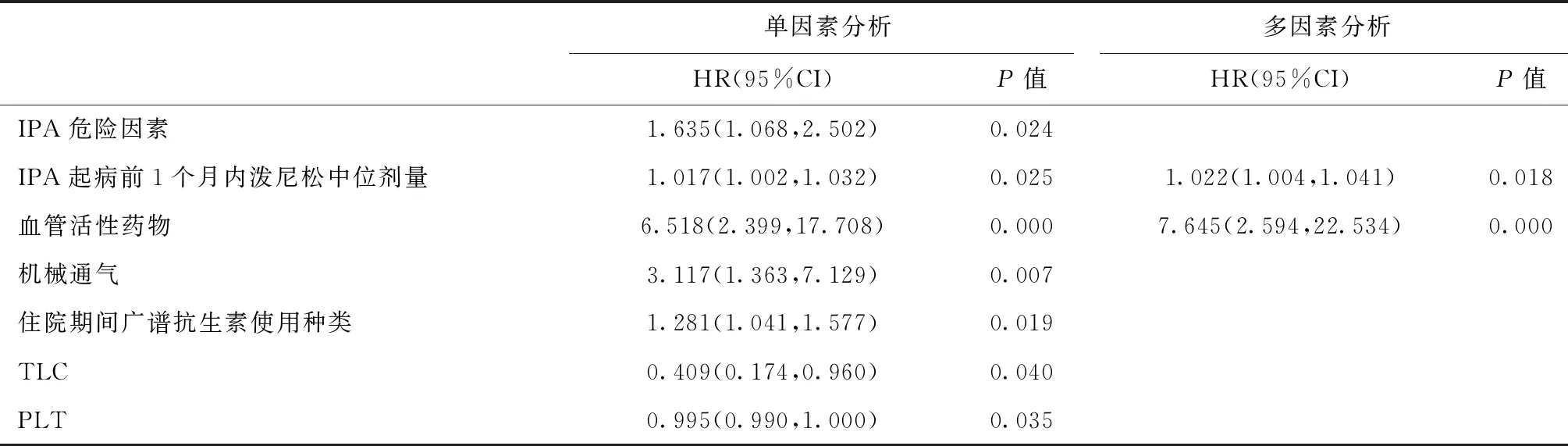
表3 COX回归分析影响CKD合并IPA患者死亡的危险因素
讨 论
曲霉广泛存在于自然界中,健康人群吸入曲霉孢子后,呼吸道上皮细胞和肺泡巨噬细胞构成固有防御,导致中性粒细胞募集和细胞免疫激活,促进分生孢子清除和继发炎症产生。当曲霉致病力增加或宿主免疫受损时,孢子转化为菌丝迅速生长,破坏上皮细胞,侵入肺组织和血管[12]。早年IPA主要见于血液系统恶性肿瘤化疗或造血干细胞移植(HSCT)后出现粒细胞缺乏症的患者。近年来随着实体器官移植广泛开展,广谱抗生素、糖皮质激素及免疫抑制剂应用增多,非粒细胞缺乏宿主IPA的发病率在0.33%~5.8%,呈逐年升高趋势[13]。本研究CKD合并IPA患者肾脏原发病的前三位原因是狼疮性肾炎、糖尿病肾病和肾移植术后,在国内外文献报道中尚属首次总结。
本研究发现,CKD患者IPA的传统危险因素为肾移植、糖皮质激素及免疫抑制剂应用,仅1例存在粒细胞缺乏症。欧洲多国参与的肾移植合并IPA病例对照研究发现,肾移植术后早期(前6个月)IPA的独立危险因素为COPD、急性排斥反应、移植肾功能延迟恢复、其他病原体的血流感染[4],而晚期(6个月后)IPA的独立危险因素是免疫抑制剂调整[14]。本研究7例肾移植受者均出现移植肾排斥反应,IPA起病前都调整了抗排斥方案,与上述研究结论一致。CKD患者长期应用糖皮质激素和其他免疫抑制剂,可抑制巨噬细胞、T细胞的活化增殖和分化存活,促进T细胞凋亡。进而抑制功能性T细胞应答,抑制巨噬细胞对曲霉的吞噬和杀灭作用[15]。同时体外实验表明糖皮质激素还能促进曲霉增殖[16]。本研究89.13%的CKD患者IPA起病前应用免疫抑制剂,中位免疫抑制种类为2(1,3)种,且糖皮质激素剂量与预后相关。
本研究发现,CKD患者IPA的非传统危险因素为合并糖尿病、COPD。长期高血糖的宿主,中性粒细胞趋化、吞噬、细胞内杀菌功能均减弱。高血糖的内环境适宜曲霉生长,血浆高渗透压也减弱了免疫细胞杀菌能力。同时糖尿病宿主的肺部微血管病变,使得肺通气/血流比例失调,局部组织缺氧导致抗感染能力减弱。上述因素均提高了糖尿病患者的曲霉易感性[17]。本研究CKD出现IPA的患者23.91%合并2型糖尿病,19.57%合并类固醇性糖尿病。提示CKD患者不仅要注意基础血糖水平,糖皮质激素治疗期间也需要监测血糖。CODP宿主长期雾化或全身应用糖皮质激素增加曲霉定殖,同时肺部结构性变化导致巨噬细胞清除呼吸道病原体的能力减弱。另外COPD急性加重期应用广谱抗生素时间长、种类多,使细菌不断被消灭,曲霉得以生长繁殖[2]。本研究发现,CKD出现IPA的患者17.39%合并COPD,提示免疫抑制剂治疗前需评估患者的基础肺功能,CKD合并COPD患者的肺部感染,需警惕IPA的可能。
IPA确诊需无菌术下取得标本培养结果,故确诊较困难,主要依赖临床诊断。尸检研究发现IPA是ICU死亡患者延误诊断的首要原因[18]。本研究CKD患者感染起病至IPA诊断时间为16.52±10.77d,仅8.7%达确诊标准。未达确诊标准者需根据宿主因素、临床及影像学表现、微生物学证据进行临床诊断。本研究发现,IPA特异性CT征象如沿支气管多发小结节影、空洞影和晕轮征出现均较晚,提示IPA影像学改变可能滞后于曲霉感染的非特异性临床症状。本研究发现CKD出现IPA时血液真菌GM试验阳性率76.09%,BALF真菌GM试验阳性率100%,上述检测手段为无法接受肺穿刺、肺泡灌洗的危重症CKD患者提供了快速诊断依据。本研究部分患者通过mNGS在血液、BALF、脑脊液中发现曲霉序列。但目前各IPA指南均未推荐mNGS用于诊断,国内专家共识建议对于新发、罕见、疑难感染性疾病以及免疫缺陷者,可作为一线检测手段[19]。需待相关研究验证其诊断价值。
本研究患者IPA起病时多见咳嗽、发热、胸闷等非特异性肺部感染症状,而咯血比例偏低,仅从临床表现与其他病原体肺部感染鉴别较困难。入院后临床医师可能早期经验性覆盖革兰阴性菌,多次调整抗菌药物疗效不佳。待IPA诊断后,亦会考虑细菌和曲霉复合感染可能,导致联合多种广谱抗生素。与粒细胞缺乏宿主的IPA主要以肺血管浸润和梗死为主不同,非粒细胞缺乏宿主的IPA以肺部炎性坏死多见,而血管浸润较少[20]。胸部CT最常见的影像学征象为沿支气管多发小结节影和气道周围实变,而晕轮征和空气新月征相对少见,提示CKD合并IPA是以气道侵袭性为主,而非血管侵袭性[21]。
IPA患者预后极差,近年来并无改善。在血液系统恶性肿瘤患者中,ICU病死率为58.4%,90d病死率为75.2%[1]。非粒细胞缺乏的IPA患者累计死亡率较粒细胞缺乏症患者高(89%vs60%,P<0.05)[22]。本研究显示CKD合并IPA患者30d死亡率45.65%,1年死亡率54.35%。患者预后与起病前糖皮质激素剂量以及是否因血压下降需要接受血管活性药物治疗独立相关,与其他人群的IPA研究结果一致。
本研究的局限不仅在于IPA大部分为临床诊断,确诊级别患者数偏少。同时单中心回顾性研究的样本量较小,缺乏CKD无感染患者对照,难以明确CKD患者IPA发病的独立相关因素,需待后续进一步研究。
小结:CKD发生IPA的患者临床症状及影像学表现均不典型,影像学表现以气道侵袭性为主,典型晕轮征出现时间较晚。感染高危因素包括肾移植、糖皮质激素及免疫抑制剂应用、合并糖尿病以及COPD。感染前大剂量使用泼尼松患者预后更差,需要综合多种检测方式及时诊断、抢先治疗、提高治愈率。
