膜性肾病相关靶抗原及自身抗体的研究进展
2021-09-18综述胡章学审校
李 昊 综述 胡章学 审校
膜性肾病(MN)是一类由免疫复合物(IC)介导的肾小球疾病,分为原发性(primary MN, PMN)与继发性(secondary MN, SMN)两类。其主要的病理特征为光镜下肾小球基膜(GBM)增厚,钉突形成,免疫荧光下可见免疫球蛋白(Ig)与补体呈颗粒状沉积,电镜下可见电子致密物沉积于上皮下[1]。IC的沉积引发补体激活,导致了足细胞损伤,增加了肾小球对血浆蛋白的通透性,可发生肾病综合征,部分患者可进展至终末期肾病(图1)。一项纳入了1980年~2010年相关研究的系统评价估计MN的发病率为1.2/100 000[2],在肾小球疾病中仅次于IgA肾病。我国的一项单中心流行病学调查发现相比于1979年~2002年,2003年~2014年肾脏疾病谱中MN占原发性肾小球肾炎的比例增高约1倍,且在14~24岁年龄段增幅最大[3]。
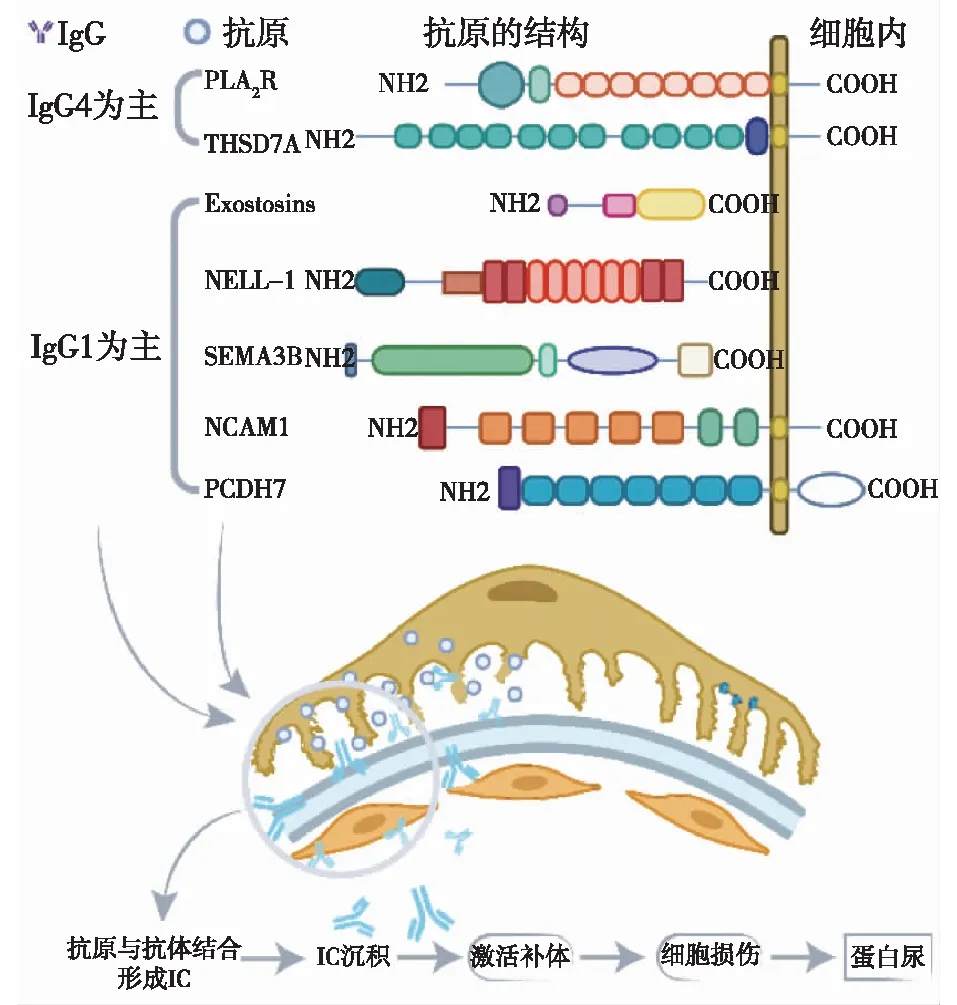
图1 不同靶抗原相关膜性肾病的致病机制
原位存在或定植于足细胞上的抗原与自身抗体结合形成IC于原位沉积是MN发病的关键环节。MN相关的靶抗原及自身抗体的研究始于1959年的Heymann肾炎模型[4],及其之后中性内肽酶(NEP)的研究[5],都为足细胞上的抗原可以作为循环抗体的靶点提供了依据。直至2009年,Beck等[6]的研究确认了M型磷脂酶A2受体(M-type phospholipase A2receptor,PLA2R)是大多数MN患者的靶抗原,为寻找MN相关靶抗原的研究掀开了新的篇章。之后,一系列新的靶抗原相继被鉴定发现,这包括了超氧化物歧化酶2(superoxide dismutase 2, SOD2)、醛糖还原酶(aldose reductase,AR)、α-烯醇化酶(α-enolase,αENO)、阳离子牛血清白蛋白(cationic bovine serum albumin, C-BSA)、卵磷脂-胆固醇酰基转移酶(lecithin:cholesterol acyltransferase,LCAT)、1型血小板反应蛋白7A域(thrombospondin type-1 domain-containing 7A, THSD7A)、Exostosin1/Exostosin2(EXT1/EXT2)、神经表皮生长因子样蛋白1(neural epidermal growth factor-like 1protein, NELL-1)、信号素3B(semaphorin 3B, SEMA3B)、神经细胞粘附分子1(neural cell adhesion molecule1, NCAM1)、原钙粘蛋白7(protocadherin 7, PCDH7)等。其中,PLA2R、THSD7A相关的MN分别占PMN的70%~80%、1%~5%,仍有部分抗原未知[7]。本文将就MN相关靶抗原及自身抗体的研究与临床应用进展作一综述。
内源性靶抗原及自身抗体
Heymann肾炎模型是研究MN的经典动物模型,Lewis大鼠被注射大鼠的组织提取物后出现蛋白尿等肾病综合征的临床表现,组织学上有GBM增厚等表现[4]。1982年,致病的抗原被证实为megalin,这是一种跨膜蛋白,在足细胞小凹上与抗体原位结合[8-9]。虽然megalin并不存在于人体中,但是为研究MN提供了可行的思路。后续发现的与人MN相关的靶抗原可以按照是否起源于足细胞,分为内源性和外源性两大类。对主要的内源性抗原进行总结见表1。不同来源的抗原相关MN的临床特点有所不同,这主要是与原发病以及抗原本身的特点相关。

表1 膜性肾病相关的主要内源性靶抗原的特征
NEP NEP是第一个被发现的与人MN相关的足细胞来源的靶抗原。2002年,Debiec等[5]报道了1例十分罕见的病例,病例中的男婴在妊娠38周后出生,出生即伴少尿、大量蛋白尿及呼吸困难。患儿在4周龄时接受了肾穿刺活检,结果表明为严重的MN,大部分毛细血管簇塌陷,血管壁增厚,肾小管萎缩,并且所有小球都可见IgG和C3的沉积。母亲在孕期的血样与肾脏标本的反应性证实,Ig是在母体形成并通过胎盘进入胎儿血液循环,将母亲血清中IgG片段注射到模型动物体内会引起蛋白尿和肾小球内IC沉积。通过免疫沉淀反应,以及NEP与IgG、C5b-9的共定位,抗NEP自身抗体被认为是致病的抗体。患儿的母亲未发病是因为编码NEP的基因发生了突变,导致母亲缺少NEP[16]。
PLA2R
PLA2R的发现及动物模型构建 Beck等[6]于2009年从70%的PMN患者的肾小球蛋白提取物中鉴定出PLA2R,结合质谱分析确认了PLA2R作为靶抗原存在于沉积的IC中,分离并识别主要为IgG4亚型的抗PLA2R的自身抗体,与SMN或其他肾小球肾炎相比具有特异性。PLA2R是甘露糖受体家族中的一种Ⅰ型跨膜受体,在人肾脏中主要表达于足细胞表面,与分泌型PLA2结合。Debiec等[17]报道1例肾移植后MN复发的患者,移植肾和原有肾脏的肾小球沉积物中均有PLA2R抗原,患者血清中有抗PLA2R抗体。亦有抗PLA2R抗体阳性的终末期肾病患者在肾移植术后血清学抗体水平转阴,但随访出现移植肾MN复发,其血清抗PLA2R抗体又由阴转阳的报道[18]。这些报道均提示PLA2R抗体的致病性。但是由于大鼠或小鼠缺乏PLA2R的内源性表达,动物模型难以建立。2019年,Meyer-Schwesinger等[19]通过基因敲入的方法成功构建了PLA2R阳性的小鼠模型,PLA2R可以正常表达并且没有导致足突形态的紊乱,但在注射兔源抗PLA2R抗体后小鼠出现了蛋白尿及高胆固醇血症。组织学资料表明,两者形成了IC并沉积于上皮下,在沉积部位有补体系统激活且伴随着氧化应激的发生。这一动物模型为PLA2R作为靶抗原以及自身抗体与靶抗原结合的致病性提供了强有力的证据,为研究PLA2R相关的MN中足细胞损伤的分子机制开辟了新途径。
PLA2R相关自身抗体在临床诊断的应用 血清中PLA2R的循环抗体的检测具有良好的临床应用价值。一项Meta分析显示抗PLA2R抗体诊断MN的敏感度为78%,特异度为99%,阳性预测值与肾活检几乎相当[20]。2020年改善全球肾脏病预后组织(KDIGO)关于肾小球疾病的草案中提到了基于PLA2R抗体血清学结果的MN诊治策略,建议对于抗PLA2R抗体阳性且高风险以及阴性的患者再进行肾活检,从而选择治疗方案[21]。
预后评估 PLA2R的胞外部分包含了10个结构域,分别是N端的富含半胱氨酸结构域(cysteinerichdomain,CysR)、纤连蛋白Ⅱ型结构域(fibronectintypeⅡdomain,FnⅡ)和8个重复的C型凝集素结构域(C-typelectindomain, CTLD),体外实验发现自身抗体识别的优势抗原表位是CysR-FnⅡ-CTLD1的复合体部分[22]。CysR可能是最早被免疫系统识别的抗原表位,对其他结构域的识别发生在抗原表位扩散。有研究发现抗原表位扩展是肾脏预后不良的独立危险因素[23],在早期干预时应当考虑患者基线水平的抗原表位扩展情况。但是近期的一项前瞻性队列研究发现,所有PLA2R相关MN患者的自身抗体都能识别PLA2R全长的至少两个抗原区域,与患者预后相关的不是抗原表位识别谱的长度,而是患者血清中总抗PLA2R的自身抗体水平[24]。
抗原表位的扩展与临床预后的相关性仍然有争论,但是患者血清中自身抗体的水平已经明确与临床表现的严重程度以及预后相关。研究发现患者基线时血清抗PLA2R抗体水平越高,完全或部分缓解的可能性越低,PLA2R抗体水平是无法缓解的独立危险因素[25],并且治疗结束时患者血清学抗体水平可预测长期预后的结局,抗体阴性的患者持续缓解的比例明显高于抗体阳性者[26]。
THSD7ATHSD7A是继PLA2R之后发现的又一具有重要意义的靶抗原,它也是一种跨膜蛋白,分子量约250 kD。2014年,Tomas等[10]在抗PLA2R抗体阴性的MN队列共154例患者中识别出15例血清THSD7A循环抗体。在健康对照组的肾脏组织标本中THSD7A正常表达并与足细胞上的一种膜蛋白共定位,而抗THSD7A自身抗体阳性病例肾脏THSD7A染色明显增强。与PLA2R不同的是,THSD7A在人和小鼠足细胞均有表达,注射含有抗THSD7A自身抗体患者血清的小鼠中可成功诱导出蛋白尿以及MN的组织学特征性病变,从而证明了自身抗体的致病性[27]。
NELL-1,SEMA3B与PCDH7Sethi等[12-13,15]通过激光捕获显微切割技术(laser capture microdissection, LCM)联合质谱分析以及组织学技术先后于2019年、2020年及2021年报道了NELL-1、SEMA3B与PCDH7三种靶抗原。通过LCM联合质谱分析可以直接获得患者肾小球组织的蛋白质组学数据,是一种直接并能够深入探索的方法。与PLA2R和THSD7A不同的是,抗NELL-1与抗SEMA的自身抗体均以IgG1亚型为主,而不是IgG4。至于SEMA3B,在研究队列中倾向于在儿童MN患者中表达,特别是起病年龄<2岁的患者[13]。研究队列中PCDH7阳性的病例更多是老年人[15]。另外,PCDH7相关MN的病理切片染色提示其补体激活相对缺乏,部分患者自发缓解,这都需要进一步研究证实[28]。
EXT1/EXT2与NCAM1 EXT1/EXT2与NCAM1目前被认为是与自身免疫性疾病特别是Ⅴ型狼疮性肾炎(LN)相关的MN中的两种抗原[11,14]。其中NCAM1虽然表达于成人足细胞,但是在正常的肾脏组织标本中未见NCAM1的阳性染色结果。两个抗原中只有NCAM1被检出相应的自身抗体,而研究者并未通过免疫印迹的方法检测到循环中的抗EXT1/EXT2抗体,这增加了EXT1/EXT2作为靶抗原的不确定性,需要后续的研究进行判断。一项回顾性研究发现膜性LN的患者中,EXT1/EXT2阳性患者比阴性患者的肾脏慢性化改变更少,进展至终末期肾病的患者更少[29]。
其他内源性抗原除了上述抗原外,MN患者的肾脏中还有一些特殊的抗原,但是否作为靶抗原参与MN发病还需要进一步的研究。其中溶酶体膜蛋白2(lysosome membrane protein-2, LIMP-2)是通过尿微泡的蛋白质组学研究发现[30],PMN患者的尿微泡中LIMP-2是正常对照的2倍以上。病理学的证据也验证了这一结果,即PMN患者的LIMP-2在肾小球中表达上调,并且免疫荧光显示LIMP-2与IgG共定位。但是,LIMP-2阳性的肾小球并不全是IgG染色阳性,在患者的血清中也未能找到抗LIMP-2的自身抗体。也许LIMP-2表达上调是其他抗原表达的继发结果,或始动因素之一,具有作为生物标志物的价值,当然这还需要进一步验证。尿微泡的蛋白质组学与组织病理学的结合的方法是研究MN发病机制的新思路。早于LIMP-2发现的抗原还有SOD2、AR与αENO[31-32],与LIMP-2不同的是,血清中存在高滴度的抗AR、抗SOD2与抗αENO的自身抗体。这三种抗原均是存在于足细胞胞质中的蛋白质,其识别过程同样使用了LCM,这一技术为MN靶抗原的识别提供了强大的动力。但是关于这三种抗原的研究较少,没有动物模型可以证明其致病性。
外源性靶抗原
2011年,Debiec等[33]报道了由C-BSA诱发的罕见的儿童IMN,通过组织学技术在肾小球上皮下IC中检测到了C-BSA和IgG,且从沉积的IC中洗脱出的IgG对C-BSA具有特异性。患儿体内BSA的唯一来源是牛奶,提示外源性种植可能是MN的发病机制之一,也说明环境因素在MN的发病中可能起了一定的作用,可能还有其他食物成分作为抗原参与了MN的发病。
此外,MN常见的继发性原因,如乙肝等感染性疾病、重金属中毒等情况都有外源性抗原定植于肾小球而参与疾病发生发展。Takahashi等[34]报道抗LCAT抗体介导的LCAT缺乏和MN的患者,该患者除了出现LCAT缺乏肾脏表现,还出现膜性肾病样表现。免疫荧光证实了LCAT沿毛细血管袢呈颗粒状沉积,并且与IgG共定位。经过激素治疗缓解的患者肾脏的LCAT沉积也明显减少。这说明LCAT可能是引发MN的靶抗原之一。
小结:近年来MN靶抗原的大量发现以及不同抗原间差异化的临床表现深化了对人类MN发病机制的认识,为MN提供了新的基于分子水平的分类和治疗的依据。MN抗原谱的完善将极大的改变目前MN的诊断、分类和治疗实践,具有重要的临床意义[35]。
