miR-7-5p和miR-152-3p联合调控Wnt/β-catenin通路对乳腺癌细胞上皮-间质转化及化疗耐药的影响
2021-09-06张哲莹朱会芳贺国洋韩正华原志庆王凡平王明永
李 娜,张哲莹,朱会芳,贺国洋,韩正华,原志庆,王凡平,王明永
文献报道显示,乳腺癌耐药形成过程是一个多元而复杂的过程,除了与基因的调控有关外,还与信号通路的调控密切相关[1]。本课题组前期实验结果证实,miR-7-5p和miR-152-3p可通过协同抑制乳腺癌耐药细胞的上皮-间质转化(epithelial-mesenchymal transition, EMT)进程,降低乳腺癌紫杉醇耐药性,但其具体的分子机制尚不清楚。β-catenin是Wnt/β-catenin信号通路的核心因子,游离的β-catenin进入细胞核可与兔抗人T细胞因子4(T cell factor 4, TCF4)结合形成复合物,进而影响下游靶基因的异常转录,促进肿瘤的发生[2]。本实验通过生物信息学软件预测发现,miR-7-5p和miR-152-3p均与TCF4 3′UTR区域存在互补的结合位点,猜测miR-7-5p和miR-152-3p可能通过共同靶向TCF4介导Wnt/β-catenin信号通路参与乳腺癌细胞紫杉醇耐药的形成。因此,进一步探讨miR-7-5p和miR-152-3p协同抑制乳腺癌细胞EMT进程及紫杉醇耐药的分子机制是否与共同调控Wnt/β-catenin信号通路有关,以揭示miR-7-5p和miR-152-3p调控乳腺癌紫杉醇耐药形成的可能机制。
1 材料与方法
1.1 主要试剂及细胞株Wnt/β-catenin信号通路激活剂LiCl购于天津市光复精细化工研究所。兔抗人TCF4单克隆抗体购于上海煊翎生物公司。兔抗人β-catenin单克隆抗体购于美国Cell Signaling公司,荧光素酶活性检测试剂盒购于美国Promega公司,乳腺癌MCF-7细胞株由本实验室保存,MCF-7/TAX细胞株购于上海和序生物公司。
1.2 方法
1.2.1细胞转染及处理 将对数生长期的MCF-7/TAX细胞以每孔106个接种至6孔细胞板上,置于细胞培养箱中常规培养。将细胞分为NC组(转染阴性对照)、miR-7-5p组(转染miR-7-5p mimics)、miR-152-3p组(转染miR-152-3p mimics)和miR-7-5p/152-3p组(共转染miR-7-5p和miR-152-3p)。根据上述分组进行转染,转染48 h后,采用Western blot法检测各组细胞中Wnt/β-catenin信号通路相关蛋白β-catenin和TCF4的表达情况。将长势良好处于对数生长期的miR-7-5p组、miR-152-3p组、miR-7-5p/152-3p组细胞分别接种至2个96孔细胞板上,一板细胞未做处理,另一板细胞分别给予20 mmol/L LiCl处理,并分别记为miR-7-5p+LiCl组、miR-152-3p+LiCl组、miR-7-5p/152-3p+LiCl组,采用Western blot法检测细胞中β-catenin、TCF4、E-cadherin和vimentin蛋白的表达,Transwell小室实验检测细胞侵袭和迁移,MTT实验检测乳腺癌细胞紫杉醇耐药性。
1.2.2双荧光素酶报告基因实验检测miR-7-5p和miR-152-3p与TCF4的靶向关系 将对数生长期的MCF-7/TAX细胞以每孔2×104个接种至6孔细胞板上后,常规培养。待细胞达75%左右汇合度时,参照脂质体2000说明书步骤将miR-7-5p mimics、miR-152-3p mimics及阴性对照分别与TCF4-WT、TCF4突变型(TCF4-MUT)共转染至MCF-7/TAX细胞中。转染48 h后,参照荧光素酶活性检测试剂盒说明书检测细胞的荧光素酶活性。
1.2.3Western blot法检测MCF-7/TAX细胞中β-catenin、TCF4、E-cadherin和vimentin蛋白的表达 各组细胞的总蛋白按试剂盒要求进行提取,总蛋白用BCA法进行定量。蛋白上清经SDS-聚丙烯酰氨凝胶电泳后转移至硝酸纤维素膜,用TBST封闭1.5 h,一抗于4 ℃孵育过夜,按照ECL试剂盒说明书进行操作,X线片曝光、显影、定影。GAPDH作为内参,采用凝胶成像分析系统以目的条带灰度值与内参条带灰度值的比值表示目的蛋白的相对表达量。
1.2.4Transwell小室实验检测MCF-7/TAX细胞的侵袭和迁移 实验前1天,以无血清的RPMI-1640培养基制备浓度为5 mg/mL Matrigel基质胶,将胶平铺到Transwell小室的底部,室温下自然凝固。加入无血清RPMI-1640培养基水化基膜30 min。取细胞悬液200 μL加入Transwell小室的上室中,并加入含10%胎牛血清的培养液600 μL,培养24 h后,取出小室,小心拭去上层小室内残留的细胞,分别以4%多聚甲醛和5%结晶紫固定、染色各15 min。洗出染色液后,采用倒置显微镜观察各组中的穿膜细胞数,结果以随机选取3个视野内细胞数的均值表示。
1.2.5MTT法检测MCF-7/TAX乳腺癌细胞紫杉醇耐药性 将长势良好的对数生长期的各组细胞以每孔105个接种至96孔细胞板上后,置于细胞培养箱中常规培养过夜。加入终浓度为0、20、40、60、80和100 μmol/L紫杉醇处理48 h。弃上清液后,加入20 μL浓度为5 g/L MTT溶液孵育4 h。加入150 μL DMSO溶液震荡反应至MTT结晶重复溶解。采用酶标仪在490 nm波长处检测各组细胞的光密度值。
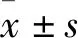
2 结果
2.1 miR-7-5p和miR-152-3p与TCF4的靶向关系采用Targetscan软件对miR-7-5p及miR-152-3p的靶基因进行预测,TCF4 3′UTR区域存在能够与miR-7-5p及miR-152-3p互补的结合位点(图1A)。结合相关资料,最终将TCF4作为研究对象,双荧光素酶报告基因实验结果显示,与NC组相比,转染miR-7-5p mimics和miR-152-3p mimics可使TCF4-WT报告基因载体的荧光素酶活性明显降低(P<0.05,图1B);但两者对TCF4-MUT报告基因载体的荧光素酶活性无明显影响(P>0.05)。

图1 miR-7-5p和miR-152-3p与TCF4靶向关系的验证:A.Targetscan软件分析miR-7-5p和miR-152-3p与TCF4 3′UTR的结合位点;B.转染miR-7-5p mimics和miR-152-3p mimics后细胞的荧光素酶活性;与NC组相比,*P<0.05
2.2 miR-7-5p和miR-152-3p对MCF-7/TAX细胞中Wnt/β-catenin信号通路的影响Western blot法检测结果显示,转染miR-7-5p mimics和miR-152-3p mimics后MCF-7/TAX细胞中Wnt/β-catenin信号通路关键因子β-catenin和TCF4蛋白的表达水平较NC组明显降低(P<0.05),且共同转染miR-7-5p mimics和miR-152-3p mimics后MCF-7/TAX细胞中β-catenin和TCF4蛋白的表达水平较miR-7-5p组或miR-152-3p组进一步降低(P<0.05,图2)。

图2 miR-7-5p和miR-152-3p对MCF-7/TAX细胞中Wnt/β-catenin信号通路的影响:A.Western blot法检测β-catenin和TCF4蛋白的表达;B.β-catenin和TCF4蛋白相对表达量;与NC组相比,*P<0.05;与miR-7-5p组或miR-152-3p组相比,#P<0.05
2.3 激活Wnt/β-catenin信号通路对MCF-7/TAX细胞EMT进程的影响在转染miR-7-5p mimics和miR-152-3p mimics基础上给予Wnt/β-catenin信号通路激活剂LiCl处理MCF-7/TAX细胞后,Western blot法检测结果见图3,Transwell小室实验检测结果见图4和图5。与miR-7-5p组或miR-152-3p组或miR-7-5p/152-3p组相比,给予LiCl处理后MCF-7/TAX细胞中β-catenin、TCF4和vimentin蛋白的表达水平明显升高,而E-cadherin蛋白的表达水平明显降低,且MCF-7/TAX细胞侵袭和迁移能力明显增强(P<0.05)。

图3 激活Wnt/β-catenin信号通路对β-catenin、TCF4、E-cadherin和vimentin蛋白表达的影响:A.Western blot法检测β-catenin、TCF4、E-cadherin和vimentin蛋白的表达;B.β-catenin、TCF4、E-cadherin和vimentin蛋白的相对表达水平;1.miR-7-5p;2.miR-7-5p+LiCl;3.miR-152-3p;4.miR-152-3p+LiCl;5.miR-7-5p/152-3p;6.miR-7-5p/152-3p+LiCl; 与miR-7-5p组相比,*P<0.05;与miR-152-3p组相比,#P<0.05;与miR-7-5p/152-3p组相比,&P<0.05

图4 激活Wnt/β-catenin信号通路对MCF-7/TAX细胞侵袭能力的影响:A.Transwell小室实验检测MCF-7/TAX细胞侵袭结果;B.各组中侵袭细胞数;1.miR-7-5p;2.miR-7-5p+LiCl;3.miR-152-3p;4.miR-152-3p+LiCl;5.miR-7-5p/152-3p;6.miR-7-5p/152-3p+LiCl;与miR-7-5p组相比,*P<0.05;与miR-152-3p组相比,#P<0.05;与miR-7-5p/152-3p组相比,&P<0.05

图5 激活Wnt/β-catenin信号通路对MCF-7/TAX细胞迁移能力的影响:A.Transwell小室检测MCF-7/TAX细胞迁移结果;B.各组中迁移细胞数;1.miR-7-5p;2.miR-7-5p+LiCl;3.miR-152-3p;4.miR-152-3p+LiCl;5.miR-7-5p/152-3p;6.miR-7-5p/152-3p+LiCl; 与miR-7-5p组相比,*P<0.05;与miR-152-3p组相比,#P<0.05;与miR-7-5p/152-3p组相比,&P<0.05
2.4 激活Wnt/β-catenin信号通路对MCF-7/TAX乳腺癌细胞紫杉醇耐药性的影响在转染miR-7-5p mimics和miR-152-3p mimics基础上给予Wnt/β-catenin信号通路激活剂LiCl处理后,采用MTT法检测MCF-7/TAX细胞紫杉醇耐药性的变化。不同浓度紫杉醇作用下,miR-7-5p+LiCl组细胞增殖活力较miR-7-5p组明显升高;同时miR-152-3p+LiCl组和miR-7-5p/152-3p+LiCl组细胞的增殖活力较miR-152-3p组、miR-7-5p/152-3p组也均明显升高(P<0.05,图6)。

图6 激活Wnt/β-catenin信号通路对MCF-7/TAX乳腺癌细胞紫杉醇耐药性的影响:与miR-7-5p组相比,*P<0.05;与miR-152-3p组相比,#P<0.05;与miR-7-5p/152-3p组相比,&P<0.05
3 讨论
miRNA是一类内源性非编码小分子RNA,可通过降解或者抑制靶基因mRNA的翻译,在转录后水平对靶基因进行调控,影响细胞增殖、侵袭、迁移、EMT和耐药形成等,与乳腺癌的发生、发展密切相关[3]。Mansoori等[4]的研究结果指出,miR-142-3p可通过靶向调控BTB-CNC异体同源体1(Bach-1)的表达减少EMT相关蛋白的表达,抑制乳腺癌细胞增殖、侵袭和迁移。Yang等[5]指出,miR-125b可通过靶向调控轴突导向蛋白分子(Semaphorins 4C, Sema4C)表达抑制EMT表型逆转乳腺癌细胞紫杉醇耐药性。
除了与靶基因相互作用外,miRNA还可通过直接或间接调控相关信号通路的活化参与乳腺癌的发生、发展。Han等[6]的研究结果发现,异常高表达的miR-30d可通过靶向调控kruppel样因子11(kruppel-like factor 11, KLF11)和激活信号转导子与转录活化子3(signal transducer and activator of transcription 3, STAT3)信号通路的活化促进乳腺癌细胞增殖、侵袭、迁移能力和EMT进程。Li等[7]指出,miR-106b和miR-93通过靶向调控PTEN激活PI3K/AKT信号通路诱导乳腺癌细胞增殖、侵袭和迁移。Mohammadi-Yeganeh等[8]发现,miR-340可通过直接靶向调控Wnt信号通路抑制乳腺癌细胞侵袭和转移。Jiang等[9]报道,miR-100可通过直接靶向Wnt/β-catenin信号通路的受体卷曲蛋白8(frizzled homolog 8,FZD-8)表达并抑制Wnt/β-catenin信号通路的活化抑制乳腺癌细胞侵袭和迁移。
Wnt/β-catenin信号通路是细胞内经典Wnt通路,当受到信号刺激时,糖原合成激酶-3β(glucogen synthase kinase-3β, GSK-3β)失活,β-catenin在细胞质内过量积累,进入细胞核,β-catenin可通过与T细胞因子/淋巴样增强因子(T cell factor/lymphoid enhancer factor, TCF/LEF)结合,进而调控下游靶基因的转录,在细胞生长、发育和分化过程中发挥重要作用。Wnt/β-catenin信号通路在乳腺癌中异常激活,核内β-catenin活化可引起下游靶基因,如Cyclin D1、原癌基因c-myc、多药耐药基因MDR1和转移相关基因MMP-7等的表达,在乳腺癌发生、转移和耐药形成过程中发挥重要作用;抑制Wnt/β-catenin信号通路活化能够有效抑制乳腺癌细胞生长及对化疗药物耐药性,被认为是乳腺癌的潜在治疗靶点。
TCF4属于TCF/LEF家族成员,是Wnt信号通路的关键因子,在Wnt信号激活时,细胞质内过多的β-catenin进入细胞核,与TCF4结合形成复合物,使其丧失抑制作用,在促转录因子作用下,引起下游靶基因过度表达,促进包括结直肠癌、肝癌和胃癌等肿瘤的发生、发展。Huang等[10]在乳腺癌的研究中指出,TCF4是miR-591的靶基因,其表达上调可部分逆转miR-591对乳腺癌细胞增殖和侵袭的抑制作用。可见,TCF4在乳腺癌的发生、发展过程中亦发挥重要作用。此外,Hong等[11]在结直肠癌的研究中指出,TCF4可通过与E-cadherin转录抑制因子Slug结合介导EMT发生。Kendziorra等[12]研究指出,TCF4可能以β-catenin独立的方式参与直肠癌细胞对5-氟尿嘧啶化疗耐药。
本组前期实验已证实miR-7-5p和miR-152-3p联合可通过抑制乳腺癌耐药MCF-7/TAX的EMT进程降低乳腺癌细胞癌细胞紫杉醇耐药性,但其具体作用机制尚不明确。本实验采用生物信息学软件预测发现,miR-7-5p和miR-152-3p与TCF4 3′UTR均存在互补的结合位点,采用双荧光素素酶报告基因实验证实,TCF4是miR-7-5p和miR-152-3p的共同靶标。同时,Western blot法检测结果发现,miR-7-5p和miR-152-3p表达上调均可引起Wnt/β-catenin信号通路关键因子β-catenin、TCF4蛋白表达下调,且两者联合具有协同作用。同时,给予Wnt/β-catenin信号通路激活剂处理后,miR-7-5p和miR-152-3p及两者联合上调对乳腺癌耐药MCF-7/TAX的EMT进程及紫杉醇耐药性的抑制作用明显减弱。这提示,miR-7-5p和miR-152-3p可能通过联合靶向调控TCF4使β-catenin/TCF4复合物减少,Wnt/β-catenin信号通路的活化受到抑制,从而使乳腺癌耐药细胞株EMT进程及紫杉醇耐药性减弱。
综上所述,TCF4是miR-7-5p和miR-152-3p的共同靶标,miR-7-5p和miR-152-3p联合可通过降低TCF4表达抑制Wnt/β-catenin信号通路的活化,进而抑制乳腺癌耐药MCF-7/TAX细胞株EMT进程,降低对紫杉醇的耐药性。该结果从细胞水平上初步阐述了miR-7-5p和miR-152-3p联合抑制乳腺癌耐药MCF-7/TAX细胞株EMT进程及紫杉醇耐药性与Wnt/β-catenin信号通路有关,后期将从体内动物水平上进一步阐述,以期为miR-7-5p和miR-152-3p有望成为改善乳腺癌紫杉醇耐药性的靶标提供参考依据。
