HIV低病毒血症对艾滋病抗病毒治疗病毒学失败的影响
2021-09-03安靓劳云飞唐松源
安靓 劳云飞 唐松源
1云南省传染病医院/云南省艾滋病关爱中心(昆明650301);2昆明医科大学(昆明650500)
艾滋病抗病毒治疗的目标之一是实现和维持HIV 病毒载量(viral load,VL)低于可检测下限。全球各地临床指南同时定义了病毒学失败的阈值,病毒学失败的患者会接受临床干预[1-4]。而处于检测下限到病毒学失败阈值之间的病毒载量结果通常被称为HIV 低病毒血症(low-level viraemia,LLV)。LLV 病例未达到“持续检测不到病毒=没有传染性”[5-7]的条件,有传播病毒的可能性,仍然是艾滋病的传染源。LLV 还可能增加病毒学失败的风险,增加死亡和严重非艾滋相关事件风险,导致增强的免疫激活与有害结果相关[8-10]。目前,云南省针对处于LLV 状态的患者的管理意见尚缺失。本文对云南省艾滋病抗病毒治疗动态队列进行观察回顾分析,观察不同水平和不同频率的低病毒血症与后续病毒学失败是否存在关联,为更好的管理低病毒血症病例提供依据,为相关政策制定者提供参考。
1 对象与方法
1.1 研究对象 2004-2018年在云南省定点机构接受艾滋病抗病毒治疗的HIV/AIDS 患者。排除标准:(1)开始治疗时年龄<15 岁或出生日期为空的病例;(2)从未做过VL 检测的病例;(3)开始治疗20 周后没有VL 检测的病例;(4)初始治疗方案不规范或为空的病例,如使用单药、两药方案、使用超出《国家免费艾滋病抗病毒药物治疗手册》[11]的自费药品方案、三药方案但错误配伍等。
1.2 方法 (1)从中国艾滋病综合防治数据信息管理系统抗病毒治疗模块下载历史卡片获得患者治疗基本情况、随访及VL 检测结果等。数据是由治疗定点机构专人根据真实的医学随访信息在随访发生后7 d 内上传。(2)2004-2011年检测仪器检测下限为<400 copies/mL,之后逐步换代为检测下限为<50 copies/mL 或<20 copies/mL 的仪器,2018年底全省有15家VL 检测实验室,其中11家使用德国罗氏公司COBAS AmpliPrep&COBAS Taqman48病毒载量仪(检测下限<20 copies/mL),其余4 家使用美国生物梅里埃公司NucliSens EasyQ Analyzer病毒载量检测仪(检测下限<50 copies/mL)。所有低于检测下限或Target Not Detected(TND)的结果录入为“0”,有具体数值的结果均按数值录入。(3)纳入分析的患者,按照治疗方案分为两个子队列进行观察:一线药物治疗子队列纳入条件:治疗方案以NNRTI 为基础的方案,即2 种NRTI+1 种NNRTI,且开始一线治疗20 周后至少有1 次VL结果;二线药物治疗子队列纳入条件:治疗方案以PI 为基础的方案,即2 种NRTI+1 种PI,且开始二线治疗后20 周后至少有1 次VL 结果;若某患者从一线药物更换为二线药物治疗,且两阶段分别符合两类子队列纳入条件,该患者两个不同治疗阶段分别纳入两个子队列中观察和分析。(4)低病毒血症定义为患者至少有1 次VL 结果在50~999 copies/mL之间。按数值水平分组:低51~199 copies/mL、中200~399 copies/mL、高400~999 copies/mL,有多次LLV 的病例,按数值最高的结果分组。按发生频率分组:单独一次、连续两次、间歇两次、连续多次、间歇多次。病毒学失败定义为至少一次病毒载量≥1 000 copies/mL。
1.3 统计学方法 多因素Cox 回归分析一线治疗队列(不含克立芝)和二线治疗队列(含克立芝)中,低病毒血症组与无低病毒血症组之间不同水平和不同频率的患者之间的风险比(HR)的差异。历史卡片载入R 3.5.0程序利用tidyverse和Data.table程序包进行数据整理,survival 程序包进行生存分析。全程以不包含患者身份识别信息的唯一的抗病毒治疗编码为主键进行分析。以P<0.05 为差异具有统计学意义。
2 结果
2.1 人口学特征 76 736 个病例纳入一线治疗子队列,中位随访了184 周184(94,305)周;17 208 个病例纳入二线治疗子队列,中位随访156 周156(78,256)周。一线治疗队列男性多,二线治疗队列女性多,两个队列均以已婚或同居、异性性传播为主。与一线治疗队列相比,二线治疗队列中病例开始治疗年龄更低(37 岁vs.34 岁)、开始治疗时CD4 计数相当(247 个/mLvs.253 个/mL)、治疗后CD4 涨幅更高(166 个/mLvs.204 个/mL)。
2.2 VL检测情况 从VL检测次数来看,两个队列病例做VL 检测的中位次数相当,均为3 次,一线治疗队列病例中最多做了23 次VL 检测,二线治疗队列病例中最多做了16 次VL 检测。
2.3 LLV 后病毒学失败的发生情况 一线治疗队列中,从未发生过LLV 病例病毒学失败的发生率是1.82/100(95%CI:1.76/100~1.88/100)人年,而发生了LLV 51 ~999 copies/mL 的病例VF 的发生率升高到2.49/100(95%CI:2.39/100~2.58/100)人年。其中,LLV 51 ~199 copies/mL 组病毒学失败发生率没有升高,LLV 200 ~399 copies/mL 组、LLV 400 ~999 copies/mL 组VF 发生率逐渐升高(表1)。
二线治疗队列中,从未发生过LLV 病例病毒学失败的发生率是2.13/100(95%CI:1.99/100 ~2.27/100)人年,而发生了LLV 51 ~999 copies/mL的病例VF 的发生率升高到2.90/100(95%CI:2.63/100 ~3.19/100)人年。其中,LLV 51 ~199 copies/mL 组病毒学失败发生率没有升高,LLV 200 ~399 copies/mL组、LLV 400 ~999 copies/mL 组病毒学失败发生率逐渐升高(表1)。
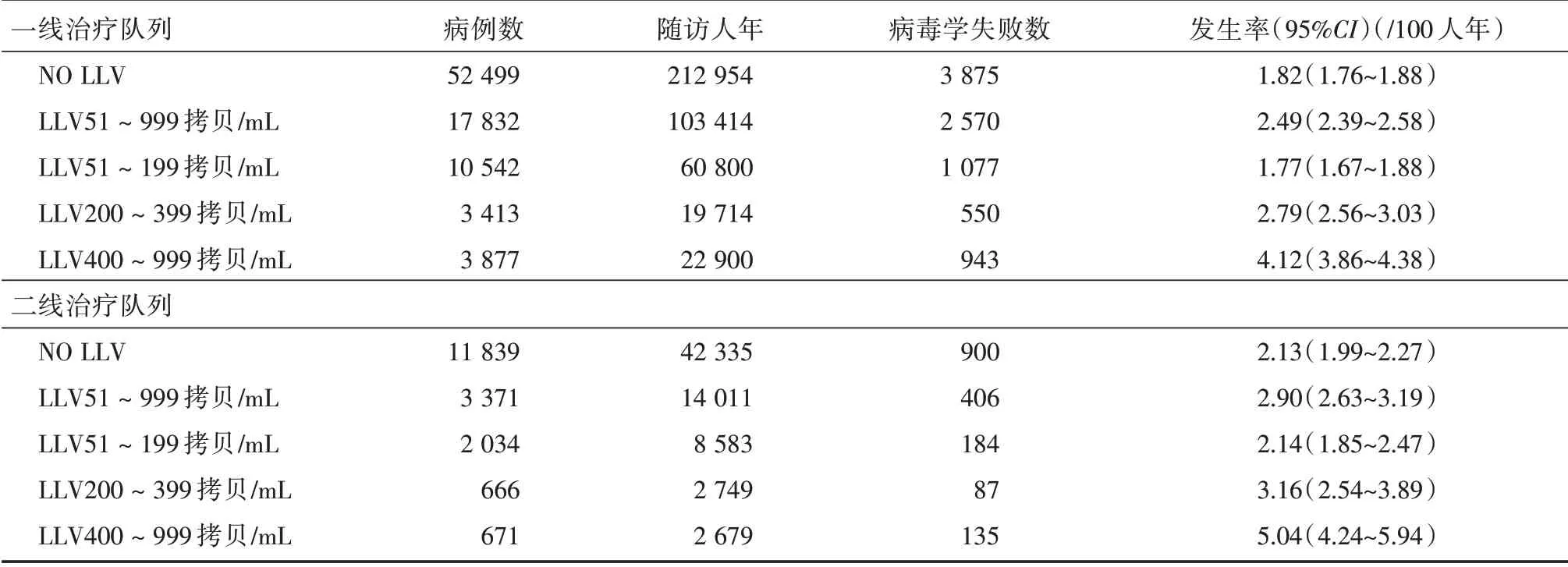
表1 不同数值水平LLV 后病毒学失败的发生率Tab.1 Incidence of VF after different numerical levels LLV
一线治疗队列中,与未发生过LLV 病例组相比,单独一次、连续两次、连续多次发生LLV 病例病毒学失败发生率逐渐升高,为2.61/100(95%CI:2.49/100 ~2.73/100)人年、2.80/100(95%CI:2.51/100 ~3.12/100)人年、3.50/100(95%CI:2.94/100 ~4.13/100)人年。而间隔发生LLV,即LLV 中间发生过VL <50 copies/mL 的病例病毒学失败发生率并没有升高(表2)。
二线治疗队列中,与未发生过LLV 病例组相比,单独一次、连续两次、连续多次发生LLV 病例VF 发生率较从未发生过LLV 病例都升高,分别为3.08/100(95%CI:2.76/100 ~3.42/100)人年、2.96/100(95%CI:2.15/100 ~3.97/100)人年、2.93/100(95%CI:1.42/100 ~5.33/100)人年。而间隔发生LLV组并没有升高(表2)。

表2 不同频率LLV 后病毒学失败的发生率Tab.2 Incidence of VF after different frequencies LLV
2.4 LLV 与病毒学失败的Cox 回归分析 一线治疗队列中,排除6 405 例首次VL 检测就发生病毒学失败、12 779 例仅有一次VL 结果和694 例随访不到1年的病例,有56 858 例病例纳入LLV 与病毒学失败Cox 比例风险回归分析。二线治疗队列中,排除1998 例首次VL 检测就发生病毒学失败、2 637 例仅有一次VL 结果和240 例随访不到一年的病例,有12 333 例病例纳入LLV 与病毒学失败Cox 比例风险回归分析。将性别、婚姻状况等6个变量纳入多因素Cox 比例风险回归分析。
2.4.1 按LLV 数值水平分组分析 LLV 数值水平分组与病毒学失败的多因素Cox 回归分析显示:一线治疗队列中,与从未发生过LLV 的病例相比较,50 ~199 copies/mL 组发生病毒学失败的风险没有变化,200 ~399 copies/mL 组提高到1.39 倍,400 ~999 copies/mL 组提高到2.02 倍。二线治疗队列趋势一致:与从未发生过LLV 的病例相比,50 ~199 copies/mL 组发生病毒学失败的风险没有变化,200 ~399 copies/mL 组提高到1.33 倍,400 ~999 copies/mL 组提高到2.26 倍(表3、图1)。
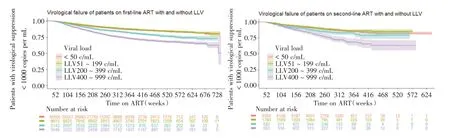
图1 发生与不发生LLV 病例病毒学失败发生的K-M 生存曲线Fig.1 K-M Survival curve of VF in cases with and without LLV

表3 低病毒血症数值水平分组与病毒学失败的COX 风险比例回归分析Tab.3 Cox Ratio Regression of the Grouping of Numeral Levels of LLV and VF
2.4.2 按LLV 发生频率分组分析 LLV 发生频率与病毒学失败的多因素COX回归分析显示:在一线治疗队列中,与从未发生LLV 的感染者相比,单独一次(HR=1.28,95%CI:1.21 ~1.36,P<0.001)、连续两次(HR=1.38,95%CI:1.22 ~1.55,P<0.001)、连续多次(HR=1.76,95%CI:1.48 ~2.10,P<0.001)发生LLV 的感染者发生病毒学失败的风险逐渐增加;在二线治疗队列中,与从未发生LLV 的感染者相比,单独一次(HR= 1.27,95%CI:1.11 ~1.46)、连续两次(HR=1.38,95%CI:1.02 ~1.88)发生LLV的感染者发生病毒学失败的风险在增加(表4)。

表4 低病毒血症发生频率分组与病毒学失败的COX 风险比例回归分析Tab.4 Cox risk ratio regression of frequency grouping of LLV and VF
3 讨论
3.1 中、高水平或单独、连续发生的LLV 是病毒学失败的预测因子 在对性别等8 个因素进行调整后,中、高水平LLV 与病毒学失败相关,单独发生或连续两次及以上的LLV 与病毒学失败相关,使病毒学失败风险升高至无LLV 组的1.28 ~2.26倍,是病毒学失败的预测因子。欧美的18个ART队列荟萃分析认为200 ~499 copies/mL的LLV与病毒学失败强烈相关,使其发生的风险增加至4 倍[12]。国外大部分类似的研究认为持续的LLV 使后续病毒学失败的风险升高至2 ~3 倍[13-16],认为持续的LLV 的存在不应仅仅归因于实验室变异和需要调查[15]。本研究结果与上述相似。但其他研究没有对单独一次LLV 对病毒学失败的影响进行研究或认为它们没有关联,而本研究认为单独一次LLV能使后续病毒学失败发生的风险增加27%,同时在发生LLV的病例中单独一次占比高达74.5%。因此,医生应该对发生一次200 ~999 copies/mL LLV的病例进行认真审视,采取干预措施。本研究还发现间隔发生的LLV 后续病毒学失败发生率无变化,两者不相关,可能的解释是间隔发生的LLV 更可能是检测偏差造成的。
3.2 建议病毒学失败阈值界定为VL ≥200 copies/mL 发生200 copies/mL 以下LLV 的病例后续病毒学失败发生率没有升高,发生200 copies/mL 以上LLV 的病例后续病毒学失败发生率和风险均增高。这一结论支持美国DHHS[3]、欧洲EACS[17]和中国艾滋病诊疗指南(2018年)[1]将病毒学失败阈值界定为≥200 copies/mL。建议WHO 指南(目前病毒学失败的阈值界定为≥1 000 copies/mL)[4]、《中国国家免费艾滋病抗病毒药物治疗手册》(目前要求VL ≥1 000 copies/mL才进行医学干预)[11]降低病毒学失败的阈值为VL ≥200 拷贝/mL,对目前忽略的200 ~1 000 copies/mL 的病例进行医学干预。
3.3 对云南省低病毒血症病例的管理建议 建议云南省不等待WHO 指南和《国家免费艾滋病抗病毒药物治疗手册》对病毒学失败阈值的调整,率先对发生一次200 ~999 copies/mL 的病例进行关注,将其纳入云南省艾滋病抗病毒治疗个案管理[18]。建议动员VL 检测结果为200 ~999 copies/mL 患者在采血日期后半年内尽快再次接受VL 检测以判断LLV是否连续发生和监测病毒学失败,若VL再次处于200 ~999 copies/mL 即LLV 连续发生,立即更换治疗方案。若VL >1 000 copies/mL即符合目前定义的病毒学失败,按现有建议进行医学干预,见图2。

图2 对云南省低病毒血症病例的管理建议Fig.2 Suggestions for the management of LLV in Yunnan
3.4 本研究的局限性 在研究设计时,仅将LLV按数值和发生频率分别分组,若能开展两者的交叉分组,得到更明晰的相关结果对干预对象的建议会更加明确;本研究是真实世界的观察研究,在纳入和排除病例时可能存在选择偏倚;全省做VL检测实验室多、操作人员多、检测质量良莠不齐,对结果可能有影响,应开展不同实验室相同研究的敏感性分析;由于资源有限,大部分病例每年只进行了一次VL 检测,检测频率较低对研究结果可能有一定的影响;本研究仅对有病载结果的病例进行了分析,而那些未进行VL 检测的病例情况不清,结果仅解释了纳入病例的情况,无法扩展。下一步应进行前瞻性队列研究以验证管理建议对病毒学失败识别的效果。
