TIMP2蛋白抑制TGF-β1诱导宫颈癌细胞EMT的过程
2021-09-02罗丽娜牟大英龚乾涛刘茂永
罗丽娜 牟大英 龚乾涛 刘茂永
(遵义市第一人民医院,贵州 遵义 563000)
宫颈癌是世界上第二种常见的妇科癌症,全球每年有52万新病例和27万人死亡。大约30%的宫颈癌患者不能通过手术、放疗或化疗改善结局〔1〕。越来越多的证据表明,上皮细胞间质化(EMT)在宫颈癌的发生中起着重要作用。EMT参与宫颈癌侵入和转移〔2〕,诱发癌症化学抗性和放射抗性〔3〕,并有免疫保护作用〔4〕。因此,探寻新的治疗手段来调节EMT过程可能为宫颈癌的治疗提供新思路。基质金属蛋白酶抑制剂(TIMPs)是基质金属蛋白酶(MMPs)家族的内源性抑制剂,两者形成非共价复合物从而抑制 MMPs 的活性,减少细胞外基质蛋白(ECM)的破坏,保持细胞之间连接的完整性,降低肿瘤的转移,改善预后〔5〕。研究表明,MMPs/TIMPs 的不平衡可能导致 ECM 降解或沉积从而影响肿瘤的侵袭和转移〔6〕。相比较 TIMPs 其他家族成员而言,TIMP-2 在多数正常成人组织间隙有大量表达,能特异性抑制 MMP-2的活性从而减少 ECM 的降解,降低癌细胞的迁移能力。临床病理证据表明TIMP-2 与肿瘤发展相关,例如在侵袭性胃癌及肾透明细胞癌的组织、食管癌和胃癌及非小细胞肺癌患者的血清中 TIMP-2表达水平均较低〔7〕。肿瘤组织中 TIMP-2 的表达水平较低,这可能与肿瘤的侵袭性增加有关;相反,上调 TIMP-2 的表达,能抑制肿瘤的生长及增强肿瘤对化疗药物的敏感性〔8〕。然而,TIMP-2通过调控EMT过程在宫颈癌的发生发展中发挥保护作用尚未阐明。因此,本研究建立宫颈癌细胞EMT模型,拟观察人源TIMP-2对TGF-β1诱导宫颈癌细胞(HeLa)EMT的影响及其可能的分子机制。
1 材料与方法
1.1主要试剂 钙黏附蛋白(E-cadhein)、波形蛋白(vimentin)、信号转导转录激活因子(STAT)3、蜗牛家族转录抑制因子(SNAIL)2、M2型丙酮酸激酶(PKM2)、p-p70s6k、β-actin抗体购自Cell Signaling Technology 公司;转化生长因子(TGF)-β1和人源TIMP2购自Sigma公司;CCK8购自同仁化学研究所;Annexin V-FITC/PI细胞凋亡检测试剂盒购自南京森贝伽生物科技有限公司;HeLa细胞购自上海然泰生物科技有限公司;雷帕霉素购自派普泰克生物科技(苏州)有限公司。
1.2方法
1.2.1细胞培养与处理 人宫颈癌细胞系HeLa培养于10%胎牛血清(FBS)和1%青霉素/链霉素37℃,95%空气和5%CO2培养箱中。实验分组:TGF-β1组为HeLa给予10 ng/ml TGF-β1处理,PBS组为HeLa给予体积PBS处理,1,5,10,15,25 μg/ml,TIMP2组为HeLa给予1,5,10,15,25 μg/ml TIMP2处理,TIMP2+TGF-β1组为HeLa同时给予25 μg/ml TIMP2和10 ng/ml TGF-β1处理,Rapa组为HeLa给予mTOR抑制剂雷帕霉素(Rapa)50 μmol/L 处理 Rapa+TGF-β1组为HeLa同时给予Rapa 50 μmol/L和10 ng/ml TGF-β1处理。倒置显微镜下观察细胞形态变化。
1.2.2细胞活力测定 通过CCK-8测定法检测细胞活力。细胞以1×104个细胞/孔接种到96孔板中,并在37℃下培养过夜。在24 h后接种,将指定浓度的TIMP2,同时给予TGF-β1处理,然后将细胞分别培养24、48和72 h。将CCK-8加入每个孔中,并在孵育1 h后,通过测定细胞活力测量转化染料在450 nm处的吸光度,重复3次。
1.2.3划痕实验 在完全培养基中培养细胞,使其生长至90%。使用2 ml移液器枪头进行划痕。 用PBS洗涤3次后,细胞为用含有10 ng/ml TGF-β1的新鲜无血清培养基培养,有或无TIMP2处理24 h。迁移率通过量化在24 h的划痕距离/0 h的划痕距离。所有实验重复3次。
1.2.4Annexin V-FITC/PI双染细胞凋亡检测方法 将细胞以4×105个细胞/孔接种在6孔板中,然后用TIMP2处理,同时给予10 ng/ml TGF-β1刺激24 h。具体实验步骤参照Annexin V-FITC/PI双染细胞凋亡试剂盒。
1.2.5Western印迹检测 收集处理后的细胞裂解后,检测E-cadhein、vimentin、STAT3、SNAIL2、PKM2、p-p70s6k的蛋白表达,将提取后的蛋白进行上样、电泳、转膜、封闭、洗膜、一抗4℃过夜孵育,用洗膜液漂洗后,二抗杂交1 h,清洗后加上化学发光剂(ECL)显色,上机检测。
1.3统计学方法 采用SPSS18.0 软件进行t检验、单因素方差分析。
2 结 果
2.1TGF-β1诱导宫颈癌细胞EMT TGF-β1组E-cadherin表达水平较PBS组明显下降,而波形蛋白表达较PBS组明显升高 (均P<0.05)。见图1,表1。

表1 HeLa细胞E-cadherin与Vimentin的蛋白表达水平

图1 TGF-β1诱导宫颈癌细胞对EMT标记蛋白表达
此外,HeLa细胞在TGF-β1刺激下都获得了纺锤体和成纤维细胞的形状,见图2。

图2 TGF-β1诱导宫颈癌细胞EMT(×400)
2.2TIMP2对HeLa细胞增殖,迁移,凋亡的影响 各剂量TIMP2组24~72 h细胞增殖能力均显著低于PBS组,且呈剂量依赖性(均P<0.05)。TGF-β1组24~72 h细胞增殖能力显著高于PBS组,而TIMP2+TGF-β1组显著低于TGF-β1组(均P<0.05)。见表2。TIMP2 (25 μg/ml)组24 h后细胞迁移指数(0.44±0.03)显著小于PBS组(0.65±0.06,P<0.05),TIMP2+TGF-β1组细胞迁移指数(0.52±0.03)显著小于TGF-β1组(0.81±0.03,P<0.05)。表明TIMP2能明显抑制TGF-β1诱导细胞迁移能力,见图3。TIMP2组细胞凋亡率〔(58.25±7.24)%〕显著高于PBS组〔(0.02±0.01)%,P<0.05〕,而TIMP2+TGF-β1组细胞凋亡率〔(41.35±4.33)%〕显著高于TGF-β1组〔(1.32±0.02)%,P<0.05〕。见图4。表明TIMP2能促进HeLa的凋亡,抑制增殖与迁移。

表2 TIMP2对Hela细胞增殖的影响
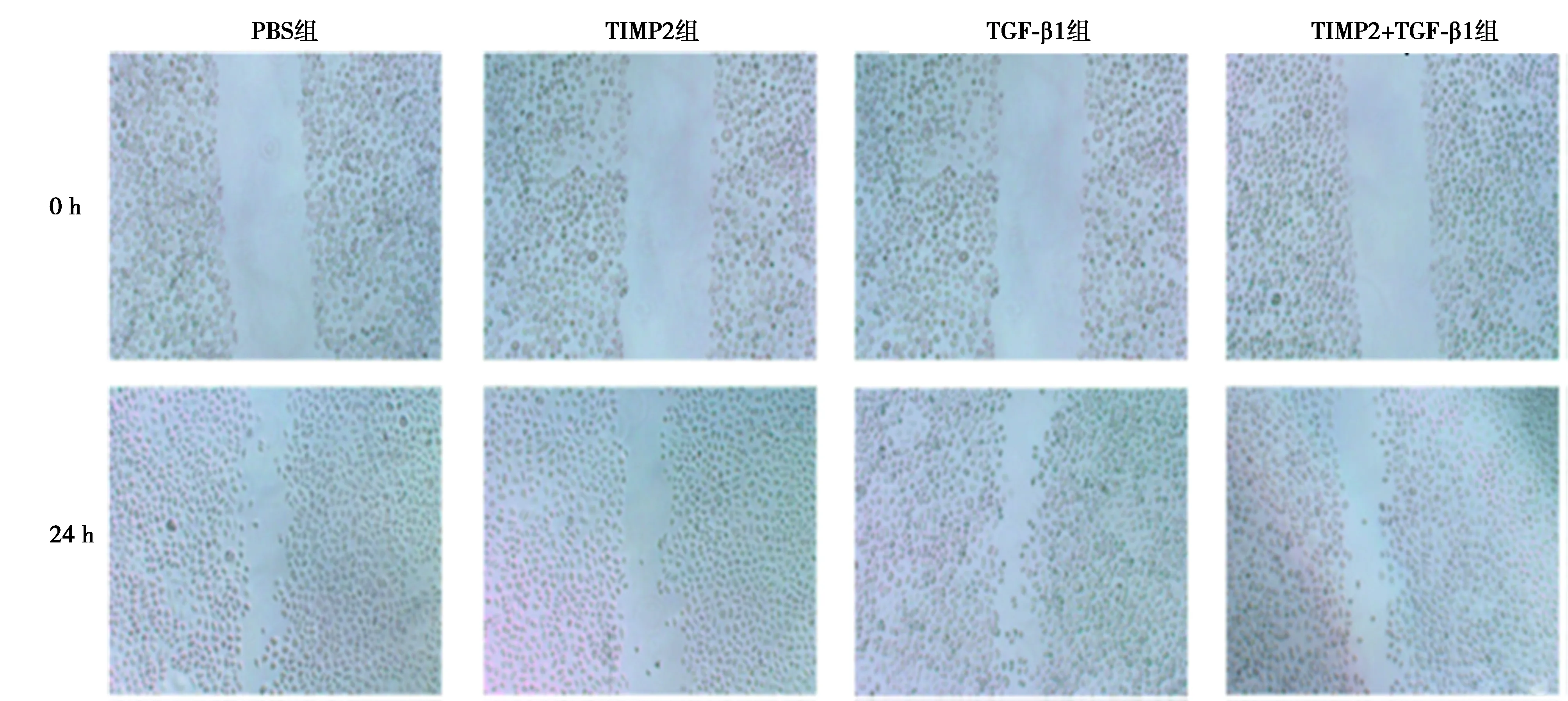
图3 TIMP2对HeLa细胞迁移的影响(×100)
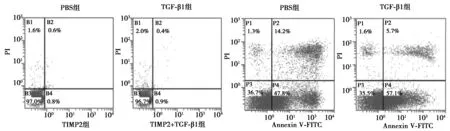
图4 TIMP2对HeLa细胞凋亡的影响
2.3mTOR/p70s6k信号通路对Hela细胞的作用 TGF-β1组PKM2和p70s6k水平(10.63±0.06、2.68±0.04)显著高于PBS组(4.12±0.03、1.95±0.06,P<0.05),表明TGF-β1促活化mTOR/p70s6k信号通路。Rapa+TGFβ1组PKM2和p70s6k水平(6.82±0.05、1.52±0.03)显著高于Rapa组(1.86±0.02、0.65±0.05,P<0.05),见图5。表明抑制mTOR途径显著降低HeLa中PKM2的表达和p70s6k的磷酸化。
2.4TIMP2对宫颈癌细胞EMT的作用及机制 TGF-β1组E-cadherin水平显著低于PBS组,而STAT3,SNAIL2,vimentin水平显著高于PBS组(P<0.05)。TIMP2组E-cadherin水平显著高于PBS组(P<0.05),而其他指标与PBS组比较无显著差异(P>0.05)。TIMP2+TGF-β1组E-cadherin水平显著高于TGF-β1组,而STAT3,SNAIL2,vimentin水平均显著低于TGF-β 组(P<0.05),见图6。表明TIMP2逆转了TGF-β1诱导的EMT标志物表达。同时TIMP2+TGF-β1组p70s6k和PKM2水平均显著低于TGF-β1组(P<0.05)。见表3。与TGF-β1组比较,TIMP2+TGF-β1组HeLa细胞形成纺锤体和成纤维细胞形态程度低,见图7。表明TIMP2处理完全阻断了TGF-β1诱导的EMT形态学改变,TIMP2通过调控mTOR/p70s6k信号通路来抑制TGFβ1诱导HeLa细胞EMT过程。

1~4:DMSO组,TGF-β1组,TGF-β1+Rapa组,Rapa组图5 mTOR/p70s6k信号通路对EMT的影响
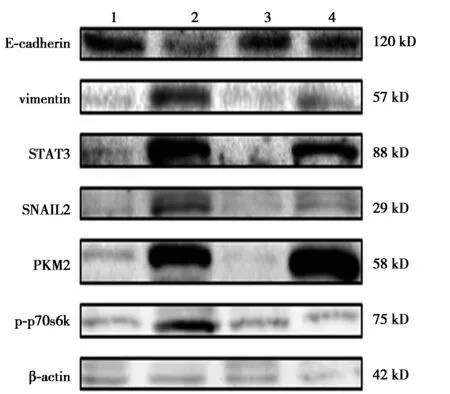
1~4:PBS组,TGF-β1组,TIMP2组,TIMP2TGF-β1组图6 TIMP2对宫颈癌细胞EMT的作用及机制

表3 TIMP2对HeLa细胞EMT及信号通路蛋白表达水平
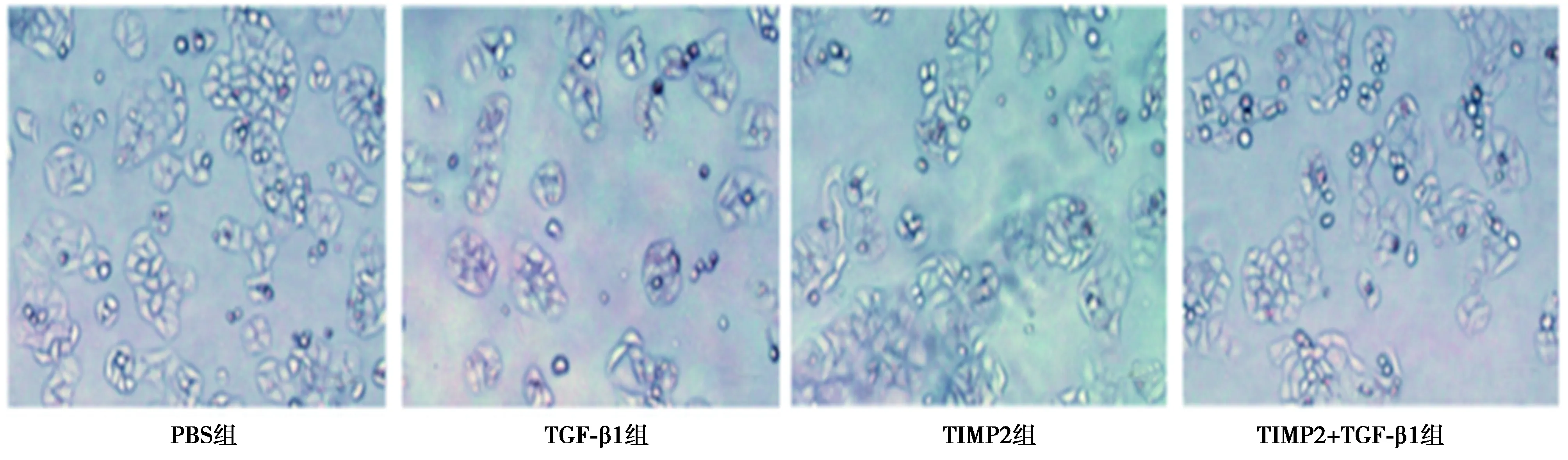
图7 TIMP2对宫颈癌细胞EMT形态学改变(×100)
3 讨 论
本研究结果表明TIMP2抑制TGF-β1诱导的EMT过程是通过宫颈癌细胞中mTOR/p70s6k/PKM2信号通路。在子宫内膜癌细胞系 HEC-1A 细胞中 miR-200b、胃癌细胞中 miR-106A、肾癌细胞中的 miR-221 均能通过调节 TIMP-2 表达水平影响肿瘤细胞增殖、迁移和侵袭〔9〕;在神经胶质瘤细胞中 miR221/222 能靶向调节 TIMP-2 水平进而影响细胞周期、细胞凋亡及血管的生成〔10〕。研究显示血清中高浓度TIMP-2有更好的临床预后,可能有助于癌症患者术后的监测和放化疗〔11〕。肿瘤的高死亡率主要与其自身的浸润和远处转移相关,因此,如今治疗策略的重点是抑制肿瘤的生长〔12〕,阻止癌细胞的侵袭和转移〔13〕。
本研究结果表明TIMP2对宫颈癌的潜在治疗意义。既往研究发现PKM2在癌症的EMT发展中起着至关重要的作用〔14〕。PKM2是mTOR诱导的Warburg效应中重要的糖酵解酶,其中缺氧诱导因子(HIF)-1α和c-Myc-hnRNP是mTOR调控PKM2的效应分子〔15〕。PKM2在小鼠肾肿瘤中表达显著增加,而被mTOR的激活所抑制〔13〕。这些研究提示mTOR/p70s6k信号传导与EMT相关。本研究表明PKM2和p70s6k参与EMT过程,TIMP2抑制了p70s6k和PKM2的磷酸化。
综上,TIMP2可通过抑制mTOR/p70s6k/PKM2信号通路抑制宫颈癌细胞EMT过程,表现为抑制细胞的增殖与迁移,促进肿瘤细胞凋亡。
