circRNA CDR1as靶向miR-876-5p调控肝癌细胞的增殖、迁移和侵袭
2021-09-02李沛李颖刘宇
李沛 李颖 刘宇
(南华大学附属第一医院 1检验科,湖南 衡阳 421001;2急诊科)
虽然针对肝癌的治疗研发水平不断提高,但其预后并未得到明显的好转,因此,开拓新的治疗方案具有重要意义〔1,2〕。环状RNA(circRNA)是一类长的非编码RNA分子,其形成共价闭合的连续环,不存在5′-3′极性且不含polyA尾。CircRNA在真核转录组中表达高度组织特异性〔3〕。最新研究发现,数千种内源性circRNA存在于哺乳动物细胞中,它们通过与微小RNA或其他分子结合,以抑制其功能,在转录或转录后水平调控基因的表达。此外,circRNA在多种类型的癌症中表现出异常表达,包括肝癌〔4〕,由此可见,circRNA是诊断或治疗肿瘤生物标志物的新希望。小脑退化相关蛋白1反义RNA (CDR1as)是一种致癌环状RNA,参与人类肿瘤的发生,其在肝癌中表达失调〔5,6〕,CDR1as在肝癌中作用的分子机制尚不清楚。miRNA作为circRNA的调控因子之一,其确实对circRNA的功能具有很大的作用。miR-876-5p在肝癌中发挥抑制癌症进一步恶化的作用〔7〕,但是其是否与CDR1as在肝癌中的功能具有相关性尚且未知。本研究拟以肝癌细胞为研究对象,检测其中CDR1as、miR-876-5p的表达,观察敲减CDR1as、过表达miR-876-5p对肝癌细胞增殖、迁移和侵袭的影响,揭示其机制可能与CDR1as靶向miR-876-5p有关,将为CDR1as在肝癌的诊断、治疗中的研究提供参考依据。
1 材料与方法
1.1材料 正常肝细胞L02和肝癌细胞Huh-7、Hep-3B均购自ATCC;实验动物SPF级BALB/C裸鼠(18~20 g)30只,购自湖南斯莱克实验生物有限公司,遵守实验动物管理和伦理委员会章程对动物进行饲养和相关实验;胎牛血清(FBS)购自杭州四季青;DMEM培养基购自美国Hyclone;CCK-8试剂盒购自美国Apexbio;LipofectamineTM2000、逆转录试剂盒、荧光定量试剂盒购自大连Takara公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司;Transwell小室购自美国Corning。
1.2方法
1.2.1细胞培养 将正常肝细胞L02和肝癌细胞Huh-7、Hep-3B,用含有10%FBS的DMEM培养基进行常规培养。
1.2.2细胞转染与分组 将正常肝细胞L02和肝癌细胞Huh-7、Hep-3B分别标记为L02组、Huh-7组、Hep-3B组;将培养24 h 的Huh-7随机分为si-NC组(转染si-NC)、si-CDR1as组(转染si-CDR1as)、miR-NC组(转染miR-NC)、miR-876-5p组(转染miR-876-5p mimics)、anti-miR-NC组(转染anti-miR-NC)、anti-miR-876-5p组(转染anti-miR-876-5p)、si-CDR1as+miR-NC组(共转染si-CDR1as和miR-NC)、si-CDR1as+miR-876-5p组(共转染si-CDR1as和miR-876-5p mimics),各组细胞用LipofectamineTM2000试剂盒说明要求操作进行转染,转染48 h后,用实时荧光定量-聚合酶链式反应(qRT-PCR)检测转染效率,转染成功后用于后续试验。
1.2.3qRT-PCR检测细胞中CDR1as、miR-876-5p的mRNA的相对表达水平 取充分研磨肿瘤组织或细胞,用Trizol法提取总RNA,使用微量核酸蛋白测定仪检测RNA浓度和纯度。调整RNA样品浓度,使用TaKaRa反转录试剂盒和荧光定量试剂盒分别将RNA反转录为cDNA,并配制反应体系,以U6为内参进行扩增。实验结果采用2-△△Ct法进行分析。引物信息如下:CDR1as:上游引物5′-GTGTCTCCAGTGTATCGGCG-3′,下游引物 5′-TACTGGCACCACTGGAAACC-3′;miR-876-5p:上游引物 5′-TGAAGTGCTGTGGATTTCTTTGTG-3′,下游引物 5′-TGAATTACTTTGTAAACCACCACCA-3′。
1.2.4CCK-8法检测细胞的增殖 调整细胞至1×105个/ml,取100 μl/孔接种至96孔板,37℃、5%CO2培养24 h。每组设5个重复,加入20 μl的CCK-8溶液,490 nm波长检测吸光度(OD490值)。细胞的增殖能力与细胞的吸光度呈正比。
1.2.5Transwell小室检测细胞的迁移和侵袭 通过Transwell小室检测细胞的迁移和侵袭,不同之处在于,检测细胞侵袭的小室的聚碳酸酯膜上表面需要铺有一层基质胶,模拟人体的细胞外基质,细胞需要消化基质后才能进行穿膜。操作方法为:首先将细胞用无血清培养基培养24 h,调整至5×105/ml,取100 μl加入小室上室的聚碳酸酯膜上,取600 μl含血清的培养基加入下室,将小室放在37℃、5%CO2的细胞培养箱中进行培养48 h,取出小室。用棉签小心擦去上室聚碳酸酯膜下表面的细胞,用甲醇固定,结晶紫染色,在显微镜下用400倍视野观察细胞的数量,取5个视野进行拍照计算,取平均值。
1.2.6双荧光素酶报告基因检测实验检测细胞的荧光活性 将含有CDR1as-WT(含CDR1as野生型片段)和CDR1as-MUT(含CDR1as突变体片段)克隆至pGL3报告荧光素酶载体,标记为pGL3-CDR1as-WT、pGL3-CDR1as-MUT,将其分别于miR-NC、miR-876-5p、anti-miR-NC、anti-miR-876-5p共转染48 h,通过萤火虫荧光素酶和海肾荧光素酶的荧光活性的比值表示荧光素酶的活性。
1.2.7裸鼠成瘤实验 将30只裸鼠随机分为Blank组、si-NC组、si-CDR1as组,每组10只。Blank组裸鼠,不进行任何处理,正常饲养;si-NC组、si-CDR1as组裸鼠分别接种转染si-NC、si-CDR1as的Huh-7细胞,用1 ml注射器吸取0.2 ml的1×106个/ml细胞,接种在裸鼠左前肢,在SPF条件下饲养裸鼠,第3天开始,每周用直尺测量肿瘤的长和宽(cm),计算肿瘤的体积。至第60 天肿瘤生长到足够大,断颈法处死裸鼠,小心剥离肿瘤,称量重量(mg),取平均值。
1.3统计学方法 采用GraphPad Prism6.0软件进行单因素方差分析、Bonferroni校正的t检验。
2 结 果
2.1CDR1as、miR-876-5p在肝癌细胞中的表达 与L02组相比,Huh-7、Hep-3B组细胞中CDR1as表达均显著升高,miR-876-5p表达均显著降低(P<0.05)。见表1。

表1 CDR1as、miR-876-5p在肝癌细胞中的表达
2.2敲减CDR1as对肝癌细胞增殖、迁移和侵袭的影响 与si-NC组相比,si-CDR1as组细胞中CDR1as表达显著降低,在48、72 h时,细胞增殖显著降低,迁移细胞数和侵袭细胞数均显著降低(P<0.05)。见表2、图1。
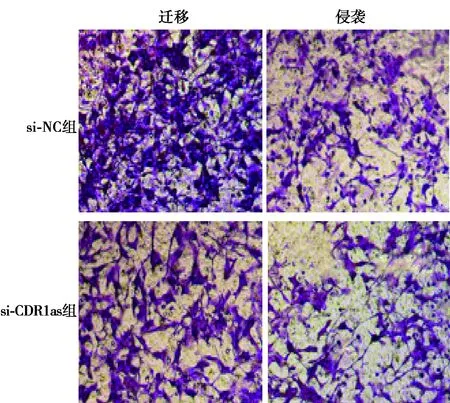
图1 敲减CDR1as的肝癌细胞的迁移侵袭(结晶紫染色,×200)

表2 敲减CDR1as对肝癌细胞增殖、迁移和侵袭的影响
2.3CDR1as靶向miR-876-5p 通过生物信息学在线预测网站Target Scan(http://www.targetscan.org/vert_71/)预测到CDR1as与miR-876-5p之间存在15个互补的靶向结合位点见图2。双荧光素酶报告基因检测实验显示,与miR-NC组相比,miR-876-5p组CDR1as表达显著升高,WT-CDR1as细胞的荧光活性显著降低,MUT-CDR1as细胞的荧光活性差异不明显,与anti-miR-NC组相比,anti-miR-876-5p组CDR1as表达显著降低,WT-CDR1as细胞的荧光活性显著升高,MUT-CDR1as细胞的荧光活性差异不明显(P<0.05)。见表3。
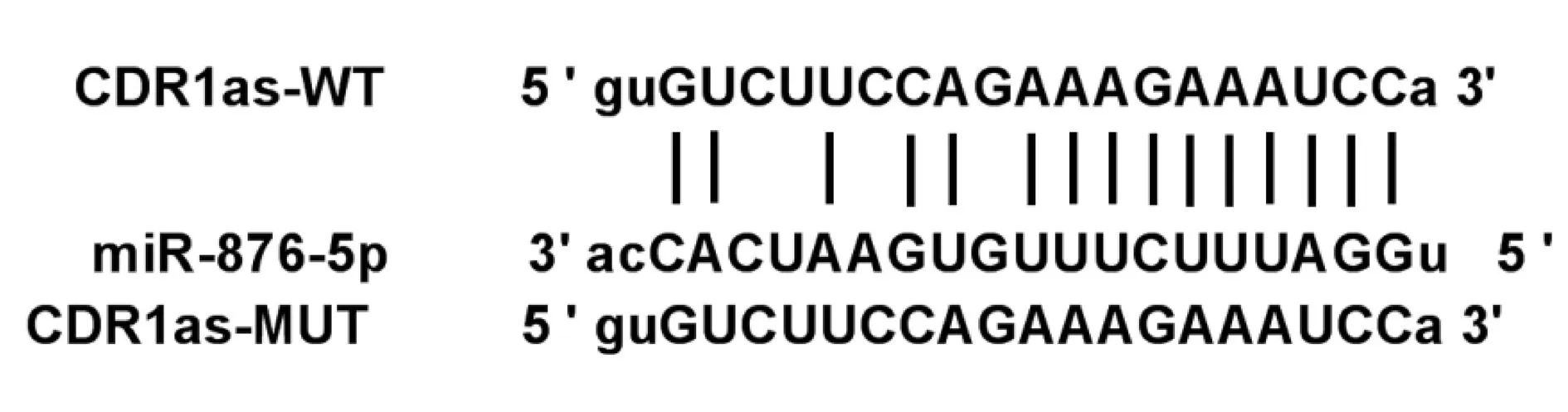
图2 circ RNA CDR1as与miR-876-5p之间存在互补的结合位点

表3 双荧光素酶报告实验结果
2.4过表达miR-876-5p对肝癌细胞增殖、迁移和侵袭的影响 与miR-NC组相比,miR-876-5p组细胞中miR-876-5p表达显著升高,在48、72 h时,细胞增殖显著降低,迁移细胞数和侵袭细胞数均显著降低(P<0.05)。见图3、表4。

表4 过表达miR-876-5p对肝癌细胞增殖、迁移和侵袭的影响
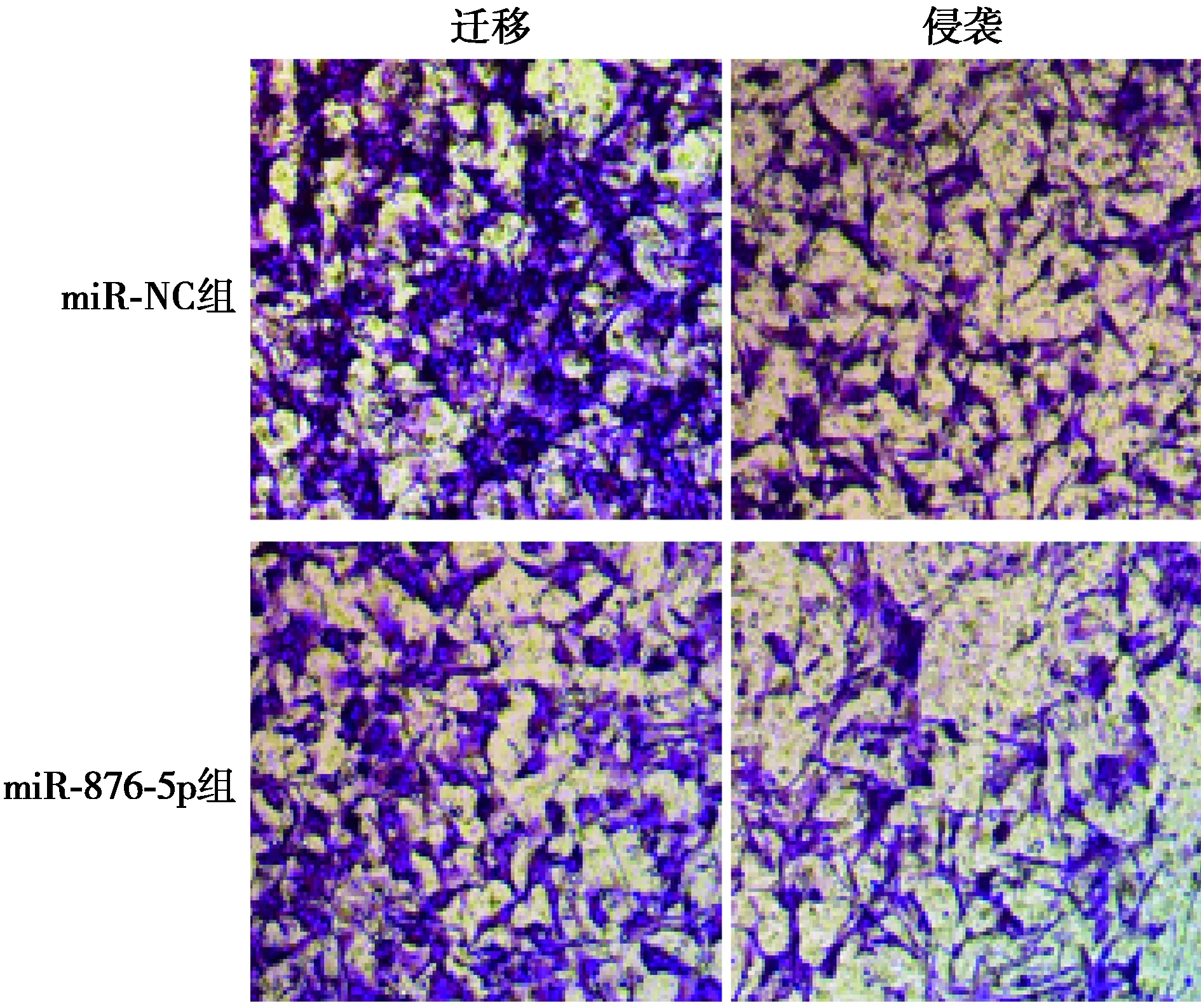
图3 过表达miR-876-5p的肝癌细胞的迁移侵袭(结晶紫染色,×200)
2.5抑制miR-876-5p逆转了敲减circRNA CDR1as对肝癌细胞增殖、迁移和侵袭的抑制 与si-CDR1as+miR-NC组相比,si-CDR1as+miR-876-5p组细胞中CDR1as表达显著升高,在48、72 h时,细胞增殖显著升高,迁移细胞数和侵袭细胞数均显著升高(P<0.05)。见表5。

表5 抑制miR-876-5p逆转了敲减circRNA CDR1as对肝癌细胞增殖、迁移和侵袭的抑制作用
2.6敲减circRNA CDR1as对裸鼠成瘤的影响 与si-NC组相比,si-CDR1as组裸鼠成瘤的平均重量和体积均显著降低,肿瘤组织中CDR1as的表达显著降低,miR-876-5p的表达显著升高(P<0.05)。见表6。

表6 敲减circRNA CDR1as的裸鼠成瘤及CDR1as、miR-876-5p mRNA的表达
3 讨 论
circRNA是一类内源性RNA,通过与其他分子或微小RNA相互作用调节转录后或转录水平的基因表达。circRNA在生物学过程中起着至关重要的作用。circRNA被证明是许多疾病(包括癌症)的潜在生物标志物〔8〕。研究表明CDR1as的表达明显发生升高,其表达与miR-7之间呈靶向负调控的关系,且敲减CDR1as可抑制肝癌细胞的增殖和侵袭,提示CDR1as在肝癌新疗法中的巨大潜力〔9,10〕。Yang等〔11〕发现CDR1as在肝癌细胞中可调节300多个差异表达的蛋白质,以参与细胞增殖和周期调控,表皮生长因子受体(EGFR)是miR-7的靶向目标,CDR1as可靶向调控miR-7,也可以间接靶向调控EGFR,揭示了CDR1as在肝癌中发挥作用的新的功能机制。本研究检测了肝癌细胞中CDR1as的表达发现,其在肝癌细胞中表达异常上调,并且敲减CDR1as明显抑制肝癌细胞的增殖、迁移和侵袭。本研究通过生物信息学预测、双荧光素酶报告基因检测实验验证了CDR1as可靶向负调控miR-876-5p,于是猜测CDR1as在肝癌中的功能也许可能与miR-876-5p具有一定的联系。
miRNA在人类肿瘤中的重要调控功能已得到认可,但是其调控网络十分复杂,至今仍处在不断地探索阶段〔12〕。Xu等〔13〕报道miR-875-5p在肝癌的临床样本分析中的表达下调,并且过表达miR-875-5p可通过抑制上皮间质转化而抑制肝癌细胞的迁移和侵袭,抑制miR-875-5p则具有相反的作用,并通过双荧光素酶报告基因检测实验和回补实验验证miR-875-5p可靶向调控BCL6共抑制因子样蛋白(BCORL)1的表达,揭示了miR-875-5p抑制肝癌细胞迁移侵袭的机制与靶向BCORL1相关。我们推测miR-875-5p在肝癌中的功能也许与CDR1as在肝癌中的功能具有一定的联系。本研究验证了miR-875-5p在肝癌中发挥抑制癌症进一步恶化的作用;重要的是抑制miR-875-5p逆转了敲减CDR1as对肝癌细胞的增殖、迁移和侵袭的抑制作用,这揭示了miR-875-5p也可以反向负调控CDR1as在肝癌中的表达和功能,为CDR1as、miR-875-5p在肝癌的诊断、治疗中的潜在价值的开发奠定理论基础。
综上,环状RNA CDR1as在肝癌细胞中调控癌细胞的增殖、迁移和侵袭,其机制与靶向miR-875-5p具有相关性,为肝癌的治疗提供新的候选靶标。
