多重real-time PCR技术快速鉴别特种乳中的乳源动物成分
2021-08-31杨艳歌王丹丹李唯熙王洪越刘鸣畅吴亚君
杨艳歌,李 莉,王丹丹,李唯熙,王洪越,刘鸣畅,吴亚君,*
(1.中国检验检疫科学研究院,北京 100176;2.河北工程大学生命科学与食品工程学院,河北 邯郸 056038)
目前乳产品市场朝着多样化方向快速发展,羊乳、牦牛乳、水牛乳、骆驼乳、马乳、驴乳等特色乳产品越来越受到关注。联合国粮农组织的数据显示,全球生鲜乳生产量排名前5的分别为牛奶(占81%)、水牛奶(占15%)、山羊奶(占2%)、绵羊奶(占1%)以及骆驼奶(占0.5%)[1]。我国乳品资源丰富,加上产业政策的扶持,特色乳产业逐渐成为南方和西部地区经济增长的亮点。同时牦牛乳[2-3]、山羊乳[4]、驴乳[5]和马乳[6]等乳品在营养素含量上更接近人乳,逐渐受到消费者青睐。
由于特色乳的数量和日产量较小,价格偏高[7-8],容易发生掺假掺杂现象,主要是用价格相对较低的牛乳替代或添加到特色乳,这不仅侵犯了消费者的权益,而且容易引起过敏[9]等健康风险。因此各种乳源可追溯性分析方法陆续涌现,有基于免疫的酶联免疫吸附剂测定技术[10-12],基于非免疫的液相色谱[13-14]、电泳[15-17]或质谱技术[18-20]等。而基因检测技术是被公认的物种鉴定金标准技术,并具有可靠、特异、灵敏、快速的特点[21-23]。自发现牛奶中体细胞可以被用作DNA的来源后[24],以聚合酶链式反应(polymerase chain reaction,PCR)为基础的乳源物种识别技术迅速发展,其中实时PCR(real-time PCR)操作简便,无需电泳即可自动化获得检测结果,并进行快速定性定量分析[25-27]。而多重realtime PCR还可以在一次反应中同时检测多种靶点,实现快速高通量的检测[21,25,28]。
本研究建立可通过一次实验,高通量、高效率鉴别乳品中8 种乳源成分(牛、牦牛、水牛、山羊、绵羊、骆驼、马、驴)的多重real-time PCR方法,同时筛选建立乳品DNA高效提取方法,完成裂解后在12 min左右可同时进行96 个样品的DNA提取,大大缩短了样品前处理时间。该方法的建立旨在为特种乳监管提供可靠有力、快速高效的检测手段,为打击假冒伪劣产品,保障消费者生命健康提供良好的技术支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
绵羊乳、山羊乳、骆驼乳、马乳均从内蒙古的牧场收集,水牛乳、驴乳、牦牛乳分别由广西水牛研究所、山东海关和中国农业大学提供,全脂牛乳粉由惠氏营养品有限公司提供。市售特色乳制品购自北京超市以及电商平台。其他动物材料:猪、梅花鹿、马鹿、狗、兔、狐狸、水貂、鸡、鸭、鱼为本实验室储存样品。
1.1.2 试剂
QuickGene组织DNA提取试剂盒 日本Kurabo公司;PDQeX prepGEM通用DNA提取试剂盒 英国MicroGEM公司;NucleoSpin®食品DNA提取试剂盒 德国Macherey-Nagel公司;DNeasy Mericon DNA提取试剂盒德国Qiagen公司;Foodproof®转基因样品提取试剂盒德国Biotecon Diagnostics公司;TaqMan®Gene Expression Master Mix 美国Applied Biosystems公司;灭菌ddH2O。
1.1.3 引物探针
牛、水牛、牦牛、绵羊的引物探针序列引自现有标准[29-32]。哺乳动物、骆驼、山羊、马、驴引物探针自行设计,先从GenBank数据库中提取这些物种及各自近源物种的生长激素基因(growth hormone,GH)、cytb、tRNA-Thr及D-loop基因序列,然后利用Clustal X软件进行多重序列比对,利用Primer Premier 5.0软件在保守区域设计哺乳动物通用引物探针,在种间差异区域设计骆驼、山羊、马、驴的特异性引物探针。考虑到乳粉在生成过程中需要经过高温杀菌等加工处理,会导致DNA断裂或者降解,因此在设计筛选引物探针时控制靶序列长度在250 bp以内,以保证不同加工程度乳品的检测需求。设计的引物探针通过单重real-time PCR进行物种特异性和灵敏度进行分析,最终确定的引物探针信息详见表1。引物探针均由上海英潍捷基生物技术有限公司合成。

表1 乳源动物成分检测引物探针信息Table 1 Information about primers and probes used for identification of dairy animal species
1.2 仪器与设备
7500fast实时荧光PCR仪 美国ABI公司;QuickGene Mini8L 日本Kurabo公司;核酸蛋白定量仪Qubit®2.0美国Invitrogen公司;组织研磨机 德国Qiagen公司;涡旋仪 德国IKA公司;Pico17离心机(离心力≥12 000×g) 美国Thermo公司;恒温混匀仪、微量移液器 德国Eppendorf公司;离心管、八连排PCR管美国Axygen公司;电子天平 德国Sartorius公司;恒温水浴锅 北京六一生物科技有限公司。
1.3 方法
1.3.1 样品前处理
液态乳冷冻干燥成粉,乳粉直接混匀,其他植物和动物样品统一用组织研磨仪粉碎,-80 ℃冻存。
1.3.2 DNA提取
CTAB法采用GB/T 19495.3—2004《转基因产品检测核酸提取纯化方法》[33]操作,其中蛋白酶K量增加1 倍,氯仿去蛋白的步骤重复1 次。PDQeX prepGEM通用DNA提取试剂盒按照说明书步骤提取DNA。而NucleoSpin、DNeasy Mericon、QuickGene、Foodproof DNA提取试剂盒在说明书的基础上进行了改良:样品量统一称取100 mg,蛋白酶K量增加1 倍,裂解时间统一为65 ℃、500 r/min恒温混匀仪振荡孵育1 h,其余步骤按说明书操作。DNA用100 μL无菌ddH2O溶解。用Qubit®2.0测量DNA浓度,用筛选的哺乳动物内参照基因进行DNA质量检测,每份DNA扩增3 次,-20 ℃保存DNA。后续实验采用优选的方法进行DNA提取。
1.3.3 real-time PCR扩增
单重real-time PCR体系:总体积25 μL包含12.5 μLTaqMan®Gene Expression Master Mix,10 μmol/L上下游引物各0.5 μL,10 μmol/L探针0.5 μL,模板DNA 5 μL(5 ng/μL),无菌ddH2O 6 μL。
多重real-time PCR体系:4 种不同荧光的浓度为10 μmol/L的上游、下游引物和探针分别按照1∶1∶1∶1混合配制成上下游引物混合液以及探针混合液,对应的4 种靶标乳粉DNA(5 ng/μL)等体积混合配成DNA mix。总体积25 μL包含12.5 μLTaqMan™ Multiplex Master Mix,上游引物、下游引物和探针混合液各1 μL,DNA混合液5 μL,无菌ddH2O 4.5 μL。
在real-time PCR仪上进行PCR扩增与结果分析。扩增程序:50 ℃去除RNA 2 min;95 ℃预变性10 min,95 ℃变性10 s, 60 ℃退火1 min,40 个循环(哺乳50 个循环)。生成图像时阈值设为自动。在试样PCR反应的同时,设置阴性对照、阳性对照和空白对照。
1.3.4 引物探针通用性和特异性
分别以绵羊奶、山羊奶、牛乳、水牛乳、牦牛乳、骆驼乳、马奶、驴乳、马鹿、梅花鹿、猪、狗、兔、狐狸、水貂、鸡、鸭、鱼的DNA(5 ng/μL)为模板进行扩增,以无菌水为空白对照,每个样品3 个平行。
1.3.5 多重real-time PCR交叉反应性
按照real-time PCR仪的4 种荧光系统,对8 种乳源的探针分别用FAM、VIC、ABY和JUN进行荧光标记并编号,编号如表1所示。根据发光集团的不同将8 种乳源进行组合,共产生16 种组合:即1234、1247、1238、1278、1346、1368、1467、1678、2345、2358、2457、2578、3456、3568、4567、5678。8 种乳DNA均调至5 ng/μL,将每种组合对应的4 种DNA进行等体积混合作为阳性(DNA终质量浓度1.25 ng/μL),10 种阴性对照DNA调至12.5 ng/μL并进行等体积混合作为阴性对照(保证反应体系中每个物种终质量浓度一致),以无菌ddH2O为空白对照,进行多重real-time PCR检测,每个样品3 个平行。
1.3.6 多重real-time PCR绝对灵敏度
将提取的8 种乳样品的DNA从起始质量浓度开始进行10 倍比稀释,稀释6 个梯度,其中牛乳和马乳起始DNA质量浓度为5 ng/μL,水牛乳和驴乳起始DNA质量浓度为10 ng/μL,牦牛乳、山羊乳、骆驼乳起始DNA质量浓度为50 ng/μL,绵羊乳起始DNA质量浓度为100 ng/μL。以无菌ddH2O为空白对照,用优选的组合进行多重realtime PCR扩增,分析检测的绝对灵敏度,每个反应设置3 个平行。
1.3.7 实际灵敏度分析
为分析建立的多重real-time PCR体系对混合样品检测的灵敏度,将每种组合对应的4 种靶标乳先等质量混合,以非靶标乳为基质,按照每种靶标乳含量0.1%、1%、10%、50%的比例制备混合乳品。即以绵羊乳为基质添加牛乳/牦牛乳/水牛乳/山羊混合乳,以牛乳为基质添加绵羊乳/驴乳/马乳/骆驼乳混合乳,以对应的基质DNA为阴性对照,以ddH2O为空白对照,对目标物种成分进行多重real-time PCR检测,每个反应设置3 个平行。
1.4 数据统计及图表绘制
从仪器导出检测结果和数据,并录入在Excel表格中,在Excel中计算平均值和标准偏差,根据数据绘制三线表、柱形图或散点图,柱形图用不同颜色和图案填充,以重复实验的标准偏差添加误差线。扩增图谱和标准曲线仪器自动生成,导出图谱进行组合。
2 结果与分析
2.1 乳品高效DNA提取方法的建立
为实现乳品DNA的快速高效提取,以牛乳和羊乳为研究对象,选用传统CTAB法和5 种商业试剂盒比较和优化DNA提取方法,通过质量浓度、纯度和哺乳动物内参照基因检测结果分析DNA提取质量和扩增效率。结果显示,针对牛乳,DNeasy Mericon DNA试剂盒提取的DNA浓度最高,其次是QuickGene组织DNA提取试剂盒,二者的扩增效率几乎一致。针对羊乳,无论是DNA提取质量浓度还是扩增效率,QuickGene都高于其他5 种方法。
并且QuickGene DNA组织提取试剂盒配套QuickGene-mini8L设备,通过温和正压过柱法从样品中快速获取DNA,无需离心,对核酸片段的损伤小;一次可过柱10 mL的液体,是传统吸附柱法15 倍的体积量,大大缩短了富集时间,样品裂解后12 min即可完成DNA提取;且可以一次同时处理8 份样品,提高了提取的通量。因此最终选择QuickGene组织DNA提取试剂盒作为不同乳制品DNA快速高效提取的方法。

图1 不同DNA提取方法对乳DNA提取结果Fig. 1 Results of DNA extraction from milk by different DNA extraction methods
2.2 引物探针的筛选
为保证real-time PCR检测结果的准确性,首先要保证提取的乳品DNA的质量。因为常见的乳源物种均为哺乳动物,因此实验设计筛选了哺乳动物通用引物探针。real-time PCR检测结果显示,该引物探针可以将15 种哺乳动物成分(绵羊、山羊、牛、水牛、牦牛、骆驼、马、驴、猪、梅花鹿、马鹿、狗、兔、狐狸、水貂)扩出,Ct值均在30以内,非哺乳动物无扩增,表明通用性和特异性良好,可以作为乳品DNA质量检测的内参照。
以8 种乳为研究对象,设计和筛选8 种乳源(牛、牦牛、水牛、山羊、绵羊、骆驼、马、驴)的特异性引物探针(表1),扩增结果显示只有靶标乳源物种产生扩增曲线,扩增Ct值在19.96~25.86之间(表2),与非靶标乳源物种之间无交叉反应,阴性对照和空白对照也均无扩增,说明筛选的引物探针特异性较好。
表2 通用性和特异性引物探针real-time PCR检测结果( )Table 2 Results of real-time PCR detection using universal and specific primers and probes ()

表2 通用性和特异性引物探针real-time PCR检测结果( )Table 2 Results of real-time PCR detection using universal and specific primers and probes ()
注:a.指猪、梅花鹿、马鹿、狗、兔、狐狸、水貂;b.指鸡、鸭、鱼。
样品水牛 23.67±0.2520.39±0.28牦牛 22.93±0.5324.02±0.41山羊 22.15±0.1725.86±0.64绵羊 22.20±0.28 Ct值哺乳 牛 水牛 牦牛 山羊 绵羊 马 驴 骆驼牛 21.24±0.0419.96±0.03 ≥40≥40≥40≥40≥40≥40≥40 20.96±0.29马 22.32±0.22 24.43±0.35哺乳非靶标a21.43~29.18≥40非哺乳b ≥50≥40≥40 20.27±0.10骆驼 26.49±0.09≥40 20.30±0.54驴 20.07±0.11≥40≥40≥40≥40
2.3 多重real-time PCR交叉反应性
为建立乳源多重real-time PCR检测体系,对8 种乳源引物探针的16 种组合进行多重real-time PCR交叉反应性检测。结果显示,除2358这种组合外,其他15 种组合均能成功检测到对应的4 个目标物种(图2),10 种阴性对照均无扩增。但发现含牦牛成分的3 种组合中(1238、1346和2345)牦牛的扩增曲线ΔRn较低,非典型的S型曲线(图2C、E和图I);同时1247和2457组合中山羊(图2B和K),以及1278和2578中骆驼的扩增也出现同样的现象(图2D和L),说明在这8 种组合中出现了交叉反应,扩增受到抑制。剩下的反应体系中只有1234和5678这种组合可以同时保证8 种乳源均具有良好的扩增效果(图2A和P),混合体系之间未产生交叉反应,故初步确定以1234和5678这种组合作为8 种乳源多重real-time PCR检测体系。



图2 16种组合的多重real-time PCR扩增结果Fig. 2 Amplification curves with 16 multiplex combinations of four primers and four probes
2.4 多重real-time PCR绝对灵敏度
为对选择的1234和5678这种组合的多重检测体系进行绝对灵敏度分析,将8 种乳稀释的6 个梯度进行多重real-time PCR检测,每一个物种的扩增结果如图3所示。结果显示马乳(图3C)、牛乳(图3D)和骆驼乳(图3G)DNA前5 个浓度扩增结果较好,但第6个梯度的扩增曲线接近阈值基线,故牛乳和马乳的最低绝对灵敏度为0.5 pg/μL,骆驼为5 pg/μL;水牛乳、绵羊乳和驴乳DNA可以检测到第6个浓度梯度,故水牛乳和驴乳的最低绝对灵敏度为0.1 pg/μL,绵羊乳最低绝对灵敏度为1 pg/μL;牦牛乳和山羊乳可以检测到5 个浓度梯度,即最低绝对灵敏度均为5 pg/μL。分析仪器自动生成的标准曲线结果,如图4所示,R2均在0.99以上,扩增效率均在80%以上,说明线性关系良好,检测结果较可靠。


图3 8种乳源多重real-time PCR绝对灵敏度扩增图谱和数据分析Fig. 3 Amplification curves showing absolute sensitivity of multiple real-time PCR for detection of milks from eight dairy species



图4 8种乳源多重real-time PCR绝对灵敏度标准曲线结果Fig. 4 Standard curves for absolute sensitivity of multiple real-time PCR for detection of milks from eight dairy species
2.5 多重real-time PCR检出限
为了进一步分析1234与5678组合的多重realtime PCR体系对混合乳品检测的实际灵敏度,制备了4 种目标乳含量为0.1%、1%、10%、50%的混合样品,多重real-time PCR检测结果显示8 种乳的检出限均可达0.1%,检测Ct值在32.05~38.07之间(图5),可以满足检测需求。因此确定后续实际乳品检测以1234与5678这种多重real-time PCR体系进行乳品中8 种乳源成分的检测。
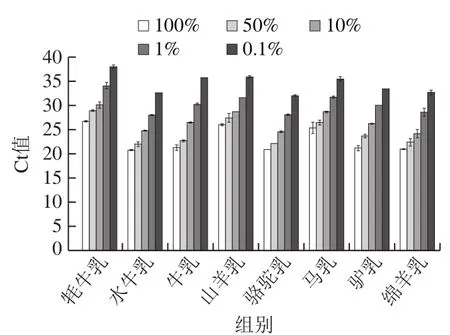
图5 混合乳品多重real-time PCR实际检出限Fig. 5 Limits of detection of multiplex real-time PCR for milk mixtures
2.6 市售样品检测结果
用建立的方法对55 份样品市售特色乳产品进行了乳源成分分析,包括12 份牦牛乳制品、4 份水牛乳制品、11 份骆驼乳制品、4 份马乳制品、5 份驴乳制品、9 份山羊乳制品、6 份绵羊乳制品以及4 份未标识羊品种的羊乳制品。种类包括液态鲜奶、酸奶、奶贝/奶片、奶酪/干酪、奶粉、婴配,涉及的加工方式包括巴氏杀菌、发酵、高温灭菌、超高温灭菌、高温喷雾干燥、物理脱膻、冻干、低温干燥、低温干湿复合等。用哺乳动物内参照进行DNA质量检测,结果显示所有乳制品检测Ct值均在35以内,证明建立的DNA提取方法可以满足不同种类不同加工方式乳制品基因检测的需求。多重realtime PCR进行8 种乳源成分的检测结果显示(表3),有20 份乳制品检出非标识物种成分,掺伪率达36.36%,主要是羊乳制品、骆驼乳制品及牦牛乳制品。其中5 份山羊乳制品检出非标识绵羊或牛成分,不符率为55.56%;3 份绵羊乳制品检出非标识山羊或牛成分,不符率为50%;另有1 份马乳制品、1 份驴乳制品、6 份骆驼乳制品、4 份牦牛乳制品检出非标识牛成分,不符率分别为25%、20%、54.54%、33.33%。水牛乳制品和未标识品种的羊乳制品未检出非标识成分。整体市售特色乳产品乳源标识不符率达36.36%。

表3 市售乳及乳制品乳源动物物种成分检测Table 3 Results of detection of animal-derived ingredients from commercial dairy products from minor species

续表3
3 讨 论
分离提取高质量的DNA是基因检测的首要原则,从乳品中提取DNA主要从体细胞中获得,而每毫升乳中仅有20~20万 个体细胞,DNA含量不高[24,34]。加之乳制品在生成过程中需要经过喷雾干燥、高温杀菌等加工处理,会导致DNA断裂或者降解,加剧了DNA提取的难度[35]。因此建立乳品中高效快速的DNA提取方法,对乳品的乳源检测具有重要意义。通过比较,QuickGene DNA提取试剂盒不仅半自动、高通量,且相比于传统试剂盒法具有以下优点:1)移液快,具有10 mL容量的富集柱远高于传统富集柱650 μL的容量;2)DNA损伤小,即用正压过滤而无需高速离心;3)损失少,即1 次过柱即可完成过滤,而传统试剂盒需多次转移。另外乳品蛋白质含量高,这不仅给DNA提取带来困难,也会抑制PCR,降低检测的灵敏度[36-37],蛋白酶K可以水解消化蛋白质,因此提高了蛋白酶K的浓度和作用时间以增强水解作用。但水解时间过长,又会导致部分核酸消耗;过高浓度的蛋白酶K也会引起部分核酸的消耗,增加不必要的实验成本[38]。因此经过优化(数据未提供),普通乳品蛋白酶K的用量提高至试剂盒浓度高2 倍;奶酪制品蛋白酶K用量是试剂盒浓度3 倍时效果最好,该方法保证了后续实验中不同种类不同加工方式乳制品DNA的成功提取,说明了优化方法对于乳制品的适用性。
本研究设计筛选的8 种乳源物种探针采用TaqMan QSY标记,该方法的优点是可将已进行单重realtime PCR筛选后的探针,在不改变序列的情况下直接平移到QSY探针上,减少了传统多重real-time PCR探针设计和筛选的工作量。且采用该体系,设计的引物探针既可进行单重也可进行多重real-time PCR检测。同时5′荧光基团为FAM、VIC、ABY、JUN,避免了黯淡的染料Cy5或Quasar 705荧光信号低,灵敏度低的情况。本研究还采用了TaqMan™ Multiplex Master Mix多重real-time PCR扩增酶,该酶采用MUSTANG PURPLE染料作参比荧光而不含ROX,可避免占据PCR仪红色荧光通道,提高了反应的灵敏度。最终通过实验证实该方法特异性好、灵敏度高,检测核酸含量可达pg级。
采用建立的多重real-time PCR法,对55 份市售的乳品进行物种来源检测,发现婴幼儿配方粉普遍存在乳源标识不符的情况,达到85.7%。除了蓄意掺假,标识以外物种成分的来源还可能是乳糖等配料。本实验室采用real-time PCR法对牛来源的乳糖检测到明显的阳性信号(结果未发表)。因此,当应用real-time PCR法检测乳品动物来源时,对于成分复杂的产品,可以考虑进一步使用蛋白质分析方法确证动物成分是否来源原料乳。本实验室也建立了乳源蛋白双向电泳检测方法[39-40],可通过图谱直观地呈现乳品中主要蛋白质,但蛋白分析方法操作步骤复杂、比较耗时、灵敏度相对较低。因此,多重real-time PCR法作为高效筛查技术,可以应用于含有其他动物来源成分产品的快速筛选,对具体成分可以通过电泳、色谱、质谱等技术进一步鉴定,从而提高检测效率和准确性。
