石蒜属植物组织培养及其植物生长调节剂应用的研究进展
2021-08-28殷丽青邵雅东李青竹张永春蔡友铭
殷丽青,邵雅东,李青竹,张永春,孙 翊,蔡友铭∗
(1上海市农业科学院,上海201403;2长江大学园艺园林学院,荆州434025)
石蒜是石蒜科石蒜属球根花卉,是优良的观赏和药用植物,有时石蒜也会特指其中一个最为常见的种——红花石蒜(Lycoris radiata)。我国作为石蒜的主要产地,已有1 500多年的石蒜栽培历史,在全球已发现的20多种石蒜属植物中,有12种为我国特有[1-4]。
石蒜是一种重要的园林植物,花型优美,花色有红色、白色、黄色及复色,具耐湿、耐旱、耐阴等优良特性。此外,石蒜鳞茎中含有大量的石蒜碱,具有抗菌、保护心血管、抗病毒和抑制肿瘤的效应,而石蒜鳞茎中的加兰他敏对阿尔兹海默症和小儿麻痹症具有特殊的疗效[5-6],因此药物市场对石蒜成株的需求日益增加。
在自然栽培中,石蒜依靠鳞茎分球和种子进行繁殖,自然繁殖能力弱,石蒜野外资源的采集已远远不能满足市场的需求[1]。组织培养技术是解决植物繁殖困难最为有效的方法之一。有关石蒜属植物的组织培养研究国内外已有一些报道,并取得了一定的进展,但主要集中在石蒜(即红花石蒜)[7-8]和忽地笑[9-10]这2个种,在其他石蒜种如换锦花[11]、乳白石蒜[12-13]、中国石蒜[14-15]、长筒石蒜[16-17]等也有少量报道,然而多种石蒜属植物的组织培养快速繁殖还存在着一定的困难。本文对石蒜属植物组织培养研究进展进行回顾与总结,重点探讨植物生长调节剂对石蒜属植物组织培养不同阶段的作用及影响,对存在的问题及解决方法进行分析,并对其组织培养研究的前景和发展方向提出展望,旨在为石蒜属植物的组织培养研究、分子育种工程及其产业化发展提供参考。
1 石蒜属植物组织培养研究概况
我国石蒜属植物组织培养成功获得再生植株的研究最早报道于1986年,鲁雪华等[18]以忽地笑(Lycoris aurea)未成熟的种胚进行愈伤组织诱导得到再生植株。数年后,董庆华等[19]以红花石蒜的鳞芽进行组织培养获得成功;此后,姚丽娟等[11]、郭兆武等[20]报道了不同种石蒜的组织培养,比较了不同外植体及植物生长调节剂的配比对石蒜组培的影响。在前人的努力下,石蒜属植物组织培养研究获得了较大的进展(表1)。
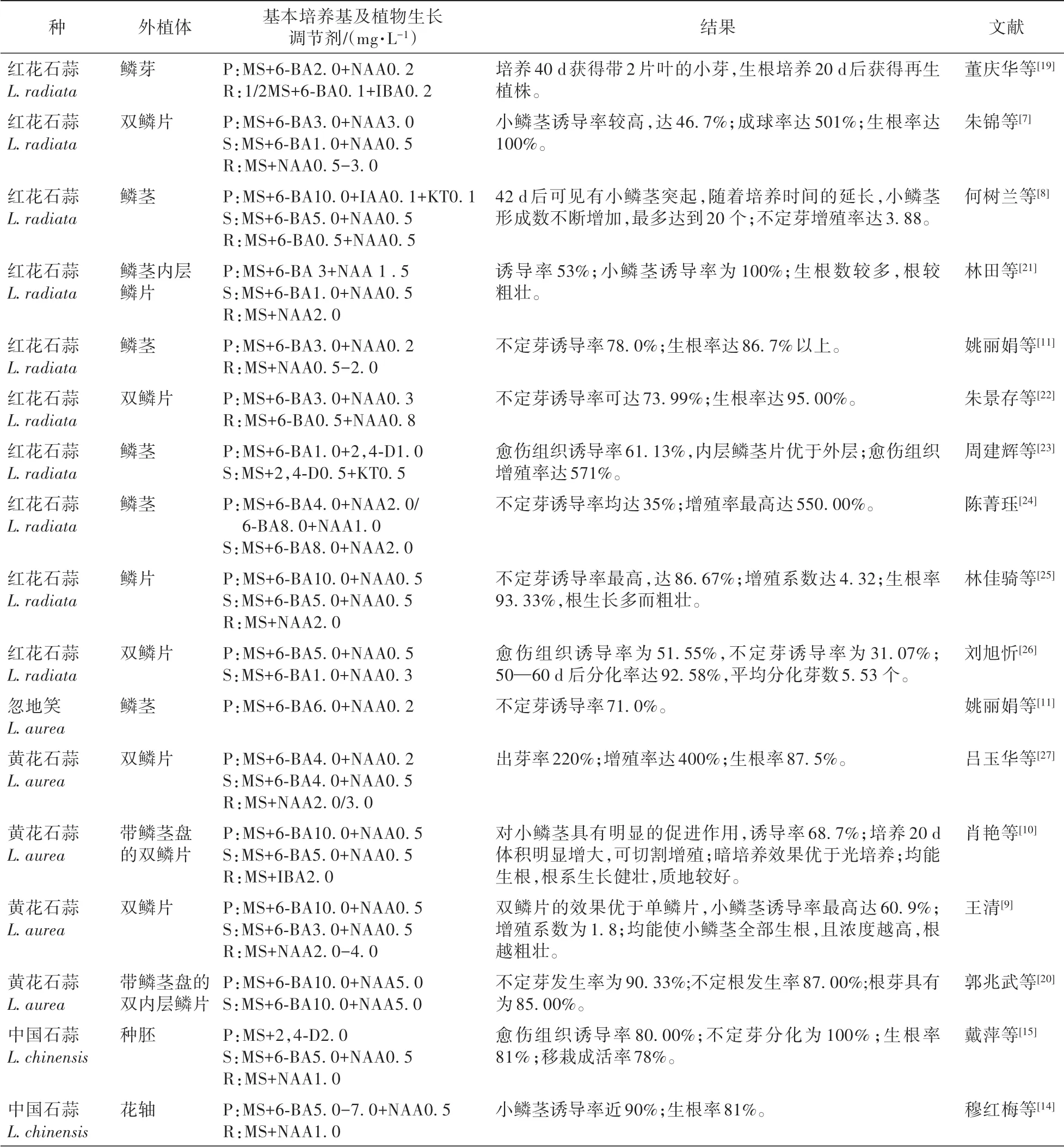
表1 石蒜属植物组织培养名录Table 1 List of tissue culture of Lycoris
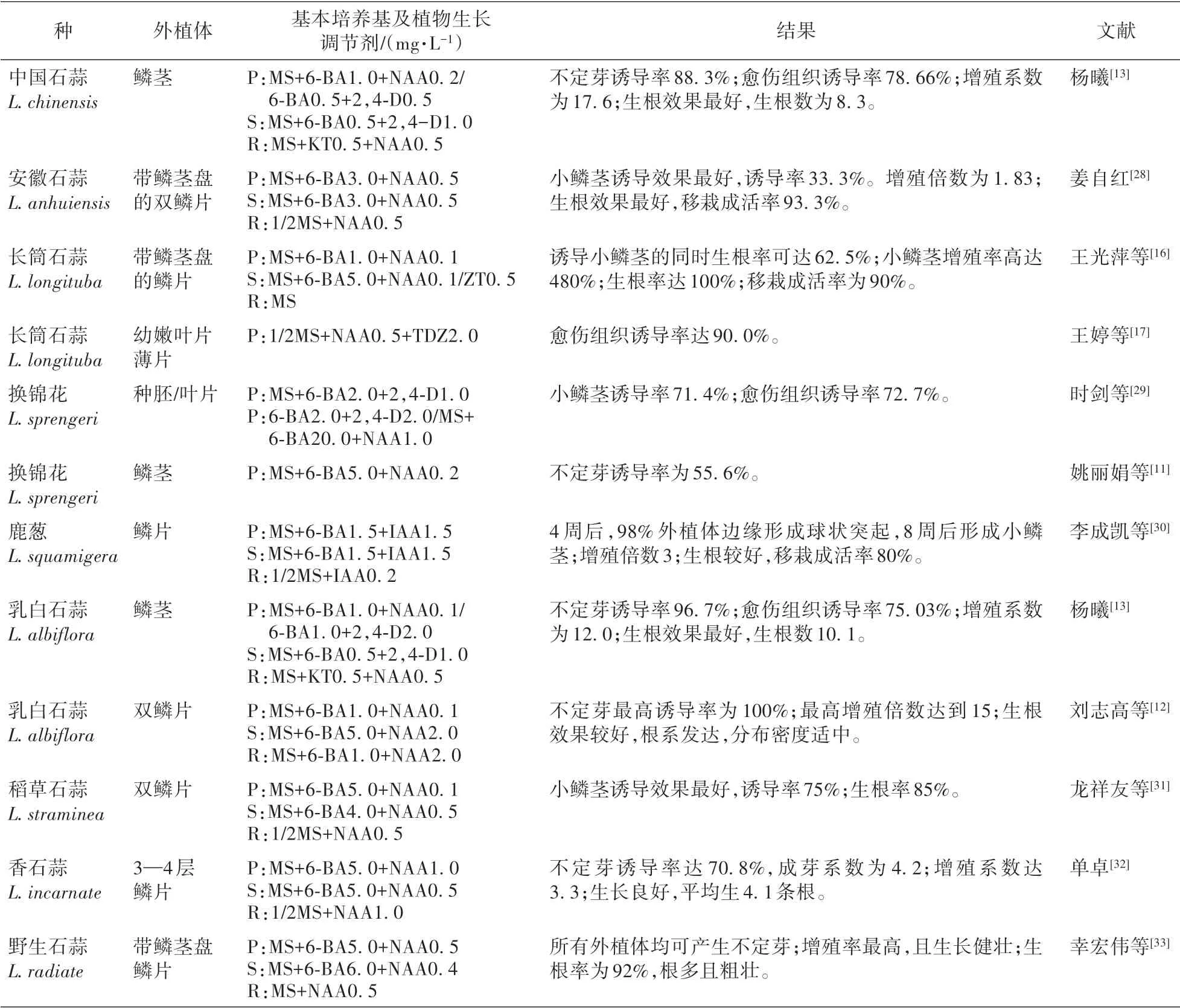
(续表1)
2 基因型和外植体对石蒜属植物组织培养的影响
基因型是影响石蒜属植物组培成功与否的重要因素,从已有报道分析,红花石蒜和忽地笑(因开黄花,一些文献中称其黄花石蒜)组培相对容易,已有较多成功的报道[9,27]。此外,中国石蒜、乳白石蒜、换锦花、长筒石蒜和稻草石蒜等也有少量组培研究初步成功的报道。石蒜属植物组培一般选用鳞茎或双鳞片作为外植体,也有一些研究使用花器官、叶片或种胚作为外植体。外植体的选择对诱导效果具有显著的影响,也是提高诱导率的关键因素之一,外植体的类型、取材部位、生理状况及生长时期都会影响诱导的成功率。有报道显示,石蒜属植物种胚培养效果最好[15,29,34],中国石蒜、换锦花种胚的培养效果显著优于鳞茎和叶片组织,其不定芽诱导率最高可达100%。但是,石蒜属植物的种胚来源有限,鳞茎或鳞片取材相对容易,使用其鳞茎或鳞片进行诱导培养也可获得良好效果[13,16,28]。其次,石蒜属植物叶片也是不错的外植体选择[17,29],相对于其他外植体而言,叶片取材方便,消毒容易,幼嫩组织具有较强的分生能力,比成熟组织更加适合作为外植体。时剑等[29]用幼嫩叶段进行愈伤组织的诱导获得了良好的效果,后续培养还获得了不定芽和小鳞茎。此外,花丝、花药、雌蕊、花轴、花被、花梗和子房等花器官也可作为外植体。陈菁珏[24]以花梗作外植体进行诱导培养,获得88.89%的愈伤组织诱导率;穆红梅等[14]以花轴为外植体进行小鳞茎诱导培养,诱导率接近90%。可见,石蒜属植物的花轴也是其组织培养的优选外植体之一。总之,在石蒜属植物组培中,外植体选择除常用的鳞茎或鳞片外,一些幼嫩的叶片和花器官也可作为外植体进行诱导培养,以叶片作外植体的诱导快繁更具有应用价值,其不损伤鳞茎,在珍稀种质保存与扩繁中具有十分重要的现实意义。
3 植物生长调节剂对石蒜属植物组织培养的影响
植物生长调节剂在培养基中含量极低,但对植物组培成功与否至关重要,其对植物生长、发育具有显著作用,可直接影响外植体的分化和再生。石蒜属植物组织培养过程中,不同阶段对植物生长调节剂的种类和浓度需求不同。
3.1 植物生长调节剂对石蒜属植物愈伤组织诱导的影响
植物组织培养中诱导愈伤组织最常用的植物生长调节剂是2,4-D。前人研究表明[15,35-36],以黄花石蒜种胚为外植体,培养于MS+2,4-D 2.0 mg∕L培养基中,诱导愈伤组织效果良好,诱导率达80%;如果以鳞茎为外植体,使用相同的培养基进行培养时,其诱导率仅为66.6%,这可能是由于鳞茎对单一施用2,4-D的响应较弱造成的。因此,以鳞茎为外植体进行愈伤组织诱导时,需要不同植物生长调节剂的联合使用才能获得较好的效果。研究表明,6-BA(0.5—5.0 mg∕L)和2,4-D(0.5—2.0 mg∕L)联合使用对鳞茎的诱导效果较好,中国石蒜的双鳞片(带基盘)诱导愈伤组织的最佳培养基是MS+6-BA 0.5 mg∕L+2,4-D 2.0 mg∕L,愈伤组织诱导率达78.66%,而乳白石蒜采用前述相同材料诱导愈伤组织的最佳培养基是MS+6-BA 1.0 mg∕L+2,4-D 2.0 mg∕L,诱导率达75.03%[13]。周建辉等[23]以红花石蒜鳞片诱导愈伤组织,不同浓度的6-BA和2,4-D联合使用均能诱导出愈伤组织,而MS+6-BA 1 mg∕L+2,4-D 1 mg∕L联合使用最佳。对比培养时间,使用MS+2,4-D 2.0 mg∕L培养基进行愈伤组织诱导培养30 d后可进行统计,而6-BA(0.5—5.0 mg∕L)和2,4-D(0.5—2.0 mg∕L)联合使用培养40—45 d可进行统计。笔者分析认为,随着培养时间的推移,石蒜愈伤组织诱导率会有所提高,但后期(培养1个月以后)形成的愈伤组织质量差于前期(培养1个月内)。目前,未见相同植物生长调节剂条件下,进行不同培养时间的对比试验。总体上说,不同植物生长调节剂的联合使用比单一植物生长调节剂的使用效果更好。6-BA和2,4-D的复合效应对不同的外植体诱导愈伤组织也具有较大的差异。研究表明,6-BA和2,4-D联合使用诱导率以种胚最高,其在MS+2,4-D 1.0 mg∕L+6-BA 1.0 mg∕L培养基上培养20 d后,愈伤组织诱导率可达82.4%;鳞茎次之,为26.1%;而叶片在最适的MS+2,4-D 2.0 mg∕L+6-BA 1.0 mg∕L培养基上最高诱导率仅为5.0%[37]。此外,换锦花和忽地笑的花梗、子房、花被、花丝和雌蕊分别接种在MS+6-BA+2,4-D培养基上培养8周后,均可以诱导愈伤组织,换锦花愈伤组织诱导效果最好的是MS+6-BA 1 mg∕L+2,4-D 1 mg∕L培养基,其中花梗作外植体效果最好,愈伤组织诱导率最高为64.7%;忽地笑愈伤组织诱导效果最好的为MS+6-BA 2 mg∕L+2,4-D 2 mg∕L培养基,4种外植体(除雌蕊外)均可以诱导出愈伤组织,其中花梗和子房的愈伤组织诱导率大于60.0%[38]。可见,6-BA和2,4-D的联合使用并不适用于所有外植体。因此,其他外源激素也成为研究重点,将苯基脲类衍生物(TDZ)应用于石蒜属植物的组织培养,以叶片为外植体诱导培养,获得了较高的愈伤组织诱导率[17],但愈伤组织非胚性,质量较差,不能获得小鳞茎或不定芽。在石蒜属植物的组织培养中,仅有较高的愈伤组织诱导率是不够的,应该更关注愈伤组织的质量,其中胚性愈伤组织的比例和颗粒性对其分化再生植株具有较大的影响。根据笔者多年经验,在植物组织培养中,获得良好的愈伤组织后应及时转接分化,否则会影响其质量,失去胚性而影响分化率。在具体研究中,可以通过植物生长调节剂种类浓度及配比的筛选、增加微量元素含量、提高培养基糖浓度等途径改善愈伤组织状态,提高胚性愈伤组织的比例和颗粒性,从而提高植株再生率[39]。
3.2 植物生长调节剂对石蒜属植物不定芽或小鳞茎形成的影响
石蒜属植物不定芽的形成主要有2种途径,即外植体直接诱导产生或通过愈伤组织分化形成。不定芽诱导主要以MS作基本培养基,常见的植物生长调节剂组合为6-BA和NAA,6-BA常用质量浓度范围为1.0—5.0 mg∕L,NAA常用质量浓度范围是0.1—2.0 mg∕L。不同种的石蒜对植物生长调节剂的响应具有较大的差异,姚丽娟等[11]研究表明,红花石蒜、忽地笑、换锦花3个种诱导不定芽的最适植物生长调节剂组合分别是6-BA 3 mg∕L+NAA 0.2 mg∕L、6-BA 6 mg∕L+NAA 0.2 mg∕L和6-BA 5 mg∕L+NAA 0.1 mg∕L,不定芽诱导率分别达78.0%、76.9%和55.6%,其中红花石蒜所需6-BA浓度最低,而不定芽诱导率最高。杨曦[13]以中国石蒜与乳白石蒜带基盘鳞片为外植体进行相关研究认为,中国石蒜与乳白石蒜诱导不定芽的最适植物生长调节剂组合分别是6-BA 1.0 mg∕L+NAA 0.2 mg∕L和6-BA 1.0 mg∕L+NAA 0.1 mg∕L,培养45 d后,其不定芽诱导率分别达88.3%和96.7%。刘志高等[12]以乳白石蒜鳞茎为材料进行不定芽诱导,培养50 d后,其结果与杨曦[13]相似,最高不定芽诱导率达100%。由此可见,在培养时间较一致时,不定芽诱导所需植物生长调节剂浓度和配比受基因型影响较大。此外,外植体种类不同,所需的植物生长调节剂最适浓度与配比也不同,一般认为,幼嫩组织对于外源激素的敏感性强于成熟组织。郭兆武等[20]以黄花石蒜为材料,以不同外植体进行不定芽诱导时发现,不同外植体对植物生长调节剂浓度的响应不同,其最适浓度的诱导率也具有一定差异,其中带底盘双内层鳞片、带底盘双中层鳞片的培养效果在MS+NAA 5.0 mg∕L+6-BA 10.0 mg∕L和MS+NAA 10.0 mg∕L+6-BA 5.0 mg∕L两种培养基上较其他外植体好。穆红梅等[14]等报道,以中国石蒜的花轴为外植体进行不定芽诱导时,MS+6-BA 5.0—7.0 mg∕L+NAA 0.5 mg∕L培养基的诱导率最高,近90%。除常用的6-BA和NAA之外,还有少量报道采用其他植物生长调节剂诱导石蒜属植物不定芽的发生,如2,4-D、IAA及KT。有学者以红花石蒜的鳞茎为外植体,在MS+IAA 0.1 mg∕L+6-BA 10.0 mg∕L+KT 0.1 mg∕L培养基上诱导不定芽的产生,培养6周后,其诱导增殖率达3.88[8]。红花石蒜通过愈伤组织分化不定芽,在MS+6-BA 1.0 mg∕L+2,4-D 1.0 mg∕L培养基上效果最好,不定芽分化率为76.2%[37]。总之,石蒜属植物不定芽培养适宜的植物生长调节剂种类和浓度配比因基因型和外植体种类不同而异,一般选用6-BA和NAA联合应用。也有报道认为,外植体可直接诱导获得小鳞茎,如稻草石蒜在MS+6-BA 5.0 mg∕L+NAA 0.1 mg∕L上诱导培养效果最好,小鳞茎诱导率为75%[31]。
3.3 植物生长调节剂对石蒜属植物继代增殖的影响
增殖系数(增殖率)是体现植物组织培养效率的最关键指标之一,在植物继代增殖过程中,在一定浓度范围内,其增殖系数随着植物生长调节剂浓度增加而提高,但浓度过高容易形成玻璃苗或发生变异。石蒜属植物继代增殖培养常用的基本培养基为MS,植物生长调节剂组合是6-BA+NAA或6-BA+2,4-D,也有少数报道用其他植物生长调节剂如KT、IAA和TDZ。前人研究表明,NAA和2,4-D的浓度差异会显著影响球根类花卉组织培养的效果[40]。石蒜和中国石蒜以带基盘双鳞片为外植体诱导的小鳞茎,增殖培养的最适植物生长调节剂是6-BA 0.5 mg∕L+2,4-D 1.0 mg∕L,增殖率分别可达543%和515%[34];红花石蒜以鳞茎诱导的不定芽进行增殖培养的适宜植物生长调节剂是6-BA 8.0 mg∕L+NAA 2.0 mg∕L,增殖率高达550%[24];香石蒜不定芽增殖的适宜植物生长调节剂是6-BA 5.0 mg∕L+NAA 0.5 mg∕L,增殖系数为3.3[32]。综上,NAA与2,4-D在石蒜增殖培养时,其效应并没有明显的差异。此外,KT、IAA和TDZ在石蒜属植物增殖培养方面也有应用,裸体石蒜鳞茎增殖的适宜植物生长调节剂是6-BA 1.5 mg∕L+IAA 1.5 mg∕L,增殖系数为3.0[30]。长筒石蒜的不定芽培养于含6-BA 5.0 mg∕L+NAA 0.1 mg∕L和6-BA 5.0 mg∕L+ZT 0.5 mg∕L的MS培养基进行增殖培养,增殖率分别高达480%和454%[16]。马建军[41]研究发现,在含NAA 1 mg∕L的MS培养基上,添加0.5—2.0 mg∕L的TDZ进行石蒜和中国石蒜鳞茎的增殖培养,鳞茎增殖系数随着TDZ浓度的提高而提高,石蒜最佳增殖培养的植物生长调节剂组合是6-BA 3.0 mg∕L+TDZ 0.5 mg∕L+NAA 1 mg∕L,中国石蒜最佳增殖培养基为MS+6-BA 4.0 mg∕L+TDZ 0.5 mg∕L+NAA 1 mg∕L,两者的增殖系数分别为2.69和2.77。综上所述,石蒜属植物增殖培养使用的培养基为MS,不同组织的增殖培养需要的生长调节剂浓度具有较大差异,复合应用植物生长调节剂的效果优于单一使用,而使用TDZ等其他植物生长调节剂与6-BA、2,4-D和NAA相比,没有显著优势。
3.4 植物生长调节剂对石蒜属植物生根培养的影响
已有研究显示,石蒜属植物的生根培养一般以MS或1∕2MS为基本培养基,应用的植物生长调节剂为NAA或IBA,也有两者联合应用,还有复合应用NAA或IBA添加低浓度6-BA的。前人研究表明[11,25],红花石蒜的小鳞茎或不定芽在含有NAA 0.5—2.0 mg∕L的培养基上生根率较高,根多且粗壮。朱景存等[22]和何树兰等[8]分别报道,在含适量NAA(0.8—1.0 mg∕L)的MS培养基中添加6-BA 0.5 mg∕L对红花石蒜不定芽诱导生根培养可获得较好的生根效果;乳白石蒜小鳞茎在含6-BA 1.0 mg∕L+NAA 2.0 mg∕L的MS培养基上能形成发达根系[12],表明外源激素的联合使用可以有效增加红花石蒜的生根率。陈娜等[42]以MS为基本培养基,比较了IBA和NAA联合应用于石蒜小鳞茎诱导生根的效果,结果显示NAA 0.5 mg∕L+IBA 1 mg∕L比NAA 0.5 mg∕L+IBA 0.5 mg∕L组合生根率高,且不定根生长状态较好,与NAA同时使用较高浓度的IBA会降低石蒜小鳞茎根系诱导率,表明石蒜类植物对于生长素类物质的联合使用较为敏感,需要控制生长素类用量。石蒜属植物对NAA的响应一般高于IBA,使用的NAA浓度一般较低便可诱导生根。朱锦等[7]比较了相同培养时间下(2—4周)NAA和IBA对石蒜生根的影响,发现NAA比IBA的诱导生根效果更为显著,低浓度的IBA对石蒜的生根诱导较差,而小鳞茎对NAA的浓度要求不严格。黄花石蒜的小鳞茎在MS+IBA 2.0 mg∕L培养基进行生根培养后,其根系生长健壮,质地较好[10],而野生石蒜不定芽使用MS+NAA 0.5 mg∕L进行生根诱导时,生根率达92%,根多且粗壮[33]。此外,杨曦[13]以中国石蒜和乳白石蒜为材料,比较了KT和6-BA与NAA联合应用于生根的效果,发现小鳞茎在含KT 0.5 mg∕L+NAA 0.5 mg∕L MS培养基上的生根效果优于6-BA 0.5 mg∕L+NAA 0.5 mg∕L培养基,具体表现为生根时间短、生根多、根系健壮。总之,石蒜属植物可利用MS或1∕2MS培养基进行生根培养,生长调节剂使用质量浓度以0.5—2.0 mg∕L为多。较低质量浓度(0.5 mg∕L)的细胞分裂素类(KT或6-BA)与生长素类(NAA)联合应用也可用于部分石蒜属植物的生长及诱导生根,效果良好。
4 其他影响石蒜属植物组织培养的因子
4.1 再生途径
植物组织培养离体再生类型有器官发生途径和体细胞胚发生途径两种,石蒜属植物的离体再生主要以器官发生较为常见。器官发生途径又分为直接途径和间接途径,直接发生途径是外植体直接诱导形成不定芽和不定根的过程;间接发生途径是外植体先脱分化形成愈伤组织,愈伤组织经过再分化形成不定芽的过程。石蒜属植物组培的直接发生途径是近年来的研究重点[27-28],由种胚或带鳞茎盘的鳞片通过直接发生途径比间接途径形成不定芽或小鳞茎更高效,且不容易产生变异。
4.2 预处理
污染是组织培养中常见的问题,鳞茎是石蒜属植物组织培养的主要外植体之一,其自带病菌多而杂,是造成污染的主要原因之一,在消毒前应彻底清洗后再流水冲洗。组织培养中常用的外植体消毒剂主要有酒精、升汞、过氧化氢和次氯酸钠等。0.1%的升汞灭菌效果最好,且与吐温吸附剂联合使用效果更佳,然而升汞杀伤力强,易造成植株死亡,需要根据外植体幼嫩程度和带菌情况把握消毒时间。使用热处理和低温冷藏对外植体进行预处理对减少或控制病菌也具有一定效果[24]。此外,在接种前将球茎放入冰箱冷藏,也有利于提高外植体的分化能力,提高成活率[43]。
4.3 培养条件
石蒜属植物组培一般采用1∕2MS或MS为基本培养基,pH 5.3—5.8,添加3%蔗糖和0.7%琼脂进行培养。不同的蔗糖浓度对石蒜属植物组织培养的效果也有一定影响。姚丽娟等[11]研究发现,当蔗糖浓度为3%—6%时,红花石蒜小鳞茎质量随蔗糖浓度的提高而增加,在蔗糖浓度为6%时,获得最高倍数的生长量,继续提高蔗糖浓度小鳞茎质量逐渐下降。除蔗糖外,其他有机成分也具有十分重要的研究价值,在培养基中附加硅藻土和酵母粉对黄花石蒜的出芽具有促进作用,而加入土豆、香蕉、水解酪蛋白和活性炭后出现抑制作用,其中活性炭的抑制作用较为显著[27],但在生根培养基中加入活性炭,有利于促进小鳞茎生根[21],这可能与活性炭会吸附部分营养物质和植物生长调节剂,降低了培养基的外源激素水平有关。此外,光照条件对石蒜属植物不定芽的形成也有一定调节作用。吕玉华等[27]研究发现,红花石蒜在800—1 200 lx光照条件下培养16 h比24 h全黑暗条件下出芽率更高,且出芽较早;但是光照下的外植体极易褐变,而采用暗培养可有效降低褐变率[29]。此外,温度也是影响石蒜属植物组培效率的因子之一,石蒜属植物常规的组织培养适宜温度为25℃左右,目前未见不同培养温度对石蒜属植物组织培养影响的报道。笔者在研究中发现,稍低温度(22—24℃)条件下形成的愈伤组织生长速度低于稍高温度(26—28℃)条件,但前者形成的愈伤组织质地优于后者。此外,有研究显示,低温处理有利于外植体的分化,鳞茎在4—8℃下冷藏6—8周,褐化率降低,诱导率提高[8,11,43]。
5 存在的问题及解决方法
5.1 外植体消毒困难,污染率高
外植体的无菌化处理是影响植物组织培养成功与否的首要因素。石蒜属植物组培中常用的外植体是鳞茎,采用花器官、叶片及种胚等作为外植体的研究较少[2],而鳞茎常年生长于土壤中,带有数量较高和种类众多的微生物,很难进行消毒处理,尤其是霉菌类微生物很难彻底灭菌。采用以下方法可提高外植体灭菌效果,降低污染率:根据外植体的幼嫩程度选择适宜的消毒剂种类,并依据外植体带菌情况确定消毒剂的浓度及消毒时间;土壤中的鳞茎类外植体,开始消毒前进行较长时间(2—4 h)的流水冲洗;在消毒剂中添加吐温可以提高消毒剂的渗透率;培养基中添加抗生素有利于控制微生物的发生;将鳞茎进行低温冷藏可降低其携带的微生物的活力,提高杀菌的效果;采用多次消毒法、在植物生长旺盛期取材等措施对控制外植体污染也有一定效果[22,35]。此外,鳞茎类外植体不同部位的带菌数量差异较大,内层鳞片<中层鳞片<外层鳞片,灭菌效果也从强至弱;稍嫩的叶片和花器官等外植体带菌率较低,无菌化处理相对比较容易,有利于提高外植体无菌化处理的效率。
5.2 繁殖系数低,小鳞茎生长缓慢
在石蒜属植物组织培养中,还存在着繁殖系数低,小鳞茎生长缓慢的问题[44]。提高其繁殖系数和促进小鳞茎的膨大是提高石蒜属植物组织培养效率的关键。适当提高培养基中植物生长调节剂浓度,并将细胞分列素类与生长素类联合使用,对提高增殖系数具有一定作用。此外,叶面喷施氯吡苯脲(CPPU)、氯化胆碱(CC)、水杨酸(SA)等植物生长调节剂,对小鳞茎膨大均有一定促进作用[45]。在石蒜属植物的组织培养中也可尝试在培养基中添加上述植物生长调节剂促进小鳞茎的膨大。蔗糖是植物组织培养中应用最广泛的碳源[46],适当提高蔗糖浓度对石蒜属植物小鳞茎膨大也有一定的促进作用。此外,刘志高等[12]研究发现,在乳白石蒜的小鳞茎增殖时,通过适当切割小鳞茎可以缩短培养周期且不影响增殖效果。
6 展望
石蒜属植物作为一种独特的兼园林景观和药用于一体的多功能花卉,其野生资源远远不能满足市场需要,种球的增殖技术是该类植物产业化开发的关键。利用组织培养技术快速繁殖石蒜属植物优质种苗是目前尽快满足市场需求的有效途径,组培技术是种质保存(超低温保存)、诱变育种及遗传转化的基础。有关石蒜属植物的遗传工程研究已有少量报道,虞剑平等[47]使用农杆菌将nos基因转入石蒜花茎幼嫩部位,并成功检测到胭脂碱,但相关的转基因研究未见报道,仅有部分遗传分析和基因表达的研究[48-50]。在百合等其他球根花卉上的基因标记分类、基因表达和获得转基因植株等方面已有较为深入的研究[51-52],这也是日后石蒜属植物研究的方向之一,而建立完善的组培再生体系是石蒜属植物遗传转化研究的基础。基于石蒜属植物可用于药物开发的巨大前景,加快其组织培养技术和工厂化育苗体系的建立,可促进药用植物资源的规模化和标准化生产。今后在石蒜属植物组培的研究中应积极开展组培未获成功种的探索,在外植体选择上不局限于常见的石蒜外植体,通过改变消毒方法和培养条件,同时在植物生长调节剂种类与浓度配比上进行更深入的研究,以提高石蒜属植物组培的成功率和增殖系数。通过更加深入的石蒜组培体系研究,加速石蒜属植物组培快繁体系的建立、完善和优化,为其产业化开发奠定基础。
