青稞品种‘喜马拉22号’小孢子培养植株再生体系的建立
2021-08-28郭桂梅宗营杰张述伟杜志钊陆瑞菊王亦菲刘成洪
郭桂梅,宗营杰∗,何 婷,张述伟,杜志钊,陆瑞菊,王亦菲∗∗,刘成洪
(上海市农业科学院生物技术研究所∕上海市农业遗传育种重点实验室,上海201106;上海市农业科技服务中心,上海200335)
青稞是我国西藏地区居民的主要食粮,同时还是优良的饲料和酿酒原料,在农业生产中具有重要地位[1]。青稞优良品种的选育关系到我国边疆地区的粮食安全,具有较为重要的社会经济效益[2-3]。青稞作为一种可食用的裸大麦,具有“三高两低”(蛋白质、膳食纤维、维生素含量高;脂肪、糖含量低)的特点,同时还富含β-葡聚糖和黄酮类功能性成分,具有很好的营养保健价值[4-6],正由区域粮食作物转向全球健康食源作物[7]。‘喜马拉22号’由西藏自治区日喀则市农业科学研究所选育[8],具有高产、耐逆抗倒、耐旱耐湿等特点,是春青稞良种中产量较高的品种,也是近年来青稞育种中的重要亲本来源之一。
青稞生产中存在品种更换周期长、老品种混杂退化严重、优异种质资源匮乏等问题[3,9-10],应用小孢子培养技术可以快速纯合、稳定优良基因,加快青稞育种进程[11-13]。目前青稞的花药培养和小孢子离体培养已在一些青稞材料上获得成功[14-17],但小孢子培养存在基因型依赖性,不同青稞材料的培养反应特性差异较大,‘喜马拉22号’作为西藏自治区主栽青稞品种,还未见小孢子培养研究成功的报道。本研究对‘喜马拉22号’游离小孢子培养中的多个环节进行研究,包括供体植株的种植与春化处理、愈伤组织的诱导及分化、再生植株倍性的鉴定及移栽等,以期建立其小孢子培养再生植株体系,为以后青稞的遗传改良提供单倍体快速育种技术支撑。
1 材料与方法
1.1 材料
‘喜马拉22号’种子由西藏自治区农牧科学院农业科学研究所曾兴权博士提供。2018年11月种植于上海市农业科学院南门大田中,2019年春季参照郭桂梅等[18]方法进行取材、修剪及低温处理。
1.2 春化处理
试验种子于28℃浸泡6 h后催芽过夜,穴盘种植,3 d后,将幼苗移入5℃冰箱,弱光照(通过冰箱玻璃透明门提供的自然光),处理37 d后,移栽大田。田间直播材料作为对照组。
1.3 小孢子培养方法
选取5℃低温处理2—3周的青稞穗,剥去叶鞘,参考郭桂梅等[18-19]方法进行消毒、收集游离小孢子。19 d后称取愈伤组织质量并将愈伤组织转入分化培养基,25℃、12 h光照培养,进行绿苗统计及壮苗生根培养。
选择根系发达的再生植株,移出壮苗生根培养基,去除黄叶后在Hoagland营养液中进行水培炼苗,获得生长健壮植株。同时对水培苗进行染色体倍性鉴定与加倍处理(单倍体植株幼苗剪根,用0.2%秋水仙碱+2%二甲基亚砜浸泡,20℃暗处理12 h),提高其二倍化率。炼苗3—4周后加倍单倍体(Double haploid,DH)植株送往云南昆明基地加代种植,收获DH株系种子。
1.4 提取液和培养基的配制
诱导培养基以N6为基本培养基,添加0.5 mg∕L KT、0.4 g∕L水解干酪素、1.6 g∕L谷氨酰胺及0.976 g∕L MES,pH 5.8,用0.22μm膜过滤灭菌。麦芽糖设置60 g∕L、75 g∕L、90 g∕L、105 g∕L和120 g∕L 5种浓度,2,4-D设置0.5 mg∕L、1.0 mg∕L、1.5 mg∕L和2.0 mg∕L 4种浓度。
提取液、分化培养基和壮苗培养基成份及灭菌方法均参照郭桂梅等[20]方法。
1.5 生长统计指标
愈伤组织产量:每皿小孢子培养19 d时产生的愈伤组织质量,用“mg”表示;绿苗产量:每皿愈伤组织分化出的绿苗数,用“株”表示;绿苗再生能力:每100 mg愈伤组织分化出的绿苗数,用“株”表示。
1.6 倍性鉴定
选用第3片叶的中部,长度3—4 cm,放入卡诺氏固定液(无水乙醇∶冰乙酸=3∶1,V∕V)中,浸泡至叶片完全褪色,在蒸馏水中漂洗后置于400倍显微镜下测量叶片下表皮气孔保卫细胞长度,每叶片随机统计10个细胞,取平均值。
每棵苗剪取3条根尖,长度1—2 cm,放入预冷的90%冰醋酸中,放置10 min后取出,用吸水纸吸干,放入70%乙醇中,-20℃保存放置。45%冰醋酸中解离制片,每个片子至少观察5个分裂相。
1.7 田间调查
考察大田种植的‘喜马拉22号’株高、分蘖、穗长、穗粒数、瘪粒数、单株产量及千粒重等农艺性状,千粒重测定重复3次,其余均重复5次。穗密度=穗粒数∕穗长;结实率=(穗粒数-瘪粒数)∕穗粒数×100%。
1.8 数据处理
采用Excel 2010、DPSv7.05软件进行数据处理与分析。
2 结果与分析
2.1 春化处理对小孢子愈伤组织诱导的影响
春化处理组单皿小孢子培养诱导愈伤组织的产量均高于对照组。对照组单皿愈伤组织产量均值为33.27 mg,春化处理后其愈伤组织产量提高了1倍,达到66.57 mg,两个处理间存在极显著差异。
2.2 诱导培养基中麦芽糖浓度对小孢子培养愈伤组织诱导的影响
由图1可知,麦芽糖质量浓度在90 g∕L和105 g∕L时小孢子愈伤组织产量显著提高,其中麦芽糖质量浓度为90 g∕L时,愈伤组织产量最高(57.12 mg)。
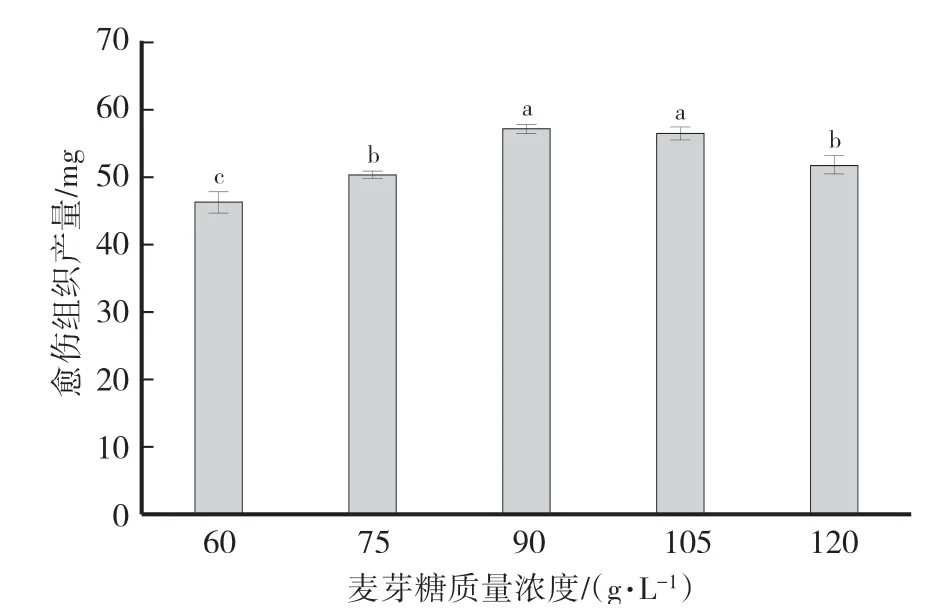
图1 诱导培养基中麦芽糖浓度对愈伤组织诱导的影响Fig.1 Effects of maltose concentration in induction medium on the yields of callus
2.3 诱导培养基中2,4-D浓度对小孢子培养愈伤组织诱导的影响
由图2可知,2,4-D质量浓度为1.5 mg∕L时,愈伤组织产量诱导最高,达56.50 mg,与其他浓度处理存在显著差异。
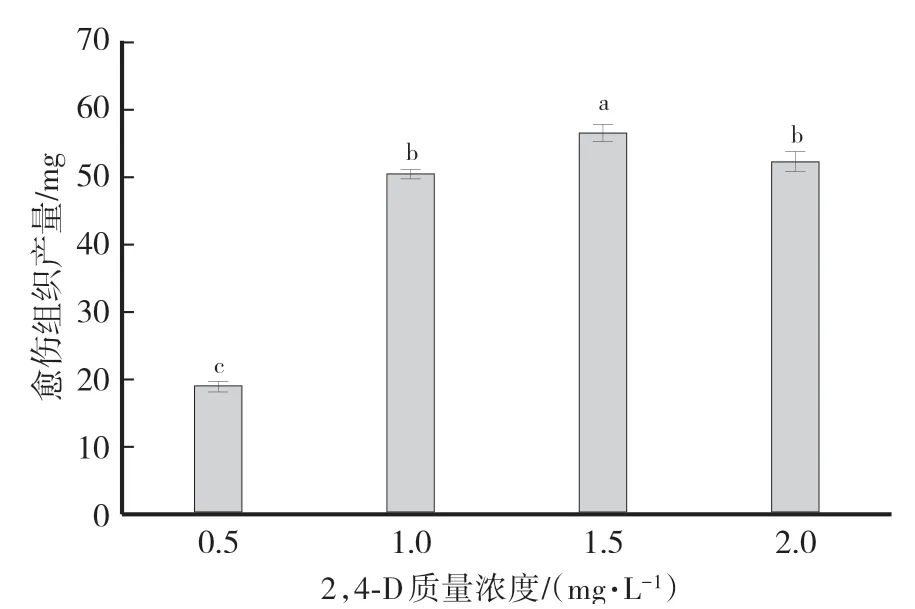
图2 诱导培养基中2,4-D浓度对愈伤组织诱导的影响Fig.2 Effects of 2,4-D concentration in induction medium on the yields of callus
2.4 小孢子植株的再生、生根与移栽
在优化后的愈伤诱导条件下,成功获得青稞‘喜马拉22号’游离小孢子胚性愈伤组织和分化绿苗,平均每皿可以诱导出92.3 mg愈伤组织,平均每皿愈伤组织能分化出56.5株绿苗,平均每100 mg愈伤组织能分化出60.9株绿苗。当分化苗长至1.5—2.0 cm高时,及时转移至生根壮苗培养基上,4周后将再生植株经过水培炼苗后移栽至盆钵(图3)。

图3 小孢子培养愈伤组织诱导及植株再生Fig.3 Callus induction and plants regeneration of isolated microspore culture
2.5 小孢子再生植株的倍性鉴定
对56株小孢子来源的‘喜马拉22号’再生植株进行染色体倍性镜检,单倍体为7条染色体(n=7),二倍体为14条染色体(2n=14),四倍体为28条染色体(2n=28)(图4)。56株再生植株中3株为单倍体植株,占5.4%;32株为二倍体植株,占57.1%;21株为四倍体植株,占37.5%。

图4 不同倍性的小孢子再生植株的染色体镜检(400×)Fig.4 Chromosomal microscopy of microspore regeneration plants with different ploidy
测量‘喜马拉22号’小孢子培养获得的56株再生植株和20株种子苗叶片保卫细胞长度,发现单倍体叶片保卫细胞长度为36.71—39.93μm,二倍体叶片保卫细胞长度为42.29—60.38μm,四倍体叶片保卫细胞长度为59.98—93.49μm(图5)。其均值长度呈正态分布,单倍体叶片保卫细胞长度平均值为38.83μm,二倍体平均值为51.94μm,四倍体平均值为71.18μm,种子苗平均值为57.13μm(图6)。

图5 小孢子再生植株的单倍体、二倍体、四倍体的保卫细胞Fig.5 The guard cells of monoploid,diploid,and tetraploid from the microspore regeneration plants
2.6 大田适应性
试验表明,青稞‘喜马拉22号’在上海地区种植能正常完成整个生育期,且其籽粒结实率在97%以上;春化处理与对照组在株高、穗密度和单株产量上均存在显著性差异(表1)。

表1 上海地区种植的‘喜马拉22号’的农艺性状Table 1 Agronomic character of field grown locally in Shanghai of‘Himala 22
3 讨论与结论
春青稞‘喜马拉22号’适宜在西藏自治区海拔4 300 m以下中高肥水农田种植,在上海地区也能正常完成生育期,但在两地种植植株的一些基本农艺性状有一定差异[8]。如在西藏地区种植时,‘喜马拉22号’全生育期134 d,株高94.7 cm,穗长6.02 cm,平均穗粒数53.6粒,平均千粒重42.9 g;而在上海地区种植时,春化处理和对照组其全生育期分别为217 d和194 d,株高分别为121.6 cm和105.5 cm,穗长分别为6.9 cm和8.0 cm,平均穗粒数分别为82.8粒和81.6粒,平均千粒重分别为49.1 g和48.2 g。其差异可能是因种植方式和生产条件的不同所致。
本研究发现,春化处理更利于春青稞‘喜马拉22号’游离小孢子愈伤组织的形成,其原因可能是低温条件可促进花芽的形成和花器官的发育[21-22],诱导体内核酸蛋白质代谢发生变化,改变体内激素水平、酶活性及DNA甲基化等[23-24]。小孢子供体植株低温预处理对象主要是幼穗,目前,关于在幼苗期进行低温预处理的报道较少,刘成洪等[17]认为,幼苗10℃低温处理1个月可以提高愈伤和绿苗产量。麦芽糖在诱导培养基中不仅可作为碳源,还可以调节诱导培养基的渗透压,对小孢子的孢子体启动起着重要作用;激素2,4-D有利于小孢子的脱分化启动,因此,麦芽糖和2,4-D的浓度是否合适对小孢子培养成功与否十分关键[16]。本研究发现,诱导培养基中麦芽糖质量浓度为90 g∕L时和2,4-D质量浓度为1.5 mg∕L时可显著增加愈伤组织产量。
花药∕小孢子再生植株的倍性可以通过叶片保卫细胞长度来确定[25-28],而根尖染色体制片计数是经典的植株倍性鉴定方法。本研究表明:‘喜马拉22号’单倍体和二倍体(加倍单倍体)的界限值为40μm,比大麦上的界限值37μm略大[27],这可能和研究群体的大小和叶龄有关。‘喜马拉22号’小孢子再生植株的倍性鉴定结果表明,相比大麦小孢子再生植株,其单倍体比例较低,四倍体比例较高,这与青稞材料小孢子培养中自发加倍的频率有关。而青稞小孢子再生植株叶片保卫细胞长度的分布、自发加倍频率与前期大麦的研究结果之间存在差异的原因还有待于进一步研究。
