气相色谱-串联质谱法测定干辣椒中50种农药残留
2021-08-26杨晓凤
陈 敏, 刘 茜, 杨晓凤
(1. 四川省农业科学院 分析测试中心,成都 610066;2. 四川省农业科学院 农业质量标准与检测技术研究所,成都 610066)
干辣椒是红辣椒Capsicum annuumL.经过自然晾晒、人工脱水等过程而形成的辣椒产品,又称作辣椒干、干制辣椒等,是世界上用量最大的调味品。干辣椒的营养价值很丰富,不仅富含生物活性物质辣椒素,还含有多种维生素、膳食纤维、有机酸、钙、磷等[1-3]。2017年,中国干辣椒产量世界排名第三 (占比6.79%,印度第一,占比45.31%),出口量世界排名第二,与排名第一的印度相比存在较大差距 (印度出口量占比55.18%,中国占比21.06%)[4]。究其原因,无论是辣椒品种、产品质量、价格中国都不具备优势[4]。影响产品质量的一个重要因素就是农药残留问题。如:邹钦培等[3]对2016—2017的某市加工型辣椒农药残留状况作了分析,发现辣椒制品比新鲜辣椒检出率高,达到20.67%,郇志博[2]对2016年南方5省150份青辣椒的14种农药残留做了监测分析,农药检出率为58.0%,不合格率47.3%。农药残留问题不仅影响辣椒产业的良性发展,同时也威胁人类的生命健康安全。
关于干辣椒,中国制定了66项农药最大残留限残留量 (MRL) 标准,国际食品法典委员会(CAC)制定了78项,印度制定了7项[5-7]。中国制定的66项MRL标准中,有14项是临时限量且未指定检测方法,有28种农药指定用气相色谱-串联质谱法检测。本研究整合了CAC、中国、印度关于干辣椒的农药残留标准,通过气相色谱-串联质谱建立了一种快速、高效、准确地检测干辣椒中50种农药残留量的方法,包括GB 2763—2019里指定了气相色谱-质谱联用检测方法的28种农药、未指定检测方法的8种农药 (苯菌酮、氟吡菌胺、氟唑菌酰胺、吡噻菌胺、敌草腈、乐果、氯虫苯甲酰胺、溴氰虫酰胺)、指定了液相色谱-串联质谱检测方法的4种农药 (噻虫嗪、噻嗪酮、啶酰菌胺、嘧菌酯),以及CAC和印度有MRL标准而中国无MRL标准的10种农药 (甲萘威、毒死蜱、甲基毒死蜱、灭多威、甲霜灵、灭线磷、三氯杀螨醇、硫丹、三唑磷、喹硫磷)。上述干辣椒中50种农药在中国及其他国家的限量值情况见表1。
1 材料与方法
1.1 材料与试剂
干辣椒空白样品为本单位委托检测样品,不含目标物。
乙腈、正己烷和丙酮 (色谱纯,Fisher chemical);乙酸乙酯和甲苯 (色谱纯,TEDIA);氯化钠 (分析纯,西陇科学股份有限公司)。
氟吡菌胺等50种农药标准品 (1 000 mg/L,天津农业部环境质量监督检验测试中心),详见表1。
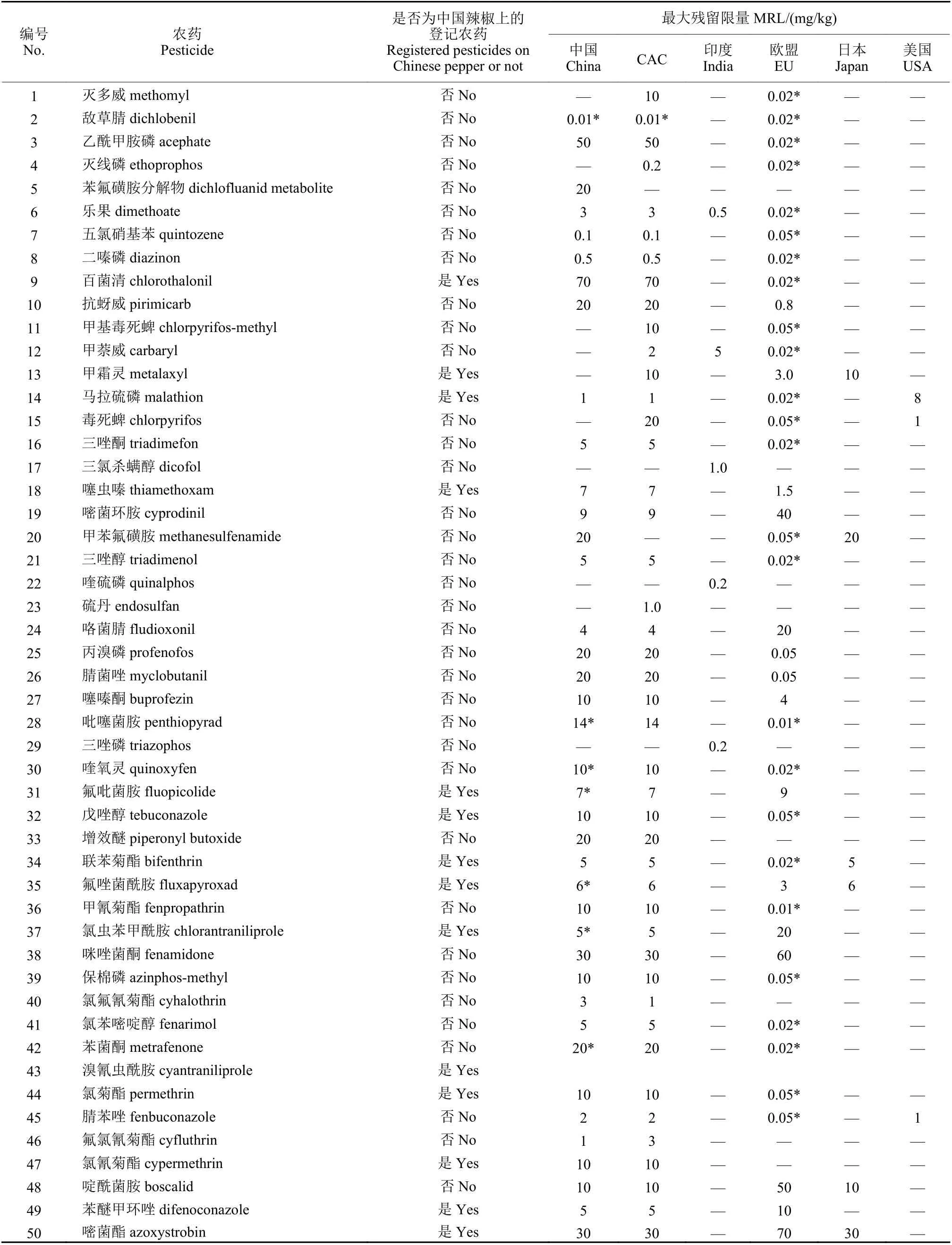
表1 干辣椒中待测50种农药残留限量标准Table 1 The MRLs of 50 pesticides in dry chilli
1.2 主要仪器
TQ8040气相色谱-串联质谱仪 (日本岛津公司);T-18 数显高速匀浆机 (德国IKA公司);R-210旋转蒸发仪 (BUCHI公司);HCB602H电子天平(0.01 g,艾德姆衡器 (武汉) 有限公司);朗赋HT2500多管旋涡混合仪 (上海朗赋实业有限公司);Neofuge 18R 高速冷冻离心机 (上海力申科学仪器有限公司)。
1.3 样品前处理
样品制备:依照GB 2763—2019规定的调味料制样方法[7]:准确称取500 g干辣椒,全果去柄,粉碎后混匀,于−18 ℃保存,备用。
样品提取:准确称取2.0 g (精确至0.01 g) 干辣椒样品于50 mL塑料离心管中,加入6 mL水涡旋混匀,静置30 min;加入20 mL乙腈,匀浆2 min后加入5~6 g氯化钠,剧烈振荡1 min后于4 200 r/min下离心5 min;准确吸取5.00 mL上清液,待净化。
样品净化:用5 mLV(乙腈) :V(甲苯) = 3 : 1混合溶液活化复合氨基柱后,将待净化上清液分两次上样,用250 mL梨形瓶收集液体;用25 mLV(乙腈) :V(甲苯) = 3 : 1混合溶液分5次淋洗复合氨基柱,并收集淋洗液;将所有收集到的液体在40 ℃下浓缩至近干,用乙酸乙酯定容至1 mL,即为空白基质溶液,待测。
1.4 仪器检测条件
色谱条件:HP-5 MS色谱柱 (30 m × 0.25 mm,0.25 μm);载气为氦气 (纯度99.999%);流速1.0 mL/min;进样口温度250 ℃;程序升温:初始
温度50 ℃保持1 min,以25 ℃/min的速率升至200 ℃,再以5 ℃/min的速率升至300 ℃保持5 min;进样量1 μL。
质谱条件:电子轰击离子源 (EI源);传输线温度300 ℃;电离能量70 eV;离子源温度230 ℃;溶剂延迟时间4 min;多反应监测模式 (MRM)。
1.5 标准溶液配制及标准曲线绘制
混合标准储备液:将50种农药标准品分成两组,分别准确吸取1.00 mL于50 mL容量瓶中,用乙腈定容,配制成每种化合物质量浓度为20 mg/L的2组混合标准储备液。于 −18 ℃避光密封保存,备用 (有效期3个月)。
混合标准中间液:准确吸取20 mg/L的两组混合标准储备液各5.00 mL,用乙腈定容至10 mL,配制成质量浓度为10 mg/L的混合标准溶液,逐级稀释为质量浓度分别为5.0、2.0、1.0、0.5、0.2和0.1 mg/L的混合标准中间液。于0 ℃避光密封保存,备用 (有效期1个月)。
基质匹配标准工作溶液:分别准确吸取50 μL质量浓度为0.1、0.2、0.5、1.0、2.0、5.0和10.0 mg/L的混合标准中间液于进样瓶中,加入950 μL空白基质溶液,混匀,配制成质量浓度分别为0.005、0.01、0.025、0.05、0.1、0.25和0.5 mg/L的系列基质匹配标准工作溶液,现配现用。
吸取上述基质匹配标准工作溶液,按1.4节的条件测定。以待测化合物定量离子的峰面积 (y) 为纵坐标,以质量浓度 (x) 为横坐标,非强制过原点,制作标准曲线,得到50种农药的线性方程和决定系数。
1.6 基质效应
基质效应 (Me) 指基质对分析物分析过程的干扰和影响。按公式 (1) 计算。
其中:B为基质匹配标准溶液响应值;A为纯溶剂配制的标准溶液响应值。
当Me在 −20%~20%时为弱基质效应;当Me在 −50%~−20%或20%~50%时为中等基质效应;当Me> 50%或Me< −50%时为强基质效应[8]。
2 结果与讨论
2.1 色谱柱的选择和质谱条件的优化
比较了HP-5 MS色谱柱和TG-35 MS色谱柱对50种农药响应值的影响。结果发现:酰胺类和菌胺类物质在TG-35 MS色谱柱上响应差,而在HP-5 MS色谱柱上响应均较好,故选择HP-5 MS色谱柱。
吸取质量浓度为5 mg/L 的50种农药的单一标准溶液,分别采用全扫描模式进行扫描,并通过谱库对比确定每种农药的保留时间,选择响应值较高且质量较大的2~3个母离子进行碎片离子扫描,选择丰度值大且特征性强的碎片离子作为其子离子,然后通过能量优化确定离子对的能量,每种农药确定3对离子对。选择响应较强的2对离子对,其中响应最强的作为定量离子对,另外一对作为定性离子对。
吸取质量浓度为0.1 mg/L 的50种农药的基质匹配标准工作溶液,采用优化后的MRM参数测定。结果发现:乙酰甲胺磷的离子对136 > 94,噻嗪酮的离子对175.1 > 132.1和175.1 > 117.1,保棉磷的离子对160 > 77和160 > 132,因基质干扰不能积分,故乙酰甲胺磷选用136 > 42离子对定量,噻嗪酮选用190 > 175、249 > 193离子对,保棉磷选择132 > 77和160 > 104离子对。优化后的50种农药的GC-MS/MS信息如表2所示。优化条件下典型图谱如图1所示。
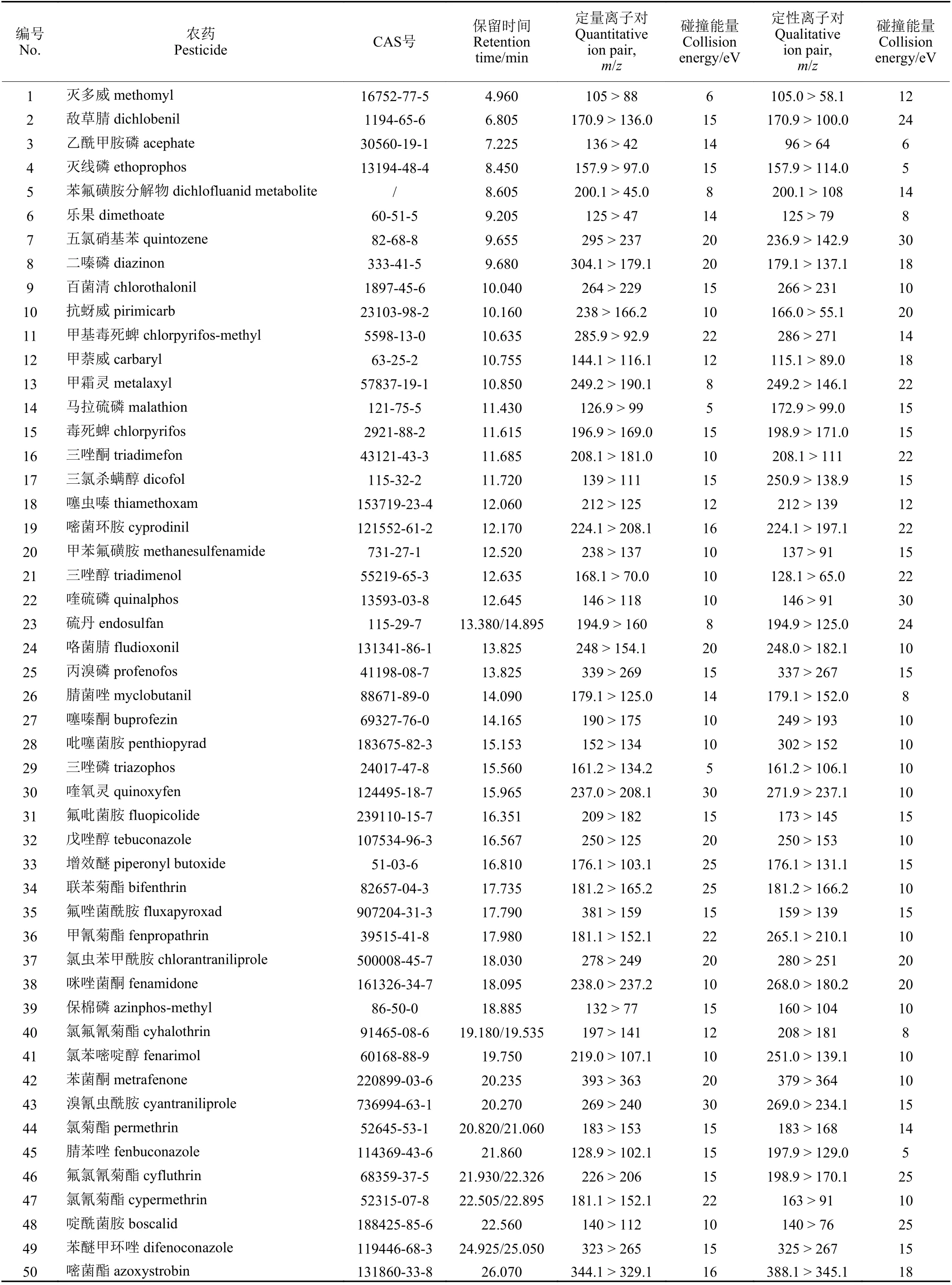
表2 50种农药的GC-MS/MS信息Table 2 GC-MS/MS information of 50 pesticides
2.2 样品前处理条件的优化
2.2.1 提取溶剂的选择 干辣椒基质复杂,富含维生素、有机酸、色素。为消除基质效应,在添加水平0.1 mg/kg条件下比较了丙酮、乙酸乙酯和乙腈3种提取溶剂对提取效果的影响。结果 (图2)发现:当以乙腈为提取溶剂时,大多数的农药回收率在90%~105%之间,且提取率均比丙酮和乙酸乙酯高,故选择乙腈作为提取剂。
2.2.2 称样量的选择 称样量的多少会影响试剂用量、后期净化效果及灵敏度的高低,称样量过多,试剂用量多,净化效果差,但灵敏度高,反之,称样量少,试剂用量小,净化效果相对较好,但灵敏度相对较低[9]。兼顾耗材成本、净化效果及灵敏度3个因素,比较了称样量分别为2.0、2.5和5.0 g时对净化效果的影响。结果发现:只有当称样量为2.0 g时,复合氨基柱净化后色素才基本除尽,且灵敏度可以达到检测要求,故称样量选择2.0 g。
2.2.3 净化方法的选择 依据23200.113—2018标准[10],通过对比试验分析了QuEChERS和固相萃取法两种净化方式对回收率和净化效果的影响。其中固相萃取净化按1.3节对样品进行前处理,按1.4节的条件测定。QuEChERS净化按23200.113—2018标准的7.1.3节香辛料方法进行前处理[10]。称取2.0 g (精确到0.01 g) 干辣椒样品于50 mL塑料离心管中,加入10 mL水涡旋混匀,静置30 min;加入16 mL乙腈、6 g无水硫酸镁、1.5 g醋酸钠及一颗陶瓷均质子,以4 200 r/min离心5 min;取8 mL上清液加入到含有1 200 mg硫酸镁、400 mg PSA、400 mg C18及200 mg GCB的15 mL塑料离心管中,涡旋混匀1 min后以4 200 r/min离心5 min;吸取2 mL上清液氮吹至近干,用乙酸乙酯定容至1 mL,过0.22 μm有机微孔滤膜,按1.4节的条件测定。两种方法的添加水平均为0.01、0.1和1.0 mg/kg,另设空白对照。
结果 (图3) 发现:从净化效果看,固相萃取法的净化效果明显优于QuEChERS法,原因可能是QuEChERS法在浓缩残留农药的同时也浓缩了杂质[11]。从回收率看,固相萃取法中50种农药的回收率均可满足检测要求,而QuEChERS法中敌草腈、苯氟磺胺、五氯硝基苯、百菌清、嘧菌环胺、喹氧灵、氯虫苯甲酰胺和溴氰虫酰胺的回收率不能满足检测要求,且大多数农药的固相萃取法回收率较QuEChERS法高,故选择固相萃取法净化样品。
2.3 方法的线性范围、定量限及基质效应
结果 (表3) 表明:50种农药中,除甲苯氟磺胺、苯氟磺胺、保棉磷和溴氰虫酰胺外,其他农药在0.005~0.5 mg/L质量浓度范围内线性关系良好 (R2≥ 0.99)。而甲苯氟磺胺因为基质干扰,在0.05~0.5 mg/L质量浓度范围内线性关系良好,三氯杀螨醇和苯氟磺胺因不稳定,只能检测出其分解物,其中,苯氟磺胺的分解物只在0.005~0.2 mg/L范围内线性关系良好。以10倍信噪比计算方法的定量限LOQ,干辣椒中50种农药的定量限范围为0.01~0.1 mg/kg。50种农药中,40种农药为强基质效应,2种农药为弱基质效应,8种农药为中等基质效应。

表3 50种农药在干辣椒中的线性方程、决定系数、基质效应及定量限Table 3 Linear equation, coefficient of determination, matrix effects, and limits of quantitation of 50 pesticides in dry chilli
2.4 方法的准确度与精密度
向空白干辣椒样品中添加0.01、0.1和1.0 mg/kg 3个水平的50种农药混合标准溶液。每个水平重复5次,计算回收率及相对标准偏差 (RSD)。结果(表4) 表明:50种农药的回收率为72%~120%,RSD为0.7%~17%,基本满足农药残留检测的要求[12]。

表4 50种农药在干辣椒中的平均添加回收率和相对标准偏差Table 4 Average recoveries and relative standard deviations (RSD) of 50 pesticides in dry chilli
2.5 实际样品测定
应用本研究建立的方法对采自成都市区及其周边农贸市场、超市、批发市场 (产地来源于云南、四川、贵州、河南、新疆、山东、印度) 的干辣椒样品共99份进行了检测。结果 (表5) 显示:99份干辣椒样品中,有21份未检出任何农药 (低于该农药定量限),占总样品量的21.2%;有22份检出1种农药,占总样品量的22.2%;另外56份均检出2种以上的农药,其中检出5种以上农药的样品有32份,占总样品量的32.3%。在99份干辣椒样品中,检出率较高的农药有:氯氟氰菊酯 (56份),戊唑醇 (42份),联苯菊酯 (35份),毒死蜱 (31份)。但根据GB 2763—2019[7]的限量要求,以单一农药来看,所有有MRL值且有检出农药的样品均未超过其MRL值,且低于MRL值较多。由此可见,近年来,中国干辣椒质量有较大提高,原因可能是农药在辣椒上施用更加规范,农产品市场监管更加到位[13]。
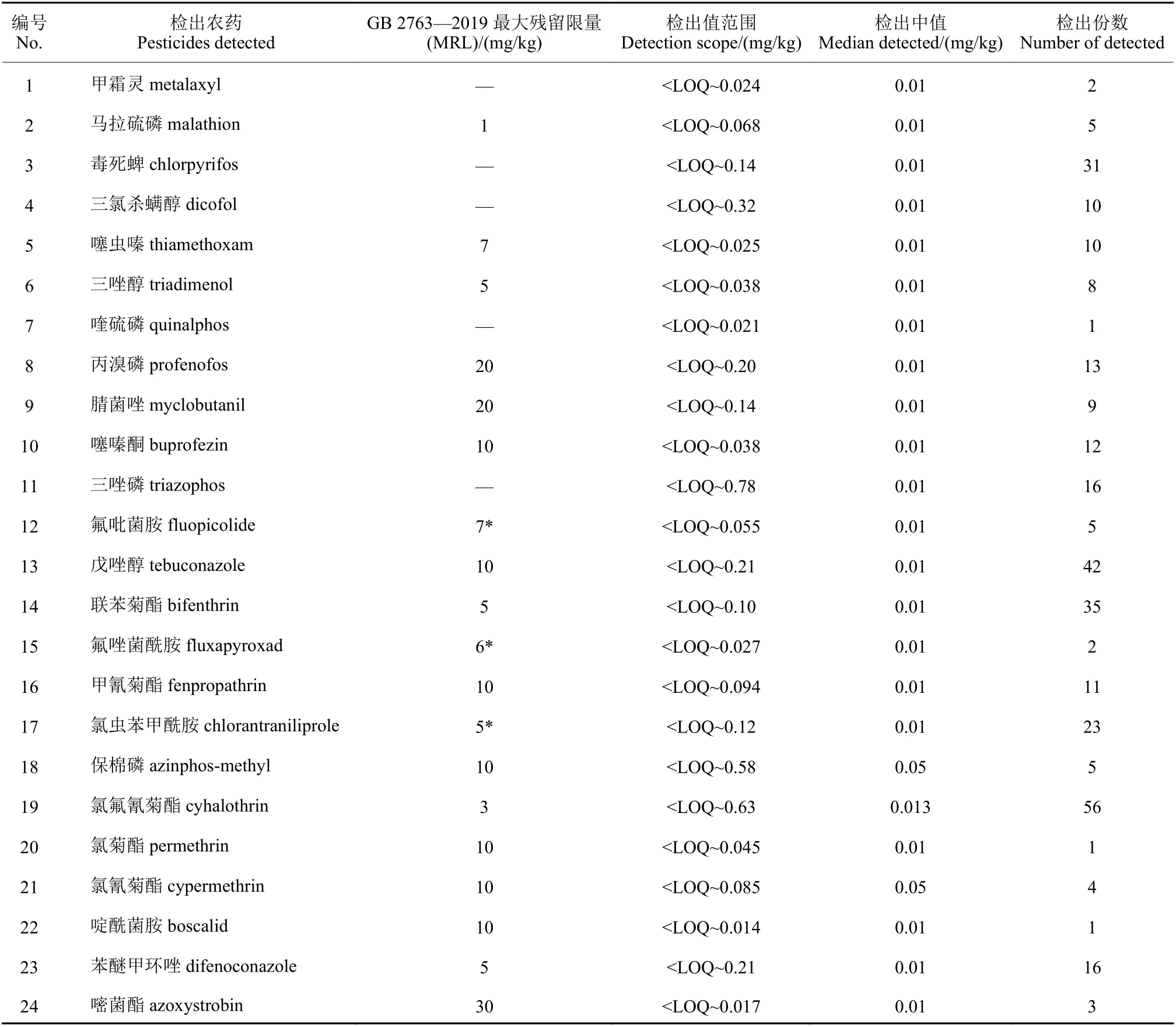
表5 50种农药在99份干辣椒样品中的检出情况Table 5 The determination results of 50 pesticides in 99 dry chilli samples
3 结论
建立了测定干辣椒中50种农药的气相色谱-串联质谱分析方法。干辣椒样品加水浸泡后用乙腈提取,再经氨基-石墨化碳黑固相萃取柱净化,采用气相色谱-串联质谱在MRM模式下检测。该方法的前处理易操作、较环保且高效,灵敏度、准确度、精密度均满足农药残留分析测定要求,可以作为日常检测干辣椒中多农药残留量的方法。
