甲草胺对非靶标生物的毒理学研究进展
2021-08-26欧阳康冯唐奇方国斌许凌风马洪菊
欧阳康, 冯唐奇, 明 坤, 方国斌, 许凌风, 马洪菊*,
(1. 华中农业大学 植物科学技术学院,武汉 430070;2. 第四储备资产管理局 哈尔滨管理站,哈尔滨 150030;3. 湖北省植物保护总站,武汉 430070)
甲草胺 (alachlor) 属于氯乙酰胺类除草剂,是一种选择性芽前土壤处理剂,主要通过抑制超长链脂肪酸延长酶 (very-long-chain fatty acid elongase,VLCFAE) 的活性,从而阻碍超长链脂肪酸 (verylong-chain fatty acid, VLCFA) 的生物合成发挥除草作用,对于出苗前土壤中萌发的杂草具有很好的防治效果,适用于大豆、花生、水稻等作物田防除一年生禾本科及部分阔叶杂草[1]。
甲草胺由美国孟山都公司于1966年研发,1969年商品化,在20世纪70年代被中国引进,并逐步被广泛使用,至20世纪末甲草胺已成为国际上应用最为广泛的除草剂之一[2]。然而,随着甲草胺使用量的增加,其对非靶标生物以及生态环境的影响也越来越受到人们的关注。
甲草胺在大田中的消解途径主要为微生物降解和挥发,其次为光解、化学降解、渗漏、地表径流和被植物吸收等。微生物降解和吸附主要发生在土壤表面,甲草胺一旦进入根区以下,一般降解缓慢。由于甲草胺对土壤的吸附亲和力较低,而在水体中的溶解度较高,并且具有较强的流动性,导致在地表水或地下水中甲草胺常常被检出[3]。有研究报道,氯乙酰胺类除草剂除具有本身特性外,其降解产物毒性更强[4-6]。因此,环境中残留的甲草胺对非靶标生物以及生态环境的潜在风险不容忽视。
自20世纪80—90年代以来,国内外对甲草胺毒理学展开了相关研究,明确了甲草胺在高浓度下具有致畸性及内分泌干扰活性[7-8],因此甲草胺已被部分国家或地区禁用。加拿大农业部宣布自1985年12月31日起,禁止美国孟山都公司除草剂甲草胺的销售[9];日本国立研究所也因为甲草胺具有致畸性及内分泌干扰活性,而将其列入具有内分泌干扰作用的黑名单[10];在2011年6月20—24日,鹿特丹公约第五次会议决定将甲草胺列入《鹿特丹公约》附件三,自2011年10月24日起适用事先知情同意程序[11]。甲草胺原药和制剂在中国多个农药生产厂家仍具有登记,然而,目前关于甲草胺毒理学研究较为零散,缺乏系统性总结与归纳。基于此,本文拟从急性毒性、慢性毒性和氧化应激效应等方面综述甲草胺对非靶标生物的毒性效应(表1),旨在为甲草胺的环境安全评价提供数据资料。
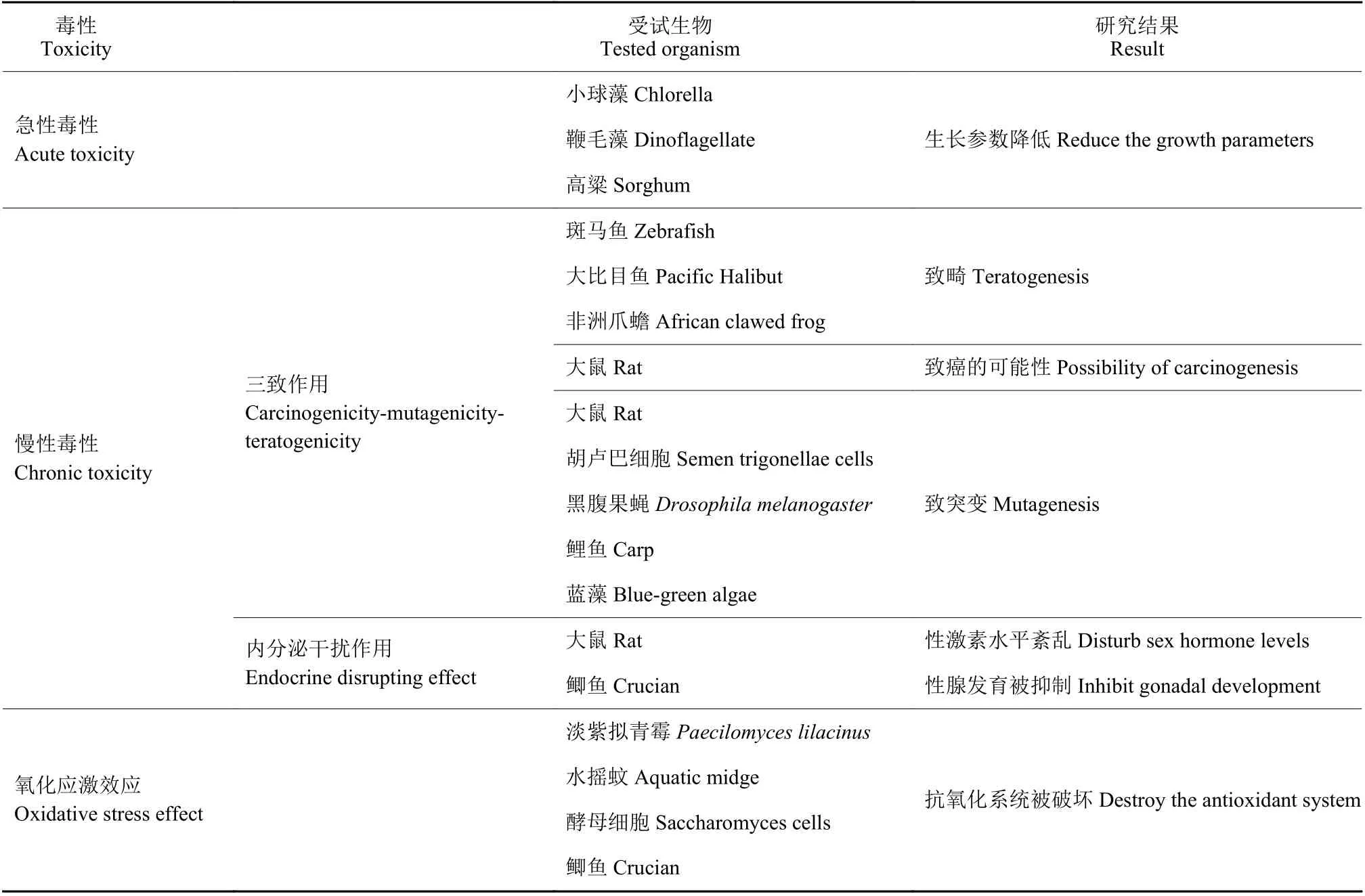
表1 甲草胺对非靶标生物的毒性效应Table 1 Toxic effects of alachlor to non-target organisms
1 急性毒性
藻类是淡水水体中常见的类群,对群落初级生产及富营养水体的净化起着重要作用。甲草胺对藻类生长具有一定的抑制作用。Paule[12-13]等研究了光营养生物膜群落对甲草胺的敏感性,结果发现,群落中藻类细胞的数量和甲草胺浓度呈显著的负相关,甲草胺能显著抑制光营养生物膜的生长。甲草胺对普通小球藻Chlorella vulgaris的96 h的EC50值为5.54 mg/L,当甲草胺的质量浓度为0.8、1.6、3.2、6.4和12.8 mg/L时,抑制率分别为37%、39%、44%、48%和62%;该研究还表明,甲草胺通过影响普通小球藻叶绿素a的含量从而对其生长产生一定的影响[14-15]。甲草胺对鞭毛藻Ostreococcus lucimarinus的72 h的EC50值为0.373 mg/L,随着甲草胺剂量的增加和暴露时间的延长,其光合效率和叶绿素含量显著降低,光合作用相关基因PmpsbA、PmatpB和PmrbcL的转录水平均被显著诱导上升[16]。此外,还有研究发现,甲草胺对马昆德拟青霉菌Paecilomyces marquandii和菲氏弧菌Vibrio fischeri的生长均有抑制作用,其EC50值分别为50.0和72.4 mg/L[17-18]。Hirase等[19]研究发现,2.7 mg/L的甲草胺暴露可显著抑制高粱芽长,抑制率达50%以上。EINahhal等[20]研究发现,甲草胺暴露对甜瓜、苦菜和小麦生长均有抑制作用,其48 h的EC50值分别为11.37、0.11和3.91 mg/kg,表明不同作物对甲草胺敏感性不同。
2 慢性毒性
2.1 致畸、致癌和致突变
畸形 (malformation) 是指发育生物体解剖学上形态结构的缺陷,致畸试验是有毒物质的安全性毒理评价的重要组成部分。Park等[21]研究表明,甲草胺对斑马鱼Danio rerio胚胎具有致畸效应,随着甲草胺暴露质量浓度 (1、3、5、8、10 mg/L)的增加,斑马鱼胚胎孵化率逐渐降低,并出现心包囊水肿、游囊关闭、躯干弯曲等症状。斑马鱼幼鱼在10 mg/L的甲草胺暴露下会出现体型弯曲、水肿以及活动迟缓等形态学异常现象[22]。大比目鱼Hippoglossus stenolepis幼虫在1 mg/L的甲草胺暴露下表现出发育缺陷,包括心包水肿和骨骼畸形[23-24]。此外,还有研究表明,甲草胺对两栖动物的形态发育具有毒性作用。例如:甲草胺对非洲爪蟾Xenopus laevis胚胎具有致畸性,其致畸指数 (teratogenic index, TI) 为1.7[25];1.25、2.5、5和10 mg/L的甲草胺暴露可导致东方铃蟾Bombina orientalis发育畸形,包括躯干弯曲、尾弯、体厚和腹面水疱,其畸形率呈浓度依赖性增加[7]。
美国环境保护署于1984年对甲草胺的风险性开展过全方位评估,通过甲草胺在大鼠上的试验证实了甲草胺对哺乳动物有致肿瘤的可能性[26]。有学者在此基础上对甲草胺的致癌机制展开了进一步研究。Nelson等[27]研究发现,1 mg/mL的甲草胺和小牛胸腺DNA在体外能形成加合物,而DNA加合物的形成是药剂致癌过程的关键一步[28],同时阐明了甲草胺潜在致癌的可能性机制。以甲草胺126 mg/(kg·d) 的剂量持续饲喂雄性大鼠120 d,其甲状腺滤泡上皮出现肥大、肝脏尿苷二磷酸葡萄糖醛酸转移酶活性和血清促甲状腺激素水平显著增加,这些均与大鼠甲状腺肿瘤发病相关[29]。Genter等[30]用260mg/(kg.d)剂量的甲草胺连续3个月饲喂小鼠,发现其嗅觉黏膜形态异常,黏膜内嗜酸性物质明显积累。Genter进一步研究发现,甲草胺能诱导基质金属蛋白酶MMP-2(matrix metalloproteinase 2, MMP-2) 和MMP-9(matrix metalloproteinase 9, MMP-9) 基因表达显著上调,MMP抑制剂能降低经甲草胺处理的大鼠的肿瘤发病率[31]。
甲草胺能诱导生物产生突变。研究发现,甲草胺暴露可导致大鼠和小鼠的骨髓细胞出现染色体损伤,其染色体畸变频率呈剂量依赖性增加[32-33]。甲草胺暴露能导致人外周血淋巴细胞姐妹染色单体交换的频率显著增加和染色体畸变的形成,表明甲草胺会导致人外周血淋巴细胞染色体损伤[34-35]。甲草胺处理后能显著增加胡卢巴Trigonella foenum-graecum细胞染色体畸变率,且其有丝分裂指数呈浓度依赖性降低,表明甲草胺对胡卢巴具有遗传毒性[36]。Torres等[37]研究发现,甲草胺能诱导黑腹果蝇Drosophila melanogaster性状改变,270 mg/L的甲草胺暴露可导致黑腹果蝇翅斑总斑点的频率显著增加。Bonfanti等[38]研究发现,108 mg/L的甲草胺能诱导大鼠肝细胞体外活化,导致DNA损伤。Ribas等[39]对人外周血淋巴细胞进行单细胞电泳 (single cell gel electrophoresis, SCGE) 检测,发现甲草胺暴露可导致人外周血淋巴细胞DNA断裂损伤。鲤鱼暴露于10、25、50和100 μg/L的甲草胺中4 d,其血细胞中DNA链出现断裂,并呈现浓度依赖性增加[40]。虹鳟鱼Oncorhynchus mykiss在1.52、3.44和7.60 μg/L的甲草胺中暴露10 min,其性腺细胞DNA链出现明显断裂,暴露30 min后性腺细胞DNA链断裂较对照组显著增加[41]。此外,甲草胺能诱导蓝藻产生不同类型突变,包括对有毒化学物质耐受性的正向突变、营养缺陷型突变和原生营养体突变[42-43]。
2.2 内分泌干扰效应
多种酰胺类除草剂属于环境内分泌干扰物(environmental endocrine disruptors, EEDs),具有内分泌干扰活性。环境雌激素是一类具有干扰生物体内正常内分泌物质的合成、运输、代谢等过程,从而破坏机体内部稳态的化合物。据报道,甲草胺具有雌激素活性,能与生物体内雌二醇竞争性地结合雌激素受体,进而影响生物正常生命活动[44-45]。以50 mg/(kg·d) 剂量的甲草胺饲喂大鼠30 d后发现,雄性大鼠睾丸和甲状腺的相对质量增加,雌性大鼠卵巢的相对质量下降,雌鼠血浆中甲状腺激素T4和睾酮T的含量显著减少[8]。甲草胺对人类精子的运动也有一定影响,暴露于甲草胺 (0、48、100、240和500 mg/L) 后,活精子率、游动精子率和精子流速均呈浓度依赖性下降[46]。
水环境是很多环境污染物的聚集地,鱼类是用来研究内分泌干扰作用的理想水生生物。低浓度的甲草胺 (250 μg/L) 暴露对鲫鱼Carassius auratus有内分泌干扰作用,可抑制鲫鱼的肝脏和精巢的生长、发育,破坏精巢结构,导致性腺指数和肝指数显著下降;甲草胺暴露还能导致鲫鱼体内的血清雌二醇、促甲状腺激素和甲状腺激素水平显著上升,睾酮水平显著下降,鲫鱼体内雌二醇/睾酮值显著增加,表明甲草胺能显著干扰其体内性激素平衡[47-49]。由此可见,甲草胺可影响非靶标动物生殖细胞正常发育,导致生物体内激素水平的失衡,但其具体致毒机制有待进一步深入研究。
3 氧化应激效应
生物体内氧化和抗氧化作用失衡会导致产生氧化应激,抗氧化剂酶可清除生物体内过量的活性氧自由基,对维持细胞内活性氧平衡和保护机体免受氧化损伤具有关键作用。超氧化物歧化酶(superoxide dismutase, SOD) 和过氧化氢酶 (catalase,CAT) 是生命体应对氧化应激的第一道防线,其活性的变化可作为诱导氧化应激的生物标志。研究表明,用50 mg/L的甲草胺处理淡紫拟青霉Paecilomyces lilacinus48 h,该霉的SOD和CAT活性显著降低,处理96 h后其CAT活性被诱导升高[50]。5和50 mg/L的甲草胺暴露可显著抑制莴苣和豌豆种子中SOD和CAT活性,但莴苣和豌豆叶片经5 mg/L的甲草胺处理后,其SOD和CAT活性显著增加,表明莴苣和豌豆种子较叶片对甲草胺更为敏感[51]。Kim等[52]研究发现,单角轮虫Brachionus koreanus暴露于300 μg/L的甲草胺24 h后,体内总SOD蛋白酶的活性显著降低,Bk-Cu/Zn-SOD转录水平显著上调,而Bk-Mn-SOD转录水平较对照无显著差异。谷胱甘肽S-转移酶(glutathioneS-transferase, GST) 是参与宿主细胞解毒的关键酶。Jin-Clark等[53]研究发现,1 mg/L的甲草胺暴露使水摇蚊Chironomus tentansGST的总活性降低50%,乙酰胆碱酯酶 (acetylcholine esterase, AChE) 活性降低30%。将水摇蚊暴露于1、10、100和 1 000 μg/L的甲草胺72 h,其体内GST活性呈浓度依赖性降低,在100和1 000 μg/L处理组中,GST的活性分别降低了65.5%和73.5%,进一步研究发现,CtGSTs2和CtGSTs3的转录水平和甲草胺的暴露浓度呈显著正相关[54]。将酿酒酵母暴露于400 mg/L的甲草胺,其细胞内活性氧含量显著增加,谷胱甘肽的产生受到抑制,而其利用率却显著增加,表明谷胱甘肽在保护细胞免受甲草胺侵害方面具有重要作用[55]。低浓度的甲草胺持续暴露也能导致生物体内产生氧化应激效应。持续低浓度 (1、4、16 μg/L)的甲草胺暴露60 d会对鲫鱼肝脏谷胱甘肽 (glutathione, GSH)、解毒代谢关键酶GST和尿苷二磷酸葡萄糖醛酸转移酶产生干扰[56]。在0.175 mg/L的甲草胺中暴露30 d,尼罗罗非鱼Oreochromis niloticus的血清、脑和肾脏中AChE和GST的活性均显著增加,并出现了轻微的组织损伤[57]。
甲草胺暴露可导致生物体内活性氧自由基的积累,即使在安全剂量下,甲草胺也能诱导生物体内产生氧化应激,导致体内氧化与抗氧化作用失衡,干扰相关酶活性,影响生物正常生命活动。生物体内的抗氧化酶活性以及相关基因转录水平的变化有助于对甲草胺暴露后产生的脂质过氧化损伤起到保护作用。
4 其他毒性
甲草胺能抑制生物的生长发育,干扰生物体内能量合成及代谢。甲草胺对游离和固定化蓝藻Cyanobacteria的生长速率均表现出显著的抑制作用,在25 mg/L的甲草胺中暴露8 d,蓝藻的叶绿素a含量、蛋白质含量和异形胞频率均被抑制[58]。淡水鱼庞克雷龙鱼Channa punctata暴露于亚致死浓度 (1.2 mg/L) 的甲草胺中10 d,其体内能量来源糖原和总蛋白质含量均显著降低,相关代谢酶天门冬氨酸氨基转移酶、丙氨酸氨基转移酶和乳酸脱氢酶活性被诱导上升[59]。甲草胺暴露能显著延长豚草条纹叶甲Zygogramma suturalis的发育时间,其种群生长参数和繁殖力均显著降低[60]。
细胞毒性是指化学物质作用于细胞基本结构或生理过程,影响细胞存活、增殖和功能的紊乱等。27 mg/L甲草胺暴露能破坏虹鳟鱼性腺RTG-2和人神经母细胞瘤SH-SY5Y细胞系的细胞质膜完整性[61]。还有研究表明,7.6 μg/L的甲草胺暴露能显著抑制虹鳟鱼性腺RTG-2细胞系活力,其生长率呈浓度依赖性降低[41]。淋巴细胞是白细胞的一种,由淋巴器官产生,是生物体免疫应答功能的重要组成部分。甲草胺对鲫鱼淋巴细胞生长活性的影响呈剂量-效应关系,其抑制中浓度 (IC50)为 27.7 μg/L;当甲草胺的质量浓度大于7 μg/L时,淋巴细胞增殖受到明显抑制,表明其对鲫鱼存在免疫毒性[62]。甲草胺 (54 mg/L) 还能诱导小鼠巨噬细胞系细胞凋亡,进而影响机体对病原体的免疫应答[63]。鲤鱼Cyprinus carpio在2.4 mg/L的甲草胺中暴露28 d,其平均红细胞血红蛋白浓度显著降低,出现贫血状态[64]。
5 总结
杂草苗前防治对田间杂草的控制至关重要。氯乙酰胺类除草剂是目前世界上使用量最多的芽前除草剂,对未出芽杂草具有很好的防治效果,并具有广谱、低残留等特性,被广泛应用于田间防除多种禾本科杂草和阔叶杂草,以乙草胺、丁草胺、异丙甲草胺等为代表的氯乙酰胺类除草剂在中国乃至全球市场占据重要的地位[65-66],然而其带来的生态环境以及人类健康问题也不容忽视。氯乙酰胺类除草剂对哺乳动物急性毒性较低,但是对浮游动物以及低等脊椎动物毒性较高。此外,有研究表明,氯乙酰胺类除草剂 (如乙草胺、丙草胺、丁草胺和异丙甲草胺等) 能导致非靶标生物产生氧化应激和内分泌干扰效应,并具有致畸、致癌的风险[67-69]。然而,不同种类的氯乙酰胺类除草剂对非靶标生物的致毒机制不同,不同生物对其敏感性也不同,如乙草胺可作为雌激素活性物质干扰斑马鱼甲状腺和性腺的发育[70-71],异丙甲草胺可通过干扰雄性大鼠芳香化酶的合成,进而影响类固醇激素的合成[72]。因此,开展酰胺类除草剂对非靶标生物的毒理学研究,比较分析酰胺类除草剂对非靶标生物的毒性差异,对于酰胺类除草剂科学合理使用以及其安全性评价具有重要意义。
本文以甲草胺的毒理学研究为侧重点,系统总结了甲草胺对非靶标生物的毒性效应。综上所述,甲草胺能抑制水生生物的生长发育,造成水生生物的形态异常。此外,甲草胺具有内分泌干扰活性,能干扰生物体内激素的稳态,影响性腺的发育,导致生殖毒性;多项研究证实甲草胺能诱导生物产生突变,并对哺乳动物存在致癌的可能。有关甲草胺对非靶标生物的内分泌系统潜在的致毒机制有待进一步研究;甲草胺在环境介质中的迁移、富集对人类的风险也不容忽视。
