d(G3AG2T3G3AT)体外形成联锁型G-四链体结构和稳定性
2021-08-24付文强
朱 婷,付文强,王 涛
(1.安徽大学 物质科学与信息技术研究院,合肥 230601;2.中国科学院 强磁场科学中心,合肥 230031;3.中国科学技术大学,合肥 230026)
DNA或RNA单链可以折叠形成各种非Watson-Crick配对的核酸高级结构[1],而由富含串联鸟嘌呤碱基(G)的DNA或RNA单链折叠形成的G-四链体是其中最常见的一种高级结构[2],也是目前核酸结构生物学领域研究热点之一。G-四分体平面是形成G-四链体结构的基本单元,平面内G通过Hoogsteen氢键首尾相连[图1(a)][3],两层或两层以上的G-四分体平面通过π-π堆积形成稳定的G-四链体[4-5],并主要由Na+、K+等阳离子稳定[图1(b)][6]。G-四链体核心结构由4条G串联主链支撑,连接各条主链的碱基序列称为loop。生物体内能形成G-四链体结构的潜在序列广泛存在于端粒、致癌基因启动子、非编码DNA以及mRNA的5′/3′ UTR区[7-8]。G-四链体由于在链走向、沟槽宽度、糖苷键构象和loop排列等方面存在差异,从而具有高度的结构多态性[6]。G-四链体的形成与多种人类遗传疾病及癌症相关,故该结构已然成为相关药物研发设计的理想靶标[9]。此外,富含鸟嘌呤的人工合成寡核苷酸序列也能形成G-四链体,具有抗凝血、抗癌、抗HIV等生物学活性[10]。
2001年已报道序列d(G3AG2T3G3AT)在Na+条件下形成联锁型G-四链体(interlocked G-四链体)结构[11],且该结构中含有新型的“V”字形loop(V-shaped loop)[图1(c)]。此外,该G-四链体结构中第四位腺嘌呤碱基(A)与一个G-四分体平面中的G存在氢键作用,形成A·(G·G·G·G)五元(penta)平面。在Na+条件下两条DNA单链形成折叠对称性等同的二聚化G-四链体,且两条链的5′端第一位G相互穿插联锁,并参与对方G-四分体的形成,以此方式形成格外稳定的联锁型G-四链体结构。
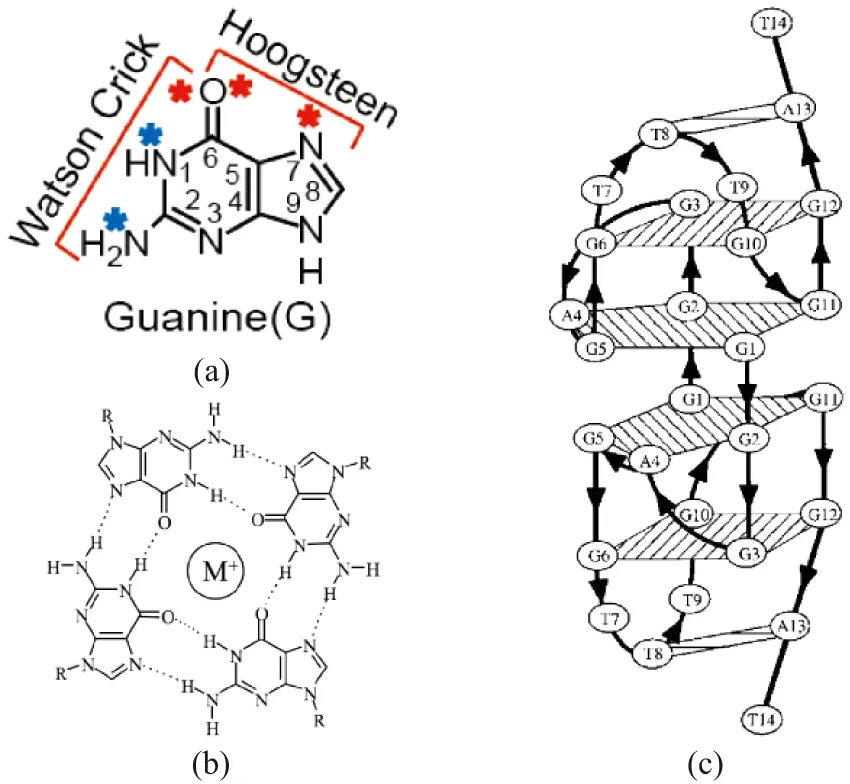
(a)参与形成Watson-Crick和Hoogsteen氢键的鸟嘌呤碱基(蓝色星标为氢键供体,红色星标为氢键受体,数字为鸟嘌呤碱基中对应的原子序号); (b)G-四分体平面(中心为稳定G-四链体结构的一价阳离子); (c)NZ473在20 mmol/L NaPi缓冲液(pH 6.8)、100 mmol/L NaCl中的结构(黑色线条代表DNA主链,箭头代表主链走向,圆圈内为碱基类型及序号)引自参考文献[11]。图1 G-四链体的基本结构Figure 1 Folding topology of G-quadruplexes
本文研究了序列d(G3AG2T3G3AT),被命名为NZ473在Na+和K+条件下形成G-四链体结构的不同特性。首先探讨NZ473在K+条件下如何完成动力学有利结构向热力学稳定结构的转换;其次,通过对比Na+、K+条件下的NMR谱图并结合CD、UV等实验,阐明Na+、K+条件下形成G-四链体的结构、稳定性等方面的差异。
1 材料和方法
1.1 材料
实验所用DNA由生工生物工程(上海)股份有限公司合成,HPLC纯化,并且样品经过超纯水透析。
1.2 方法
所有实验中,K+条件均为20 mmol/L磷酸钾(KPi)缓冲液(pH 6.8);Na+条件均为含100 mmol/L NaCl的20 mmol/L磷酸钠(NaPi)缓冲液(pH 6.8)。磷酸钾(钠)缓冲液(pH 6.8)由相同浓度的磷酸氢二钾(钠)溶液与磷酸二氢钾(钠)溶液按一定的比例混合至其pH值等于6.8制备而成。
1.2.1 核磁共振实验
10%重水样品制备:向超纯水透析后的待测样品溶液中补入10%重水与磷酸盐缓冲液(pH 6.8)。100%重水样品制备:10%重水样品经由NMR检测无误后置于冷冻干燥机上冻干,加入100%重水后用封口膜密封核磁管口。一维谱中样品浓度为0.2~0.4 mmol/L,二维谱中样品浓度约为2 mmol/L。在Bruker Ultrashield Plus 500 MHz核磁共振波谱仪上扫描一维氢谱,在Bruker Ultrashield Plus 600 MHz核磁共振波谱仪上扫描二维谱。
1.2.2 圆二色光谱
取待测DNA样品溶于磷酸盐缓冲液(pH 6.8)中,终浓度为50 μmol/L,在室温(约25 ℃)下扫描得到220~320 nm范围内的CD光谱。实验仪器型号为JASCO J-810,比色皿光路长度为1 mm,扣除相应缓冲液背景得到终谱图。
1.2.3 热稳定性测量
取待测DNA样品溶于20 mmol/L KPi缓冲液(pH 6.8)中,终浓度为60 μmol/L,终体积为550 μL,95 ℃退火,高速离心30 min除去溶液中的气泡后用200 μL石蜡油液封防止受热蒸发。利用可控温的紫外分光光度计扫描记录样品在15 ℃至94 ℃时295 nm波长处的吸光值,升温速度约为0.5 ℃/min,平行测量3次并取平均值作为最终结果。
2 结果与分析
2.1 NZ473在K+、Na+溶液中均能形成联锁型G-四链体
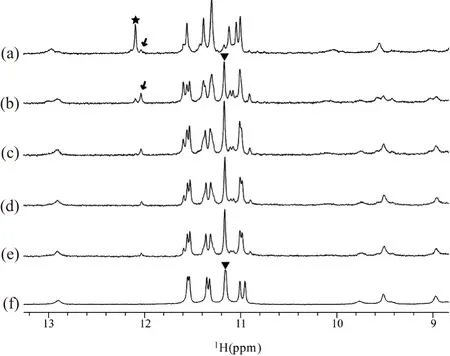
核磁共振(NMR)氢谱中,化学位移10~12 ppm区域通常为G-四链体中参与形成氢键的鸟嘌呤亚氨基(imino)质子出峰区域。若该区域出峰则可初步判定G-四链体结构的形成,因此10~12 ppm被称为G-四链体特征峰区。谱图中9~10 ppm为氨基(amino)质子出峰区域;7~8 ppm为碱基H8/H6/H2质子出峰区域。NZ473是含有3段富含鸟嘌呤串联单元的DNA片段,在钠或钾离子条件下,其一维氢谱中G-四链体特征峰区均能观测到8个鸟嘌呤亚氨基质子尖峰(10~12 ppm区域,图2),说明NZ473在钠、钾离子溶液中都可以折叠形成G-四链体结构,但是这两种离子条件下的NMR谱峰具体分布情况存在差异。在Na+条件下,10~12 ppm区域呈现8根尖峰,9~10 ppm呈现两根明显发宽的小峰[图2(a)],且其谱图不再随时间推移或对样品做进一步退火处理而改变,此时NZ473仅存在单一结构。而在K+条件下,随时间推移及对样品进行不同的孵育处理,NMR谱图中明显出现两套化学位移分布不一致的谱峰,它们分别代表两个不同的结构,见图2(b)~(d)。
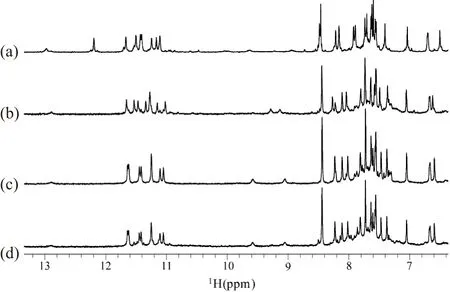
(a)20 mmol/L NaPi、100 mmol/L NaCl中透析后谱图;(b)20 mmol/L KPi fresh状态谱图;(c)20 mmol/L KPi退火后谱图;(d)B中样品置于室温自然放置2 d后谱图。图2 310K、NZ473在不同条件下的NMR谱图Figure 2 Proton NMR spectrum of NZ473 under different conditions at 310 K
NZ473样品具体操作如下:将干粉样品快速溶于含有20 mmol/L KPi (pH 6.8)的10%重水缓冲水溶液中,称此时样品状态为新制备(fresh)。新制备状态时其亚氨基特征峰10~12 ppm区域呈现8根谱峰,氨基质子9~10 ppm区域有两个化学位移接近的谱峰[相差为0.2 ppm,图2(b)]。将此样品室温下自然放置2 d后,另一套新谱峰出现在亚氨基特征峰10~12 ppm区域中,而原来新制备状态下的谱峰几乎完全消失;9~10 ppm氨基质子区的2根谱峰也因化学位移差距明显变大而分散开[现在约0.6 ppm,图2(d)]。并且对NZ473新制备样品进行退火处理后的谱图[图2(c)]与直接室温放置2 d后的谱图[图2(d)]几乎完全一致,说明二者代表同一种G-四链体结构。这表明在K+条件下,NZ473存在动力学速度有利和热力学稳定两种结构的平衡。新制备状态时NZ473在K+溶液中首先呈现的结构因其形成快速,但存在时间相对较短且稳定性相对较差,故称其为动力学有利结构[图2(b)]。样品经过缓慢退火或室温长时间放置等操作形成的结构统称为热力学稳定结构[图2(c)和(d)]。
为研究K+条件下结构转换的更详尽过程,进行了核磁谱图实时跟踪扫描实验。图3(a)为新制备状态时NZ473的谱图。室温自然放置26 h后,原动力学有利结构的谱峰(以▼表示)几乎消失殆尽而热力学稳定结构的谱峰(以★表示)逐渐成为主要成分,见图3(e)。样品室温继续放置至3 d,见图3(f),此时NMR一维氢谱只呈现热力学稳定结构的谱峰,说明此时动力学有利结构已经完全转换为热力学稳定结构。该实验表明随着时间推移NZ473趋向于形成比动力学速度有利结构更稳定的热力学稳定结构。
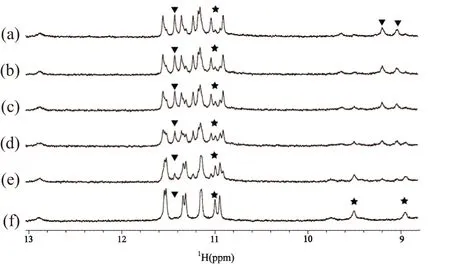
(a)~(f)分别为NZ473样品在室温静置0、1.5、3、8、26和72 h的一维氢谱。▼为动力学有利结构的代表谱峰;★为热力学稳定结构的代表谱峰。图3 298K,NZ473在K+条件下结构转换的NMR谱图Figure 3 Proton NMR spectrum of structural conversion of NZ473 in K+buffer at 298 K
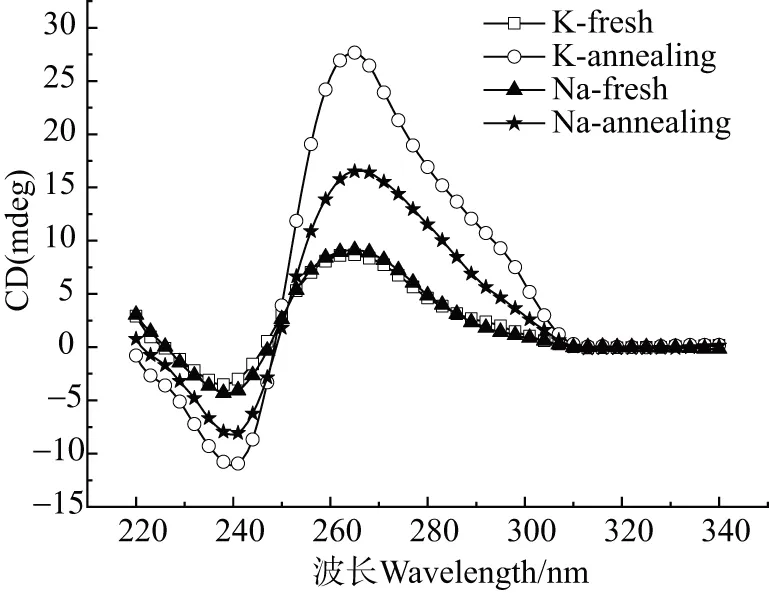
□:K+ fresh;○:K+ annealing;▲:Na+ fresh;★:Na+ annealing(fresh表示干粉样品立即溶于Na+、K+缓冲液中,annealing表示将样品置于95 ℃热水中自然冷却至室温)。图4 298K,CD表征Na+和K+条件下NZ473形成的G-四链体结构(220 ~340 nm)Figure 4 Characterization of G-quadruplexes formed by NZ473 by CD in Na+ or K+ buffer at 298K(220~340 nm)
为更深入比对NZ473在以上不同条件下的结构差异,通过圆二色谱法(CD)进行分析。圆二色谱法是研究G-四链体拓扑结构的常用方法之一[12]。根据参与形成G-四链体核心主链的走向不同,可分为平行型、反平行型及混杂型G-四链体。平行型G-四链体通常在圆二色谱图的260 nm处呈正峰,表明此时参与形成G-四链体核心结构的连续鸟苷酸糖苷键构象一致(同为syn或同为anti);反平行型G-四链体通常在295 nm处呈正峰,此时参与形成G-四链体核心结构的连续鸟苷酸糖苷键构象保持相反。若260 nm和295 nm两处皆呈现正峰,则说明此时参与形成G-四链体核心结构的连续鸟苷酸糖苷键构象同时存在一致与相反现象[13],这种情况通常形成了混杂型G-四链体(hybrid),即同时存在相互平行和反平行的链。在K+、Na+新制备状态(fresh)时,NZ473的CD谱图上基本只有260 nm处呈正峰(图4中的□和▲),而缓慢退火(annealing)后的钠离子样品无明显变化,260 nm处仍旧为主要正峰;但是钾离子样品退火后的谱图在260 nm处仍为主要正峰,但在295 nm处开始出现更多比例的正肩峰(shoulder peak)(图4中的○和★)。295 nm处正峰的出现说明退火后新形成的热力学稳定结构必然存在鸟苷酸糖苷键的翻转,从而导致不同G-四分体平面中两个相邻鸟苷酸具有不同糖苷键构型的比例增加[14]。上述CD实验结果表明,钾离子热力学稳定结构核心部分与其他条件下形成的各个核心结构大体上相同,只是更精细的局部结构存在差异。
2.2 核磁共振结构解析验证NZ473在K+条件下的热力学稳定结构与Na+条件下的核心结构
采集NZ473钾离子热力学稳定G-四链体结构的重水1H-1H NOESY谱图(混合时间为250 ms)[2]并进行化学位移指认,结果见图5(a)。其中,直接维(横轴)为碱基H8/H6质子谱峰区域,间接维(纵轴)为糖环上H1′质子谱峰区域。图中横线连接的是同一个糖环H1′跟自身碱基的H8/H6以及下一个碱基的H8/H6之间的交叉峰,而竖线连接的是同一个碱基H8/H6跟自身糖环上的H1′以及上一个糖环的H1′之间的交叉峰。以此类推依次连接指认出各个残基的H8/H6/H1′的化学位移信息。通过HMBC谱图关联同一个G的H8与其自身亚氨基H1质子[15],从而对可交换的亚氨基区的谱峰进行指认[图5(b)],图中用横线连接相关联的同一残基上的H8与H1质子。
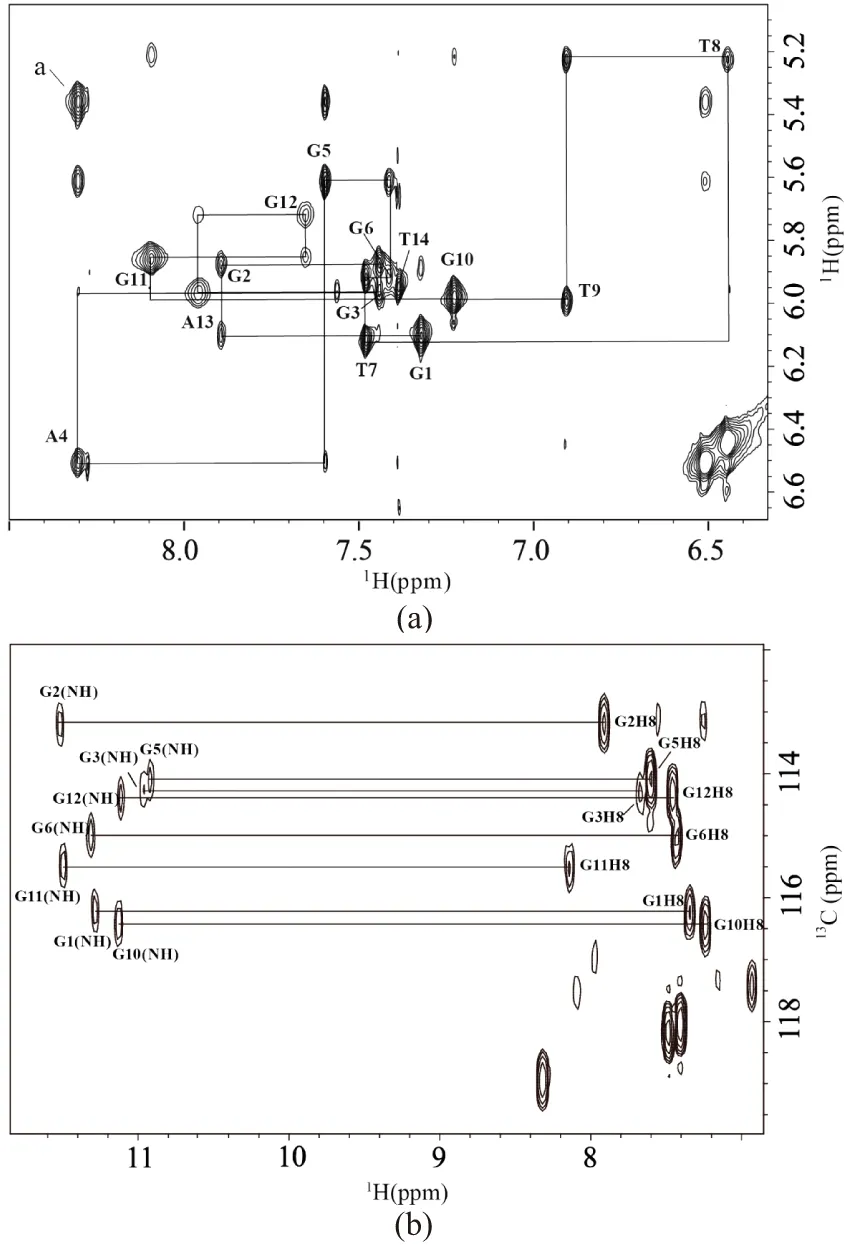
(a)293K,1H-1H NOESY重水谱给出碱基上H8/H6质子与糖环上H1′质子的空间距离信息(图中标注出来的峰为碱基H8/H6与自身糖环H1′间的交叉峰,a为A4碱基H8与自身糖环H3′的交叉峰); (b)288K,含10%重水的HMBC谱图。图5 20 mmol/L KPi(pH 6.8)条件下NZ473退火后的100%重水1H-1H NOESY谱图(混合时间为250 ms)以及10%重水的HMBC谱图Figure 5 NOESY spectrum of annealed NZ473 with 100% D2O (mixing time 250 ms) and HMBC spectrum with 10% D2O in 20 mmol/L KPi (pH 6.8)
另外,观测以柱状堆积模式显示的100%重水1H-1H NOESY谱[混合时间为50 ms,图6(a)],可以明显看出:G1、G10和G11 3个鸟苷酸的H8-H1′交叉峰明显高于其他鸟苷酸,这说明糖苷键必然为syn构型。而Na+条件下的结构只有G1和G10采用syn型糖苷键[11],表明这两个结构的精细结构必然存在差异,这与前述图4中的CD实验结果一致。
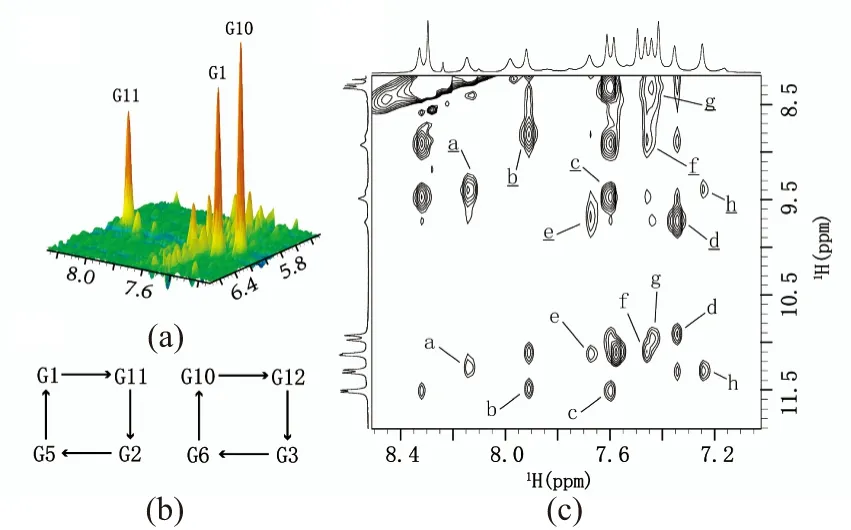
(a)1H-1H NOESY重水谱(混合时间为50 ms)的H8/H6与H1′交叉峰区域(图中G1、G10、G11采用syn型糖苷键)。(b)根据图C交叉峰推断出的两个G-四分体平面(箭头表示氢键方向,由氢键供体指向氢键受体)。(c)NZ473在10%重水中的NOESY谱图[鸟嘌呤碱基的亚氨基质子NH与H8区域的谱峰标记为a, G1(NH)-G11(H8); b, G11(NH)-G2(H8); c, G2(NH)-G5(H8); d, G5(NH)-G1(H8); e, G10(NH)-G12(H8); f, G12(NH)-G3(H8); g, G3(NH)-G6(H8); h, G6(NH)-G10(H8)。鸟嘌呤碱基的氨基质子NH2与H8区域的谱峰标记为a, G1(NH2)-G11(H8); b, G11(NH2)-G2(H8); c, G2(NH2)-G5(H8); d, G5(NH2)-G1(H8); e, G10(NH2)-G12(H8); f, G12(NH2)-G3(H8); g, G3(NH2)-G6(H8); h, G6(NH2)-G10(H8)]。图6 20 mmol/L KPi(pH 6.8)条件下NZ473退火后的100%重水NOESY谱(混合时间为50 ms)以及10%重水NOESY谱(混合时间为250 ms)Figure 6 NOESY spectra of annealed NZ473 with 100% D2O (mixing time 50 ms) or 10% D2O (mixing time 250 ms) in 20 mmol/L KPi (pH 6.8)
鉴于参与形成G-四链体核心结构的鸟嘌呤碱基H8与亚氨基H1质子的化学位移都得到指认归属,随后我们便可通过10%重水NOESY谱(混合时间为250 ms)的H8与H1质子区确定G-四分体平面信息[图6(c)]。由于在同一G-四分体平面中,4个G首尾相连,且其中一个G的H1或者H22(氨基质子)与下一个G的H8在空间上距离较近[图7(b)],故在水谱NOESY上可以找到相应交叉峰。最终确定NZ473钾离子热力学稳定结构包含(G3·G6·G10·G12)和(G1·G11·G2·G5)两个G-四分体平面[图6(b)]。
我们在10%重水NOESY谱中还发现:G2的两个氨基质子(NH2)非常稳定,并且与A4的H8以及G5的H8质子产生强烈的NOE信号[图7(d)中a、b、c、d 4个交叉峰)],同时A4的H8与G5的H8质子之间也有强烈的NOE信号[图7(d)中交叉峰e],说明上述氢原子空间距离十分接近,因此A4必然参与形成A4·(G1·G11·G2·G5)五元平面[图7(c)]。
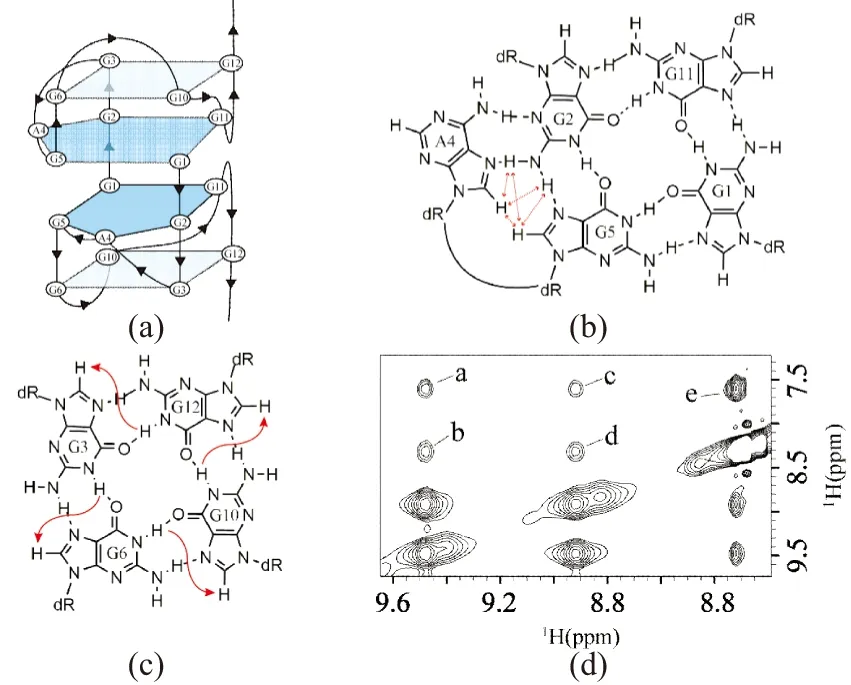
(a)NZ473钾离子热力学稳定结构示意图(黑色线条代表DNA主链,圆圈内为碱基类型及序号);(b)G3·G6·G10·G12 G-四分体平面(红色箭头连接相互靠近的H8与H1质子);(c)A4·(G1·G11·G2·G5)五元平面,其中碱基A4与G2发生配对(红色箭头连接因A4残基参与形成五元平面而在空间距离接近的氢原子);(d)10%重水NOESY谱(图中可以观察到五元平面上的特征NOE交叉峰:a, G2H22-G5H8; b, G2H22-A4H8; c, G2H21-G5H8; d, G2H21-A4H8; e, A4H8-G5H8)。图7 NZ473钾离子热力学稳定结构及其基本组成单元示意图Figure 7 Diagram of the thermodynamic stable structure of NZ473 in K+ buffer and the basic components
核磁一维氢谱中,作为氢原子(H)同位素的氘原子(D)是没有信号的。在100%重水样品中,由于鸟嘌呤碱基上的亚氨基质子非常活泼,其在未参与形成氢键的自由状态下,可以与重水中的氘原子发生快速交换,因而在氢谱中无法被观测到。而在G-四链体结构中,由于亚氨基质子参与形成氢键而相对稳定,导致其与重水中氘原子交换速度变得相对缓慢,因而在一定时间内可以观察到氢原子的谱峰。但是随着时间的推移,其谱峰高度会随着亚氨基质子被交换成氘而逐渐变矮直至谱峰消失。在G-四链体结构中,越是在疏水核心区的亚氨基质子越难被氘原子交换,核磁谱图中体现为谱峰消失速度减慢和消失程度减弱;而更接近溶剂重水的外围亚氨基质子尽管也参与形成氢键,但因其与氘原子更易接近而使得交换更易发生,因而表现为其谱峰消失的速度相对更快。鉴于此,氢-氘交换实验常被用于G-四链体结构的鉴定。
298K向已经完全冻干的NZ473样品中迅速加入100%重水后1 min,氢-氘交换实验结果显示(图8),G-四链体特征峰区呈现8根谱峰[图8(b)]。随着时间延长,G6、G10、G12以及G3谱峰(标示为▼)峰高不断降低直至消失[图8(c)~(f)]。加入重水后168 h甚至更长时间亚氨基质子特征峰区仍剩下稳定的G2、G11、G1、G5谱峰[图8(f)]。这4个亚氨基质子极难被氘原子取代从而导致其谱峰长时间稳定存在,该现象说明谱峰对应的4个残基必然位于G-四链体核心区域,四周存在疏水保护。这也进一步说明NZ473在K+条件下的热力学稳定结构必然是二聚的。若G-四链体呈单聚状态,则(G2·G11·G1·G5)平面与(G3·G6·G10·G12)平面同样暴露在重水溶剂中,故两个平面中亚氨基质子氢-氘交换速度应相差不大,谱峰都应很快消失。所以该结构必定采用类似Na+结构中二聚化的方式互相联锁保护[图1(c)]。氢-氘交换实验表明NZ473钾离子热力学稳定结构为二聚四层的联锁型G-四链体[图7(a)]且核心结构与钠离子中结构[图1(c)]保持一致,只是G11位残基的糖苷键发生了更多扭转,采用syn构型。
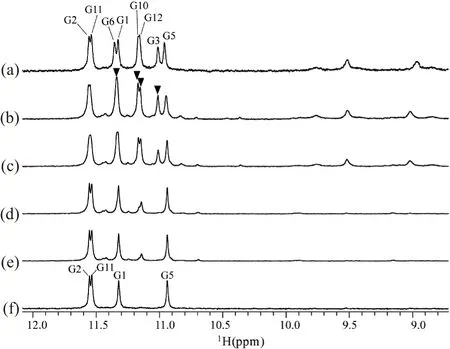
NZ473预先在20 mmol/L KPi条件下形成热力学稳定结构。(a)表示10%重水样品中的热力学稳定结构对照谱图;(b)~(f)表示分别向冻干样品中加入100%重水1 min、1、5、8及168 h后采集的谱图。亚氨基谱峰的指认在(a)中已被标出;▼标示先消失的四根峰。图8 298K,NZ473热力学稳定结构的氢-氘交换实验Figure 8 H-D exchange assay of thermodynamically stable conformation of NZ473 at 298 K
2.3 NZ473形成的联锁型G-四链体结构十分稳定
研究表明,一段富含鸟嘌呤的DNA单链折叠形成G-四链体结构后,295 nm处的紫外(UV)吸光值会相应增加。相反,当温度逐渐升高使G-四链体结构被破坏,295 nm处的UV吸光值会相应降低[16]。因此,观测G-四链体UV的吸光值随温度升高的变化,可以得到一条吸光值-温度曲线,该曲线一阶导数绝对值的最大值对应的温度即为G-四链体的熔点(Tm)。通过以上方法测得NZ473在K+条件下形成的热力学稳定G-四链体熔点为82 ℃±0.3 ℃(图9),而已报道过的多数G-四链体熔点在30 ℃至50 ℃[16]。NZ473在K+条件下形成的热力学稳定G-四链体结构较一般G-四链体熔点显著升高,说明其结构异常稳定。因其中间两层G-四分体平面由糖磷骨架共价键相连,可以在一定范围的高温条件下维持结构不被破坏。同时氢-氘交换实验中,一般G-四链体在100%重水中短时间内亚氨基质子就被完全交换。而钾离子热力学稳定结构处于内层的五元平面内的氢原子谱峰可以长时间存在,这也从侧面说明此结构拥有非比寻常的稳定性。
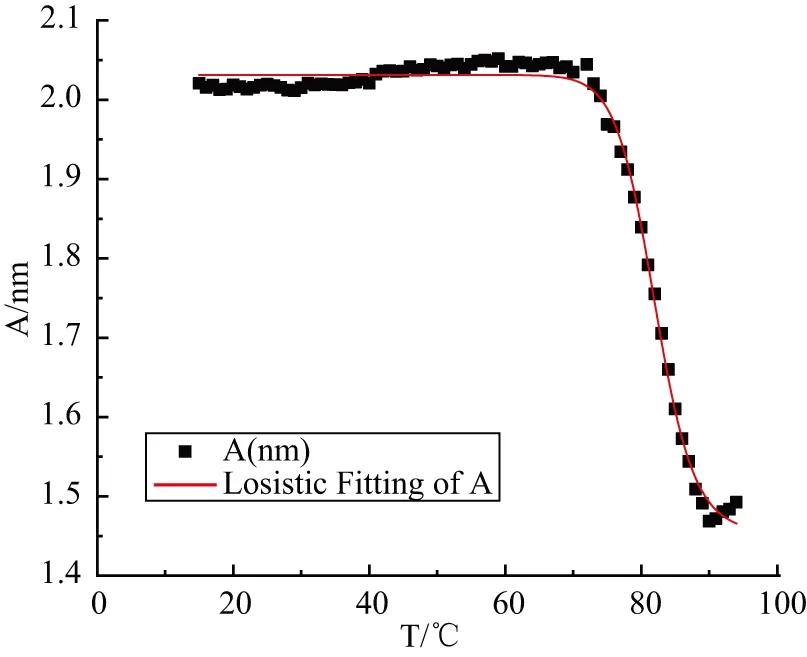
图9 NZ473钾离子热力学稳定结构的熔解温度曲线Figure 9 Melting temperature curve of the thermodynamic stable structure formed by NZ473 in K+ buffer
2.4 NZ473的Na-K交换实验表明K+热力学稳定结构比Na+结构更稳定
为探究钠、钾离子条件下NZ473序列折叠形成G-四链体结构的稳定性差异,向预先在钠离子条件下已经形成结构的NZ473样品中逐渐滴加氯化钾(图10)。当滴加氯化钾至终浓度为2 mmol/L时[图10(b)],谱图相比钠离子条件[标示为★,见图10(a)]新增了一套谱峰,同时钾离子热力学稳定结构的谱峰峰高也迅速升高[标示为▼,见图10 (b)]。随着样品溶液中氯化钾终浓度不断升高,谱图中钠离子条件下形成的G-四链体结构所对应的谱峰峰高逐渐降低而钾离子热力学稳定G-四链体结构所对应的谱峰峰高逐渐升高直至成为主要成分[图10(e)]。即使溶液中的钠钾离子浓度比为12∶1,NZ473仍主要以钾离子热力学稳定结构的形式存在,说明该钾离子结构比钠离子条件下的结构更加稳定。
3 讨论与结论
(a)为120 mmol/L纯钠离子条件下的谱图。(a)~(e)溶液中KCl终浓度为(a)0 mmol/L; (b) 2 mmol/L; (c)5 mmol/L; (d) 7 mmol/L; (e)10 mmol/L; (f)20 mmol/L纯钾离子热力学稳定结构谱图对照。▼为K+热力学稳定结构的代表谱峰;★为Na+结构的代表谱峰; ↓为NZ473在Na+中可能存在的其他少数次要结构图10 298K,NZ473 Na-K交换实验的NMR谱图Figure 10 Proton NMR spectrum of NZ473 Na-K switch assay at 298 K
随着对G-四链体研究的愈发深入,联锁型G-四链体也逐渐受到广泛关注。本文主要通过液体核磁共振、CD等方法对G-rich序列d(G3AG2T3G3AT)在不同条件下折叠形成的联锁型G-四链体结构进行探究。通过对采集的NOESY、HMBC、HSQC等二维谱谱图进行结构解析后发现,d(G3AG2T3G3AT)钾离子热力学稳定结构的核心部分与已发表钠离子条件下的结构几乎完全一致。二者区别仅在于G11处鸟苷酸的糖苷键发生了进一步扭转,由anti型(已发表钠离子结构)扭转成syn型(钾离子热力学稳定结构)糖苷键。由于其水溶性、生物相容性及超乎寻常的热稳定性,可形成联锁型G-四链体的DNA被期望广泛应用于超分子化学与纳米材料等领域。
在较高温度条件下采集d(G3AG2T3G3AT)的钾离子一维氢谱时,序列仍能先折叠形成钾离子动力学有利结构且稳定存在数小时,说明动力学有利结构自身就具备相当程度的稳定性。即便如此,核磁一维氢谱仍可以观测到动力学有利结构向热力学稳定结构转换的自发过程。因此,推动这两个稳定结构在室温下即可发生自主转换的原因仍值得后续深入探究。
