连作方式对蕨麻根际土壤真菌群落结构的影响
2021-08-24王雅琼刘吉宏李军乔白世俊
王雅琼,刘吉宏,李军乔,白世俊
(1. 青海民族大学 生态环境与资源学院, 西宁 810007; 2.青海省生物技术与分析测试重点实验室-青藏高原蕨麻研究中心, 西宁 810007; 3. 西宁市气象局, 西宁 810016)
蕨麻(PotentillaanserinaL.)是多年生草本植物,属于蔷薇科(Rosacrae)委陵菜属(Potentilla)。在高原地区生长的蕨麻,其地下根系膨大,富含淀粉、蛋白质、多糖、总黄酮等营养物质和有效成分[1],因具有抗缺氧、保肝护肝、降低血脂及胆固醇、提高机体免疫力、抑制病菌等作用,在《晶珠本草》《四部医典》中均有记载,民间常将其作为食品、保健品和藏药使用[2]。蕨麻作为青海省的特色农产品,为青海省农业和经济的发展创造了条件,但对野生蕨麻的无序采挖对自然环境产生了很大的破坏。基于此,本课题组先后培育了3个人工栽培新品种。在长期的人工种植条件下,蕨麻的产量和品质有所下降,由于土壤健康对植物的高效优质生产至关重要,为了寻找蕨麻连作的影响因素,本课题组展开了对根际土壤的研究。
根际是指植物根系周围的特殊土壤,作为土壤水分和养分进入植物根系的门户,是受根系自身的生命活动影响最直接、最强烈的区域[3]。植物的生长和产量与根际土壤营养状况和微生物群落结构等因素密切相关。其中,根际真菌对植物产生强烈影响,腐生真菌产生的胞外酶能够分解和调动植物凋落物[4],外生菌根真菌能够与植物共生[5],丛枝菌根真菌通过改变土壤营养物质浓度促进植物养分获取[6],病原菌通过造成植物病害使植物种群数量发生改变[7]。植物对根际真菌也会产生调节作用,例如,根对水分、营养物质的富集和根部的脱落物给真菌群落创造的特殊生境[4]。
本研究以青藏高原蕨麻研究中心审定的作物新品种“青海蕨麻2号”为试验对象,测定蕨麻根际土壤的养分含量和真菌多样性,探讨蕨麻生长和环境条件对真菌群落结构的影响,以期为蕨麻人工高产栽培中健康土壤的构建提供理论依据。
1 材料与方法
1.1 采样区概况
采样区位于青海省湟源县日月乡(36°31′30″ N~36°32′40″ N,101°7′51″ E~101°10′24″ E),该区属大陆性高原温带半干旱气候,四季分明,昼夜温差大,2018年年均气温4.8 ℃,年降水量515.4 mm。采样地设在“青海蕨麻2号”试验种植区,3个不同实验区的种植年限分别为连作1年、4年和8年。2018年4月进行播种,所有肥料作底肥一次施入,不追肥。
1.2 样品采集
蕨麻利用块根进行无性繁殖,分别在蕨麻萌芽期、开花期、块根膨大期和块根收获期进行4次采样。采样方法为随机采样法,在同一生长周期的不同实验区里分别随机设置3个样方,每个样方内选择长势一致的蕨麻5株,利用抖土法取样,5个土样混合均匀后代表一个样品,3个样方采集的样品代表3个生物学重复。将采集的样品用灭菌自封袋密封置于冰盒中带回实验室,去除杂质,过2 mm筛后平均分为两份,一份自然风干用于土壤养分测定,另一份置于-80 ℃冰箱储存,用于真菌群落分析[8]。采用国标方法测定土壤中全氮、全磷、全钾、速效氮、有效磷和速效钾含量。
1.3 DNA提取与建库
使用QIAampPowerFecal DNA试剂盒(QIAGEN,德国)从0.5 g土壤样品中提取DNA。使用正向引物86F,5′-GTGARTCATCGAATCTTT-3′和反向引物805R,5′-GATATGCTTAAGTTCAGCGGGT-3′[9]通过PCR扩增真菌ITS rDNA V2区。PCR反应体系包括:5 μL 5 × GC缓冲液,0.5 μL KAPA dNTP Mix,0.5 μLTaqDNA聚合酶,0.5 μL引物(10 pmol/L)和50 ~100 ng模板DNA混合成25 μL体系。PCR反应条件:95 ℃预变性3 min;25个循环,95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s;最后72 ℃再延伸5 min。使用AMPure XP磁珠纯化PCR产物,去除游离引物和引物二聚体等。使用上述引物扩增PCR纯化的产物,其中每个样品用独特的八碱基序列条形码来进行区分。然后,配置25 μL PCR反应体系包括,5 μL 5 × GC缓冲液,0.75 μL KAPA dNTP Mix,0.5 μLTaqDNA聚合酶,1.5 μL引物(10 pmol/L)和5 μL纯化产物。PCR反应条件为95 ℃预变性3 min,然后8个循环,反应条件同上。通过AMPure XP磁珠纯化扩增产物形成文库,使用Illumina MiSeq 2500测序平台完成测序。
1.4 生物信息学和统计分析
采用FLASH将测序得到的双端序列进行拼接。对目标序列进行质控过滤fastq_quality_filter(-p 90-q 25-Q33FASTX Toolkit 0.0.14),过滤后的序列与参考数据库USEARCH作比对,去除嵌合体得到优化序列。通过随机减法,根据样本的最小值对每个样本的读取次数进行归一化。根据97%的序列相似性水平,利用QIIME的Uclust算法进行OTU聚类分析,基于UNITE参考数据库,对每个样品的OTUs进行物种分类学注释。基于加权和非加权Unifrac距离矩阵计算样本的Alpha和Beta多样性。同时,我们使用线性判别分析(LDA)效应大小(LEfSe)方法来识别群体间丰度差异具有统计学意义的物种[10]。主成分分析(PCA)和冗余分析(RDA)采用CANOCO 5.0软件进行;皮尔森相关性分析和单因素方差分析采用SPSS 22.0软件进行。
2 结果与分析
2.1 采样地土壤养分特征
分析不同种植年限、不同生长周期蕨麻根际土壤的营养状况,对全氮、全磷、全钾、速效氮、有效磷和速效钾进行主成分分析(图1)。结果表明,PCA1和PCA2共同解释了总变异的93.82%,可以全面显示研究区域土壤营养状况的分异特征。不同种植年限的土壤营养状况沿PCA1明显分开,存在显著差异,对第1主成分起主要作用的营养物质为全氮,而速效钾对第2主成分的贡献较大。
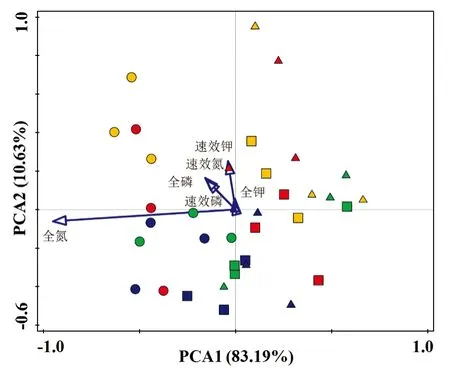
○:连作1年;△:连作4年;□:连作8年。红色:萌芽期;黄色:开花期;绿色:块根膨大期;蓝色:块根收获期。图1 3个蕨麻种植试验田土壤营养因素主成分分析Figure 1 Principal component analysis of the nutritional variables measured at the three planting fields of Potentilla anserina L.
2.2 蕨麻根际土壤中真菌的群落结构
通过Illumina测序平台,蕨麻根际土壤中共获得1 023 967条序列,各个样品的序列范围为27 460~29 626条。按照97%阈值聚类后的OTUs数目为700个,分属于5个门,14个纲,31个目,42个科和64个属。在所有OTUs中,有43%无法注释到真菌门,5个已知真菌门分别为子囊菌门,担子菌门,壶菌门,球囊菌门和接合菌门,其中,子囊菌门种类最丰富,有292个OTUs(590 998条序列),之后依次为51个OTUs(21 500条序列),7个OTUs(8 809条序列),26个OTUs(4 012条序列)和23个OTUs(72 654条序列),见图2(a)。
在64个真菌属中,平均相对丰度大于1%的优势真菌属有5个[图2(b)和图3(a)],分别是茎点霉属(Phoma)、光黑壳属(Preussia)、Cadophora、镰孢菌属(Fusarium)和被孢霉属(Mortierella);平均相对丰度在0.1%~1%的真菌属有12个,见图3(b)。由图2(b)可知,5个优势属的丰度在不同种植年限、不同生长阶段均存在差异,在连作1年的根际土中镰孢菌属占优势,连作4年的根际土中Cadophora和被孢霉属占优势,连作8年的根际土中被孢霉属占优势。由此可见,连作能够改变蕨麻根际土壤真菌的群落结构,优势真菌属及其丰度均发生了变化。
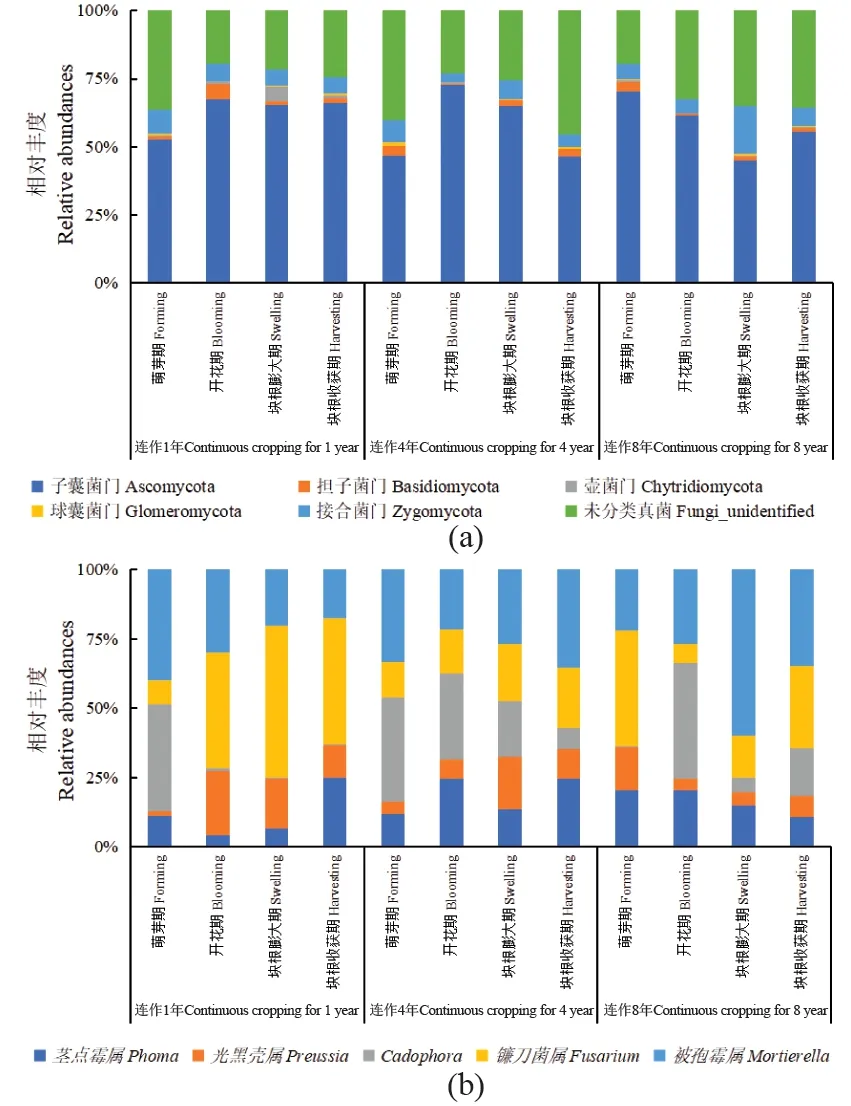
每个柱形代表3个生物学重复的平均值。图2 蕨麻种植试验田土壤真菌门(a)和优势真菌属(b)的相对丰度 Figure 2 Relative abundances of the fungal phyla (a) and dominantfungal genera (b)across all samples collected from plantingfields of Potentilla anserina L.
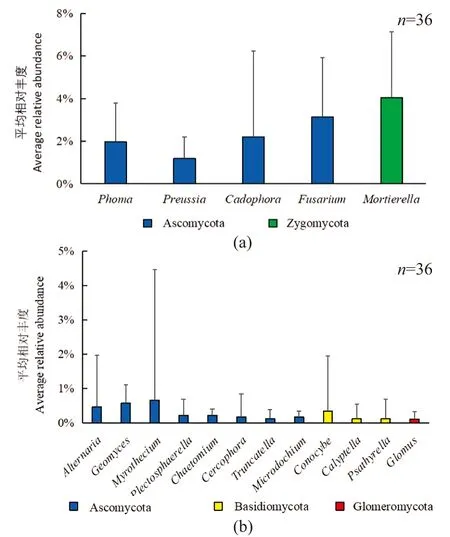
(a)平均相对丰度>1%的真菌属;(b)平均相对丰度> 0.1%的真菌属。误差条显示每个平均值的标准偏差。图3 蕨麻种植试验田土壤真菌属的平均相对丰度Figure 3 Average relative abundance of fungal genera in across all samples collected from planting fields of Potentilla anserina L.
2.3 蕨麻根际土壤中真菌的α-多样性
用Good’s coverage,Chao 1和Shannon多样性指数来估算和比较蕨麻根际土壤中真菌群落的多样性。Good’s coverage指数的变化范围是99.66%~99.79%,表明测序的结果覆盖了主要的真菌类群。Shannon和Chao 1指数的变化范围分别是3.88~6.55和370.13~521.10。方差分析显示:蕨麻开花期根际土壤中的真菌多样性显著低于其他生长阶段(Shannon,P<0.05);连作4年的土壤真菌丰富度显著高于其他连作年限(Chao1,P<0.05),而测序覆盖度显著低于其他连作土壤(Good’s coverage,P<0.01),表明土壤样品中真菌的均匀度和丰富度均发生了变化。
2.4 蕨麻根际土壤中真菌的β-多样性
主坐标分析图显示了蕨麻4个生长阶段根际真菌OTU组成的差异(图4)。PC1和PC2解释贡献率分别为16.72%和13.87%,不同生长阶段的真菌OTU组成没有显著差异。然而,对真菌群落进行LEfSe分析观察发现,在蕨麻不同生长阶段根际土壤中存在具有统计学差异的生物标识物,即组间差异显著的物种(图5)。由以上结果可以看出,蕨麻根际真菌群落随着不同生长阶段发生了改变。
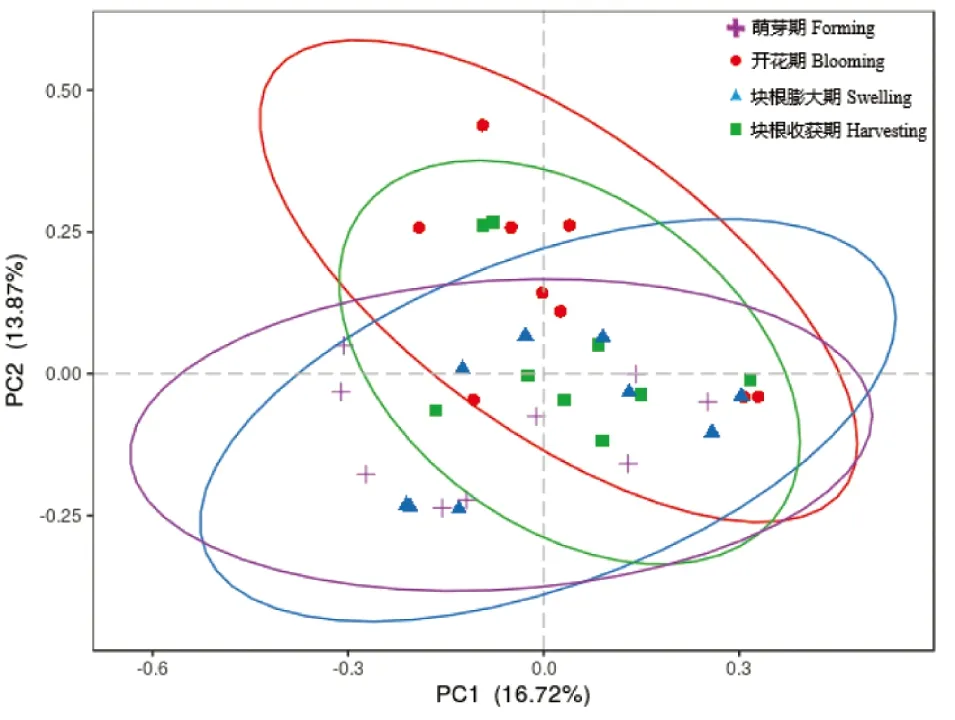
图4 基于Bray-Curtis距离的主坐标分析图显示了蕨麻4个生长阶段根际真菌的β-多样性Figure 4 Principal coordinate analysisplot based on Bray-Curtis distance showing the β-diversity of rhizosphere fungal communities among the four growth stages of Potentilla anserina L.
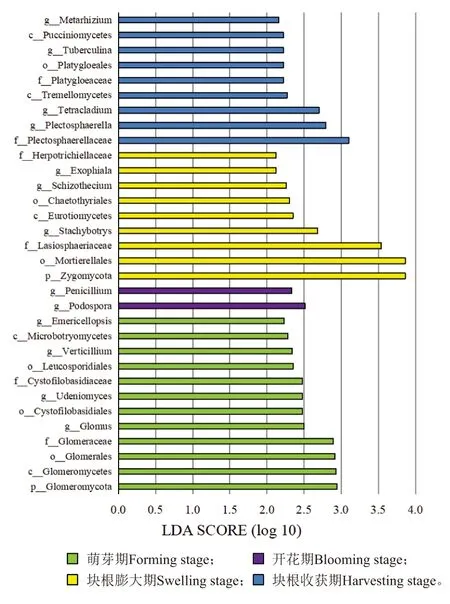
图5 利用线性判别分析分值对蕨麻4个生长阶段真菌不同分类水平的菌群进行富集(截断值≥2)Figure 5 Enriched taxa of different fungal level from the four growth stages of Potentilla anserina L. with a linear discriminant analysis score (cut off value ≥2)
2.5 土壤环境对蕨麻根际土壤真菌群落组成的影响
利用冗余分析了解土壤养分对真菌群落结构的影响,结果(图6)显示RDA1和RDA2累计解释真菌群落结构变异的变量达到29.89%,速效钾的影响显著(P< 0.05),且接合菌门和土壤全钾呈正相关,子囊菌门与土壤养分关系较小。
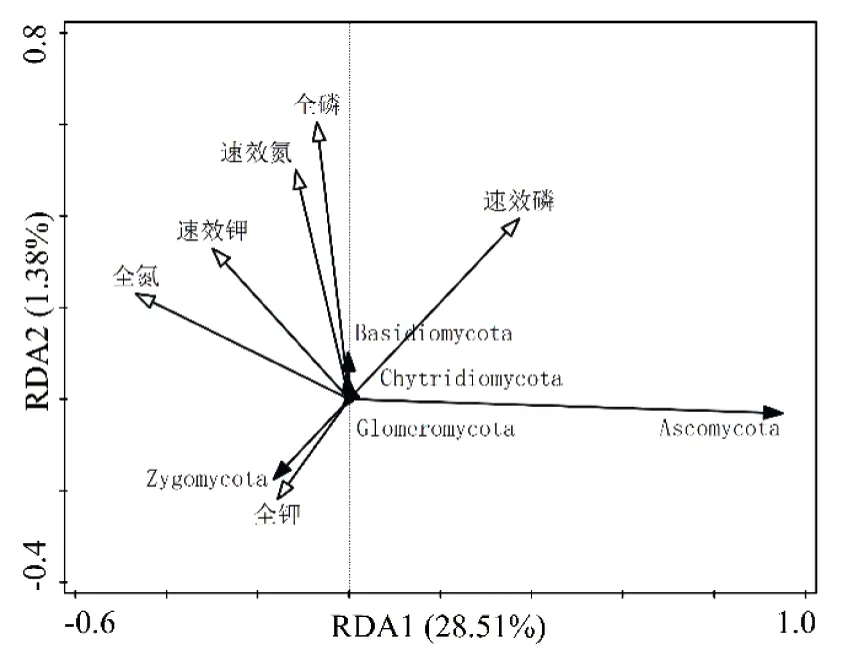
图6 蕨麻根际土壤真菌门与土壤养分的冗余分析Figure 6 Redundancyan alysis of soil fungus phylum and soil nutrient in rhizosphere of Potentilla anserina L.
对蕨麻根际真菌群落多样性与土壤营养元素进行相关性分析,结果(表1)显示:土壤全磷、速效氮与Chao 1指数呈负相关,土壤速效氮、速效磷与Shannon指数呈负相关,表明较高含量的土壤全磷、速效氮、速效磷会抑制根际土壤真菌丰富度和多样性,土壤中养分含量是影响根际土壤真菌多样性的驱动因子之一。
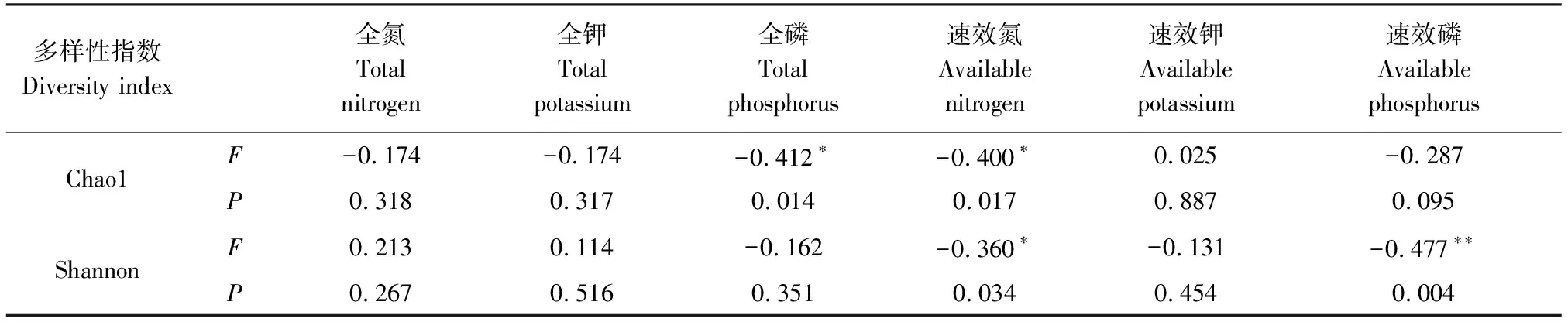
表1 真菌多样性和环境因子相关性统计Table 1 Statistical analysis of correlations between environmental factors and fungal diversity
蕨麻根际土壤中平均相对丰度大于0.1%的真菌属与土壤养分含量进行相关性分析(表2)表明,链格孢属、镰孢菌属和微座孢属与全氮含量正相关;毛壳菌属、微座孢属与全磷含量正相关;毛壳菌属、锥盖伞属与速效氮含量正相关;Cadophora与速效钾含量正相关;小不整球壳属与全钾、速效氮、速效磷含量负相关。以上结果表明,真菌属的变化与土壤中养分含量相关。
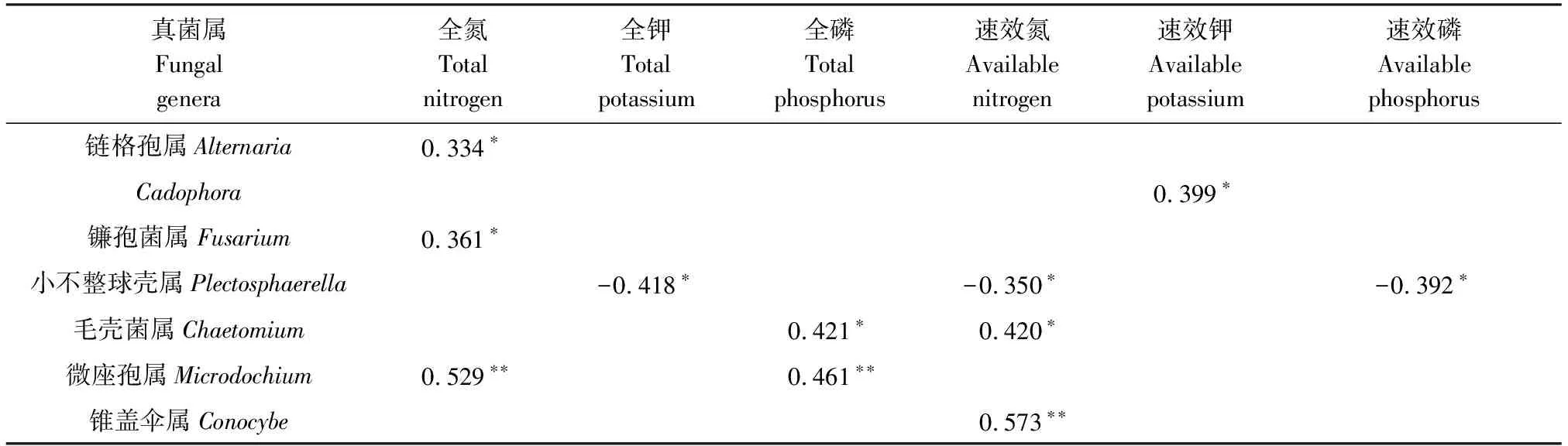
表2 环境因子与真菌属相关性统计分析Table 2 Statistical analysis of correlations between environmental factors and fungal genera
3 讨论与结论
蕨麻根际土中的真菌群落结构在不同连作年限和不同生长阶段均存在变化,子囊菌门占绝对优势[图2 (a)],这与番茄[11-12]和马铃薯[13]根际真菌的研究结果一致。有研究认为,子囊菌门真菌是一些传染性疾病的病原体和重要参与者,在本研究中占优势的真菌属[图3(a)]对植物的影响已有多项研究,例如,茎点霉属能够引起紫花苜蓿的褐色根腐病[14],镰孢菌属能够造成马铃薯[13]和番茄[11]的病害,光黑壳属能够产生抗菌活性物质[15],Cadophora对植物生长有益[16]。
研究中α-多样性分析结果显示蕨麻开花期根际真菌多样性显著降低(P< 0.05),并且蕨麻每个生长阶段生物标志物都不同(图5)。这些变化可能与特殊生长阶段根系分泌物有关[17],有研究对比了马铃薯在连作、轮作种植时不同生长阶段根系的分泌物,发现其种类和数量均存在很大差异[18],而且在构建土壤真菌群落中发挥重要作用[19]。与本研究结果类似,烤烟生育中后期土壤真菌群落最为丰富[20],土壤AM真菌的群落结构变化随着棉花生育期的不同会有短暂的变化[21],哈密瓜根际真菌群落结构同样随生育期发生改变[22]。
在农业生态系统中,微生物多样性受到栽培技术、作物连作或轮作、植物物种和气候变化等因素影响,其中连作对微生物有显著影响。许自成[20]、陈一峰[23]等利用PCR-DGGE技术研究了不同作物根际土壤的真菌群落结构,结果均显示连作对根际土壤真菌群落有较大影响。刘伟等[24]利用高通量测序技术研究了丹参连作年限对根际土壤真菌的影响,结果显示连作对真菌群落在界、纲及属不同分类水平上均有较大影响。以上研究均认为真菌群落结构的变化是导致作物连作障碍的重要原因。本研究利用高通量测序技术检测到的真菌种类远远多于上述研究,并且不同连作年限蕨麻根际真菌群落中5个真菌门[图2(a)]和5个优势真菌属[图2(b)]的丰度明显不同,表明连作能够对真菌群落结构产生影响,然而真菌群落的改变是否直接导致蕨麻连作障碍仍需进一步研究。
环境因子的PCA结果表明,连作1年、4年和8年的土壤样品分别形成了自己的集群,显示了土壤养分的独特差异。蕨麻根际土壤真菌门与土壤养分的冗余分析以及真菌多样性和真菌属与环境因子相关性统计均表明土壤养分含量与真菌群落结构存在相关性。结果表明,无论是生长周期还是连作年限,都明显改变了蕨麻根际土壤的真菌群落结构。蕨麻根际土壤中有大量致病菌,且链格孢属、茎点霉属、光黑壳属、Cadophora、镰孢菌属和被孢霉属等均与土壤营养代谢密切相关。因此,不同连作年限对蕨麻根际土壤真菌群落有较大影响,蕨麻连作后真菌种群结构的变化可能是引发连作障碍的主要原因之一。
