上海市售牡蛎中诺如病毒的污染及基因型和流行趋势分析
2021-08-24贾添慧王永杰杨明树时沙沙喻勇新
贾添慧,王永杰,2,杨明树,时沙沙,董 蕾,喻勇新,2
(1.上海海洋大学 食品学院,上海 201306; 2.农业农村部 水产品质量安全贮藏保鲜风险评估实验室(上海),上海 201306)
诺如病毒(Norovirus, NoV)属于杯状病毒科(Caliciviridae),诺如病毒属(Norovirus)。目前,NoV分为10个基因群(GI-GX),其中,GI和GII型是最常见的人诺如病毒[1-2]。在2006—2016年间,中国发生超过132起NoV的暴发(8 133起案例),其中99.9%的案例都是由GI和GII型NoV引起,造成了医疗资源浪费和经济的损失[3-5]。
NoV相关的急性肠胃炎暴发通常与被NoV污染的牡蛎有关[6]。相关研究表明,几乎所有的GI型和大部分GII型NoV的基因型在牡蛎中检出[7]。食用受NoV污染的牡蛎具有感染NoV的风险,并可能导致NoV在人群中暴发[8]。Meghnath等[9]在研究两起NoV相关的急性肠胃炎疫情(共449例)中发现,疫情都与食用受NoV污染的牡蛎有关。
本研究采用巢式RT-PCR法对上海市售牡蛎进行人诺如病毒(GI和GII型)污染状况的定期监测,旨在分析上海市售牡蛎中NoV的基因型和流行病学趋势,以期对市售牡蛎的食用安全评估和食源性NoV的防治提供参考。
1 材料与方法
1.1 材料
1.1.1 主要试剂
动物组织总RNA提取试剂盒(货号:GK3016)购自上海捷瑞生物工程有限公司;RNA稳定和储存溶液RNAlater购自上海翊瑞生物科技有限公司;一步法反转录PCR试剂盒(货号:RR055A)、PremixTaq(RR901A)购自宝生物工程(大连)有限公司;Top10感受态细胞,5-溴-4-氯-3-吲哚-β-D-半乳糖苷(X-gal),异丙基-β-D-硫代吡喃半乳糖苷(Isopropyl β-D-Thiogalactoside, IPTG),氨苄青霉素和PCR产物回收试剂盒(DP209),100 bp DNA Ladder购自天根生化科技(北京)有限公司;LB固体和液体培养基购自北京陆桥技术股份有限公司;T载体PCR产物连接试剂盒(B522214),GI和GII型NoV的巢式RT-PCR通用型引物购自生工生物工程(上海)股份有限公司(序列见表1)。

表1 巢式RT-PCR的引物组合Table 1 Primers combination used in the of nested RT-PCR
1.1.2 样品采集及预处理
实验所用太平洋牡蛎(Crassostreagigas)是由实验室在上海市芦潮港海鲜市场随机采集得到(长10~12 cm、宽6~8 cm)。2017年10月到2019年10月期间,每月2次采样,当首次样品阳性检出率高于80%时视为暴发期,将增加采样次数进行跟踪分析,共采集牡蛎样品633份,详细信息如表2所示。解剖采集牡蛎的消化腺组织并分装成50~100 mg每管,经RNA保护剂处理后冻于-80 ℃冰箱。
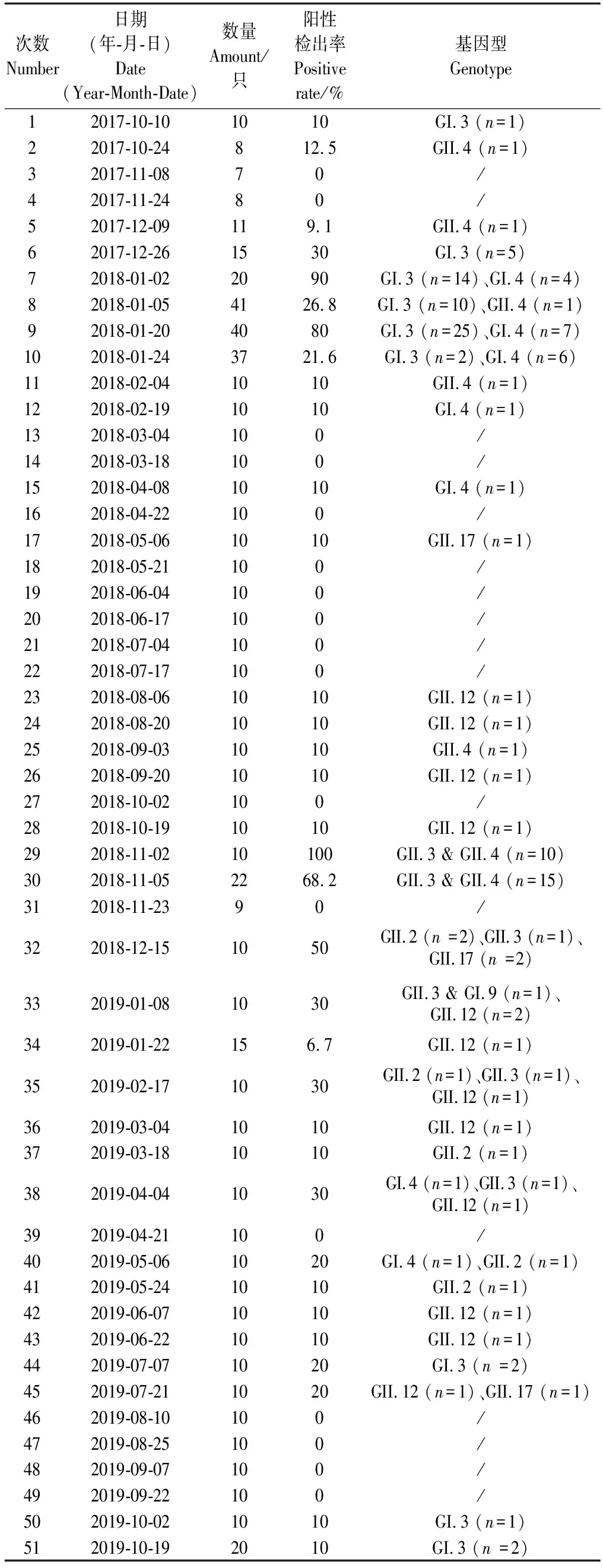
表2 样品信息Table 2 Information of samples
1.1.3 主要仪器
AC2-4S1-CN生物安全柜、ACB-4A1超净工作台购自新加坡艺思高科技有限公司(ESCO);FastPre-24MP组织均质器购自MP Biomedicals(美国);5331PCR仪、5382000074恒温混匀金属浴、5702R台式低温离心机购自艾本德中国有限公司(Eppendorf);PowerPac HC电泳仪、ChemiDoc XRS+凝胶成像系统和凝胶成像分析仪购自伯乐生命医学产品(上海)有限公司(Bio-Rad)。
1.2 方法
1.2.1 样品RNA的提取
牡蛎中总RNA的提取:取一管牡蛎消化腺组织用MP组织均质器打成匀浆,参照动物组织总RNA提取试剂盒说明书中的步骤提取牡蛎消化腺的总RNA,并将其分装于3个RNase-free的小管中,保存于-80 ℃冰箱中待用。
1.2.2 巢式RT-PCR反应
巢式RT-PCR反应分为RT-PCR和第二轮PCR两步,按试剂盒说明书指导进行。RT-PCR反应体系共25 μL,含2×1 Buffer 12.5 μL,上游引物1 μL,下游引物1 μL,Enzyme Mix 1 μL,ddH2O 8.5 μL,模板1 μL。
反应程序:50 ℃反转录30 min;94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环。
将第一轮产物稀释10倍作为模板进行第二轮PCR反应,第二轮PCR反应体系共25 μL,含PCR Mix 12.5 μL,上游引物1 μL,下游引物1 μL,ddH2O 9.5 μL,模板1 μL。
反应程序:94 ℃预变性4 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35个循环;72 ℃延伸7 min加poly-A尾,以便后续的TA连接和测序。两轮PCR扩增结束后用2%的琼脂糖凝胶电泳检测PCR产物(GI: 168 bp; GII:344 bp)。
1.2.3 序列测序
产物经处理后送往生工生物工程(上海)股份有限公司进行桑格测序。若测序结果为双峰,则需要按照PCR产物回收试剂盒说明书进行PCR产物回收,按照T载体连接试剂盒说明书进行连接转化实验,培养单克隆菌液,再次送去测序。
1.2.4 数据分析
本研究采用166条测序获得的序列进行基因分型。测序成功的序列导入到NoV专用基因分型工具NoV-genotyping tool[10](http://www.rivm.nl/mpf/norovirus/typingtool)通过系统发育分析确定基因型。
2 结果与分析
2.1 时间分布
2017年10月—2019年10月期间,共检出140例(140/633)NoV阳性的牡蛎,阳性检出率为22.1%。从图1可以看出,阳性检出率的峰值连续两年都出现在11月至次年2月,分别为2018年的1月(50%)、2018年11月(61%)、2018年12月(50%)和2019年2月(30%),而在其他月份,如3到10月,阳性检出率通常都在10%及以下。结果表明,NoV具有很强的冬季季节性,11月至次年2月是牡蛎中NoV污染的高峰期。Lowther等[8]在研究英国市售牡蛎中的NoV时也得出相似的结果。
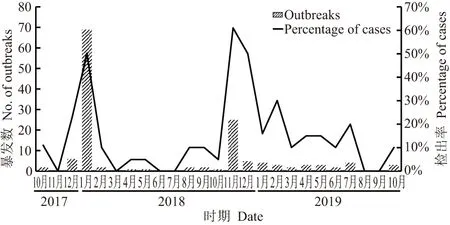
图1 共140例诺如病毒阳性牡蛎检出月份分布Figure 1 The monthly distributions of 140 cases of norovirus contaminated oysters
从年度分布看,2017年10月—2018年9月期间共检出85例NoV阳性的牡蛎,阳性检出率为23.8%,占总检出数量的60.7%。而2018年10月—2019年10月期间共检出55例NoV阳性的牡蛎,阳性检出率为19.9%,占总检出数量的39.3%。阳性检出例数受补采样影响,如2018年1月两次采样阳性检出率均超过80%,因此分别展开两次补采样,最后该月阳性检出率稳定在50%;2018年11月其中一次采样阳性检出率达100%,因此补采样一次,该月的阳性检出率最终稳定在61%。采样基数越大,阳性检出率会更稳定。在年度时间分布上,牡蛎受NoV污染的情况类似,阳性检出率都在20%的水平。
2.2 基因型分布
2017年10月—2019年10月,从140例(140/633)NoV阳性的牡蛎中共分离得到166条(含26例两种基因型混合污染)NoV的序列。利用Norovirus genotyping tool结合系统发育分析对已获得的166条NoV序列进行分型,结果(图2)显示:GI型和GII型分别占50.6%(84/166)和49.4%(82/166);在GI型中,以GI.3为主,占73.8%,其次是GI.4(25%)和GI.9(1.2%);在GII型中,数量较多的为GII.4(36.6%)和GII.3(35.4%),其次是GII.12(15.9%)、GII.2(7.3%)和GII.17(4.9%)。
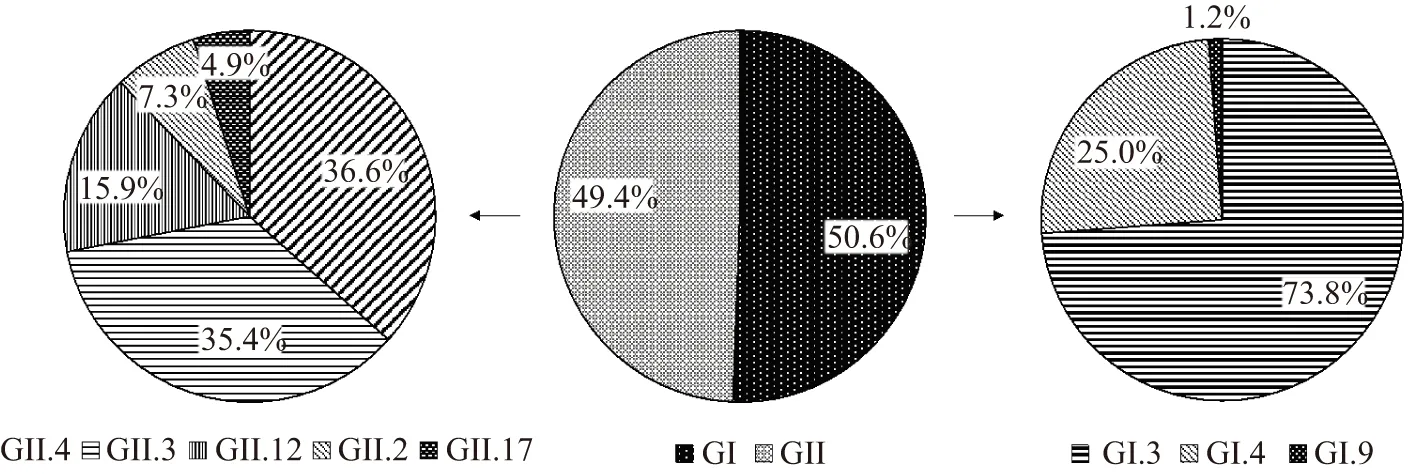
图由序列数(n=166)生成。图2 2017年10月—2019年10月从牡蛎分离到的166条诺如病毒序列的基因群和基因型百分比Figure 2 Genogroups and genotypes percentage of 166 sequences of noroviruses isolated from October 2017 to October 2019
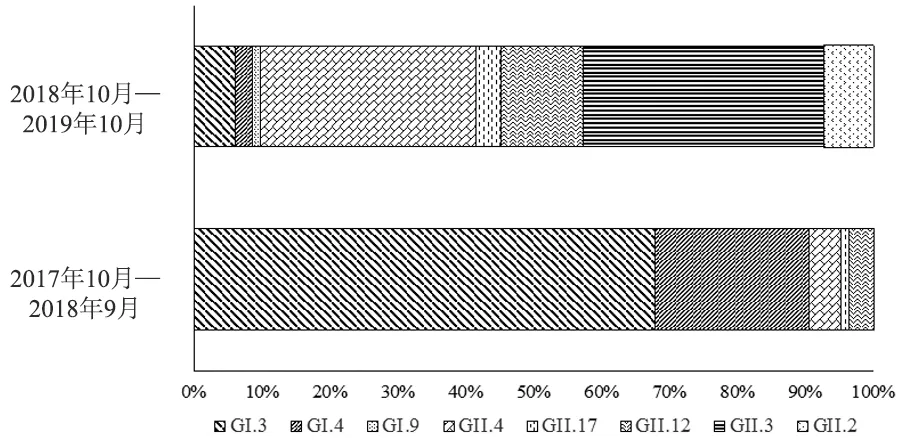
图由基因型的数目(n=166)生成。图3 2017年10月—2019年10月诺如病毒基因型的相对丰度Figure 3 Percentage of total norovirus genotypes from October 2017 to October 2019
2017年10月—2019年10月牡蛎源NoV基因型丰度的年度时间分布。结果(图3)表明基因型在这两年内发生了较大变化。2017年10月—2018年9月以GI型NoV为主,占89.4%,主要为GI.3(67.1%)和GI.4(22.4%);2018年10月—2019年10月NoV以GII型为主,占90.1%,分别为GII.3 (35.8%)、GII.4 (30.9%)、GII.12 (12.3%)、GII.2 (7.4%)和GII.17 (3.7%)。GII型成为牡蛎中的优势基因型,并且NoV的基因型比上一年同时期更丰富。
2.3 多基因型混合污染
本研究中,共有140例NoV阳性牡蛎检出,出现了26例多基因型混合污染的情况,占比18.6%。其中,25例为GII.3和GII.4的混合污染、1例为GI.9和GII.3的混合污染(表2)。这26例被多基因型混合污染的牡蛎都检出于2018年11月至2019年2月。
3 讨论
本研究报告了2017年10月至2019年10月对上海市售的牡蛎中NoV污染情况的监测结果,分析了共140例NoV阳性案例。牡蛎源GI型NoV的优势基因型为GI.3(图2)。Qin等[3]在分析2006—2016年人中NoV在中国的基因型和流行病学趋势时发现,GI.3也是人中GI型NoV的流行株;牡蛎源GII型NoV中占比高达84.2%的GII.4、GII.3、GII.2和GII.17这4个基因型(图2),在人中GII型NoV中占比达87.8%。同时,他们发现在此期间上海市人中NoV的流行株为GII.4和GII.17;而在本研究中这两种基因型在这两年均在牡蛎中被检出,说明GII.4和GII.17仍在环境中循环,一旦有机会,将会造成人中NoV的暴发。Yu等[7]研究发现GI和GII型NoV在人和牡蛎中的情况是不同的,牡蛎中GI型是优势基因型,而人中GII型是优势基因型。本研究发现2017年10月—2019年10月期间牡蛎源NoV优势基因型发生了从GI型到GII型的转变(图3),2018年10月—2019年10月GII型NoV占比达90.1%,这与人中NoV基因型分布趋同,因此这很可能是受外因影响,与养殖区域人的行为活动有关。Pu等[11]在分析日本牡蛎中诺如病毒基因型时,发现NoV基因型在人群中的传播与这些基因型在牡蛎中的检测之间存在相关性且有一定的时间差。Meghnath等[9]的研究表明,人类产生的污水是牡蛎中NoV的污染源。因此,在牡蛎养殖的过程中应严格把控水质与人的活动。
RNA重组是RNA病毒遗传进化的重要驱动力,也是RNA病毒基因型多样的原因之一[12]。Yu等[7]的研究发现3.7%的病毒序列存在基因重组现象,重组频率相对较高。目前重组NoV已成为继GII.4后主要的流行毒株[13]。重组菌株往往是多种NoV基因型共同感染一个宿主的结果[14],而多基因型的混合污染为NoV提供交叉混合和基因重组的机会。因此,本研究出现的较大比例的混合污染情况需要得到重视。本研究的数据表明,牡蛎中多基因型的混合污染和单基因型污染多发生于11月至次年2月(表2)。在这段时间食用牡蛎将面临很大的NoV感染风险。
尽管2018年10月—2019年10月期间牡蛎的阳性检出率比前一年低,但是2018年10月—2019年10月牡蛎源NoV的基因型多样性更丰富,且多为在人中占基因型优势的GII型NoV。26例多基因型混合污染的检出也都发生在此期间。因此,牡蛎中NoV的污染现状仍旧十分严峻。
因此,需要采取一些措施来应对食源性NoV感染风险。首先,我国需要持续和有效的监测系统,以便制定市售牡蛎食用安全评估;第二,应对牡蛎养殖制定详细的标准,加强对水质和养殖区域人活动行为的把控;第三,应对学校、卫生保健设施和社区加强预防感染的宣传,如熟食牡蛎,在NoV污染高峰期内尽量少食尤其不生食牡蛎等。
