基于网络药理学探究虾青素防治乳腺癌的分子机制
2021-08-24曹晓东杨冬冬赵晨宇王学梅张子英
张 楠,曹晓东,朱 浩,杨冬冬,赵晨宇,王学梅,张子英
(内蒙古医科大学 分子病理实验室 慢性病分子流行病实验室,呼和浩特 010110)
乳腺癌是女性最常见的恶性肿瘤,也是女性死于恶性肿瘤的主要原因[1]。近年来,我国乳腺癌发病率呈现逐年上升且年轻化的趋势,严重威胁女性的生命安全和生活质量[2]。研究表明乳腺癌主要与内分泌、生育、饮食、电离辐射、基因突变及遗传等多因素相关[3-4]。目前手术是治疗乳腺癌最有效的手段;对已经转移的或中晚期乳腺癌患者,化疗仍然是重要标准治疗手段,但耐药性及副作用制约其临床应用[5]。因此,迫切需要开发预防和治疗乳腺癌作用强、毒副作用低的天然化合物。
虾青素(astaxanthin, ASX)是叶黄素中的一类脂溶性类胡萝卜素,具有抗炎和氧化应激的特性,并有抗癌、抗衰老的作用[6]。迄今为止,还没有动物和人类因食用ASX产生明显不良反应的报道。因此,ASX在营养保健食品、食品添加剂和医药产品等多个领域均具有广阔的市场前景。ASX可抑制n-甲基-n-亚硝基脲(MNU)诱导的大鼠乳腺肿瘤[7]。ASX抑制多种不同类型肿瘤的生长,并负性调控乳腺癌细胞活力,抑制乳腺癌的侵袭、转移[8]。转移是恶性肿瘤患者死亡的主要原因,阻断肿瘤转移能提高肿瘤患者的生存率。ASX能减弱MDA-MB-231 (三阴性乳腺癌)的迁移能力,减弱乳腺癌细胞的转移能力[9]。
网络药理学结合生物信息学、分子生物学及各大相关数据库信息[10],可系统地探究“药物-靶点-疾病-通路”之间的相互作用,为整体研究药物的药效、毒性等作用提供了一定的理论基础,也为新药开发提供了新的思路[11],并增加了筛选靶向药物的成功率[12]。通过网络药理学可以构建药物-多基因-多靶点-乳腺癌模式。因此,为系统探究ASX抗乳腺癌作用,特进行网络药理学研究,旨在揭示ASX与乳腺癌的相互关系,阐明ASX对乳腺癌的抑制机制,为临床上更有效的开发、利用ASX防治乳腺癌提供科学依据。
1 方法
1.1 虾青素成分靶点的分析
利用PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库,输入Astaxanthin查找ASX 3D 结构;再通过STITCH(http://stitch.embl.de/)、Pharm mapper(http://www.lilab-ecust.cn/pharm mapper/)和BATMAN-TCM(Bioinformatics Analysis Tool for Molecular mechanism of TCM)(http://bionet.ncpsb. org/batman-tcm/)数据库,识别ASX有效成分的潜在靶点。利用BATMAN-TCM数据库时设置Target Prediction的Score cutoff值为20,Target Analysie的AdjustedP-value值为0.05。
1.2 乳腺癌靶点的获取
乳腺癌的靶点通过TTD(Therapeutic Target Database)(http://db.idrblab.org/ttd/)和OMIM(http://www.omim.org/)等网络数据库输入关键词breastcancer进行筛查,整合所有靶点并去除重复项,得到乳腺癌的疾病作用靶点。
1.3 虾青素成分靶点与乳腺癌疾病靶点互作
将预测到ASX的有效成分靶点和乳腺癌的预测靶点进行匹配,并通过Cytoscape 3.7.1软件,根据成分与靶点关联的程度、匹配的程度绘制对应药成分-靶点网络图。所获取的潜在靶点导入蛋白质相互作用在线数据库String(https://string-db.org)中,在Organism栏中选择Homosapiens,限定物种为人源,挖掘出核心调控靶点。基于此构建ASX靶点与乳腺癌靶点的蛋白质-蛋白质相互作用网络(protein-protein interaction,PPI)。
1.4 GO基因功能富集分析和KEGG通路富集分析
将ASX抑制乳腺癌的潜在作用靶点导入蛋白质相互作用在线数据库String(https://string-db.org/)中,选择Homosapiens,限定物种为人源,在基因本体论(Gene On-tology,GO)数据库中进行GO功能富集分析和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)中进行通路分析,并下载各分析的TSV 格式文件。通过多功能生物信息分析平台Omicshare(http://www.omicshare.com/tools/index.php/)对ASX抑制乳腺癌的生物过程、细胞组分、分子功能以及关键通路进行筛选与数据可视化处理。
1.5 细胞实验验证
1.5.1 细胞培养
乳腺癌4T1 细胞,以含7% FBS,100 U/mL青链霉素的RPMI-1640培养液,置于37 ℃、5% 的CO2培养箱中常规培养,细胞呈贴壁生长。每3 d 换液1 次,选取对数生长期的细胞,调整细胞浓度为1×106/mL进行实验。
1.5.2 MTT法检测细胞增殖情况
制备乳腺癌4T1细胞单细胞悬液,以每孔1×104接种于96孔板,设置不同浓度的ASX实验组,空白对照组(加入含有细胞的培养基),同时每组设5个复孔。37 ℃、5% CO2培养箱培养24~48 h,细胞贴壁后吸除原培养液,实验组分别加入100 μL不同浓度的ASX,空白对照组加入100 μL不含药物的培养基。同时使用3块96孔板进行上述步骤,37 ℃、5% CO2培养箱分别培养24、48和72 h。加入5 mg/mL MTT溶液10 μL,避光孵育4 h,吸净每孔液体,加入150 μL DMSO,避光低速震荡10 min,检测各孔OD490的吸光值。计算公式:抑制率=(对照组OD值-药物组OD值)/对照组OD值×100%。
1.5.3 Western Blot检测p-AKT和PI3K表达水平
PBS洗净培养瓶中的培养基,每瓶加300 μL 的蛋白裂解液,提取细胞总蛋白;用BCA 试剂盒测蛋白浓度做标准曲线计算出蛋白上样量。10%聚丙烯酰胺凝胶电泳 (SDS-PAGE) 分离蛋白质(60 μg),将电泳产物转移至PVDF 膜,一抗孵育PVDF膜4 ℃过夜,二抗室温孵育1 h,ECL显色后进行凝胶成像系统扫描拍照分析。
1.6 数据处理
Western Blot条带采用image J软件分析,GraphPad软件进行数据分析。
2 结果与分析
2.1 虾青素成分靶点的获得
利用STITCH、Pharm mapper和BATMAN-TCM数据库共获得ASX潜在靶点53个。
2.2 乳腺癌靶点的获取
以“breast cancer”为关键词,在OMIM数据库和TTD数据库中搜寻到靶点,整合所有靶点并去除重复项后共得到218个潜在的疾病作用靶点(图1)。
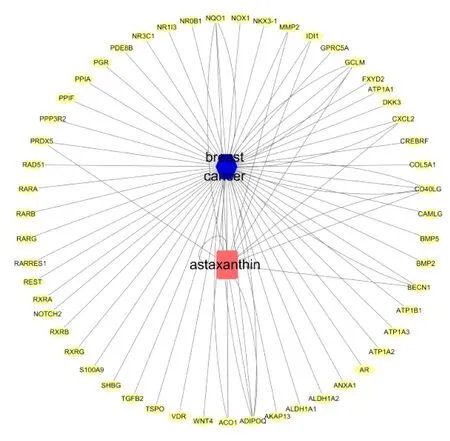
图1 虾青素-乳腺癌交互作用Figure 1 Interaction for astaxanthin-breast cancer
2.3 虾青素抑制乳腺癌靶点的网络互作分析
将ASX靶点与乳腺癌靶点进行比对,共获取交集靶点21个,并通过Uniprot数据库将靶点蛋白名转换为基因名(表1)。

表1 虾青素抑制乳腺癌主要靶点信息Table 1 Potential target information for astaxanthin in the inhibition of breast cancer
采用jvenn绘制ASX-乳腺癌交集基因图(图2)。
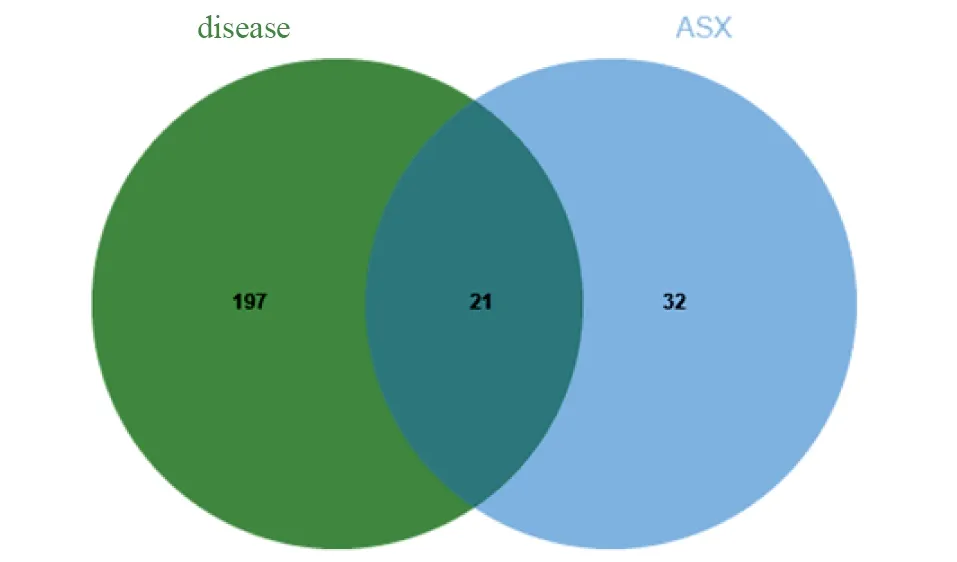
图2 虾青素-乳腺癌交集基因韦恩图Figure 2 Venn diagram for the targets of astaxanthin-breast cancer
把以上21个潜在作用靶点导入String数据库中构建其蛋白质-蛋白质相互作用网络(PPI),并下载TSV格式文件,导入Cytoscape中进行可视化处理,节点的颜色和大小反映网络中节点连接度(Degree)的大小,再基于Cytoscape平台内置的“NetworkAnalyer”功能对PPI网络进行拓扑学分析,得到所有靶点的节点连接度(Degree值)、节点紧密度(Closeness值)和节点介度(Betweenness值)等相关信息,将Degree排名前3的靶点ADIPOQ(B-cell lymphoma-2BCL2)、BECNI(NF-kappa-B essential modulator)和PGR(progesterone receptor)作为ASX抑制乳腺癌的关键作用靶点(图3)。
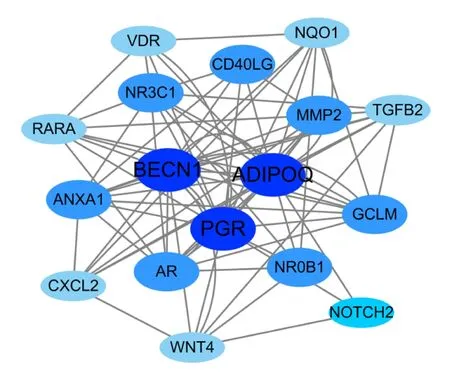
图3 ASX抗乳腺癌的靶蛋白网络互作图Figure 3 Network interaction diagram for the target proteins of breast cancer for the treatment of ASX
2.4 GO基因功能富集分析及KEGG通路富集分析
在GO分析中,筛选错误率(false discovery rate,FDR)值<0.05的生物过程,包括:参与转录调控、负性转录调控、低氧反应、信号转导、甾体激素介导、RNA聚合酶启动子的转录起始等生物进程(biology process),其中WNT4参与转录调控,并与ANXA1、AR、ANXA1和ADIPOQ调控乳腺癌细胞的生长发育;涉及细胞核、细胞质、细胞及胞外成分的改变等细胞组分(cellular component),其中S100A9广泛分布于细胞内外,CXCL2、TGFB2和MMP2主要分布在细胞外液;与甾体激素受体活性、DNA特异性序列结合、锌离子结合活性、转录因子活性、载体结合活性、受体活性、DNA和蛋白结合、RNA聚合酶的调控序列特异性DNA结合位点、RNA聚合酶转录因子活性等分子功能(molecular function)相关,其中PGR与甾体激素受体活性有关,MMP2与锌离子结合活性有关(图4)。
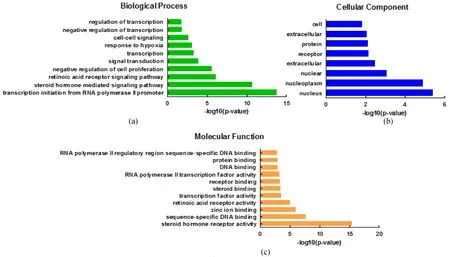
(a)生物过程分析结果; (b)细胞组分分析结果;(c)分子功能分析结果。图4 虾青素抑制乳腺癌的GO富集分析Figure 4 GO enrichment analysis of related targets of astaxanthin
KEGG富集的ASX抗乳腺癌的前22条通路,主要与免疫相关的通路有T、B淋巴信号通路、NF-κB、PI3K-AKT、癌症、Toll相关的信号通路(图5)。
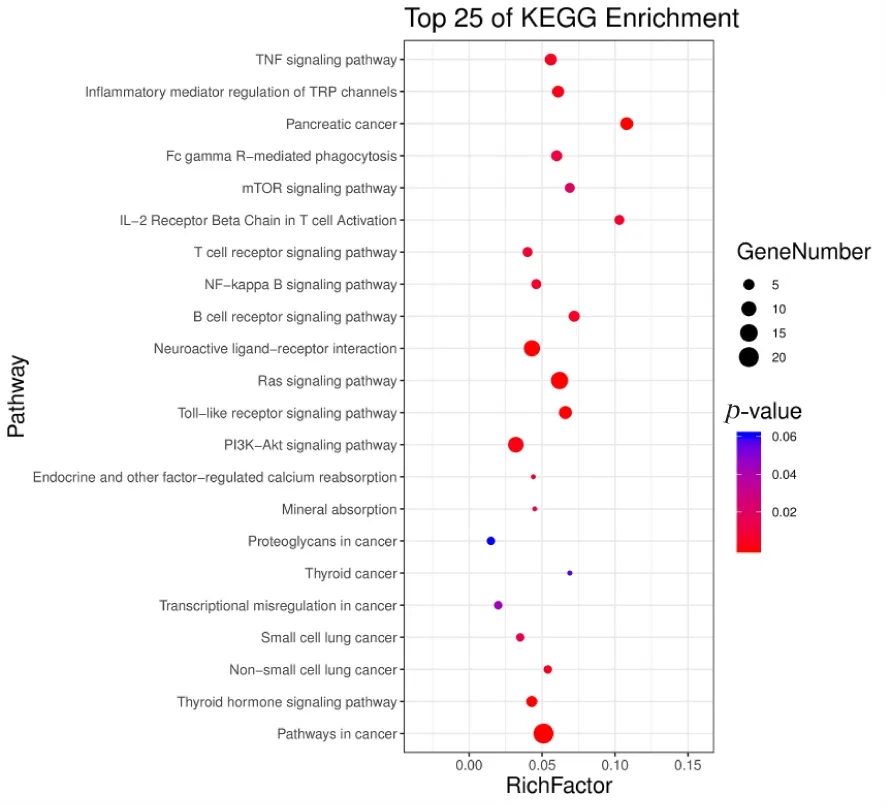
图5 KEGG通路分析结果Figure 5 KEGG enrichment analysis of related targets of astaxanthin
CD40LG、NOTCH2、MMP2、ANXA1、GCLM、RAD51、ADIPOQ和BECN1富集于PI3K-AKT信号通路,其中PI3K-AKT与T、B淋巴信号通路、NF-κB、Toll相关的信号通路有关(图6)。
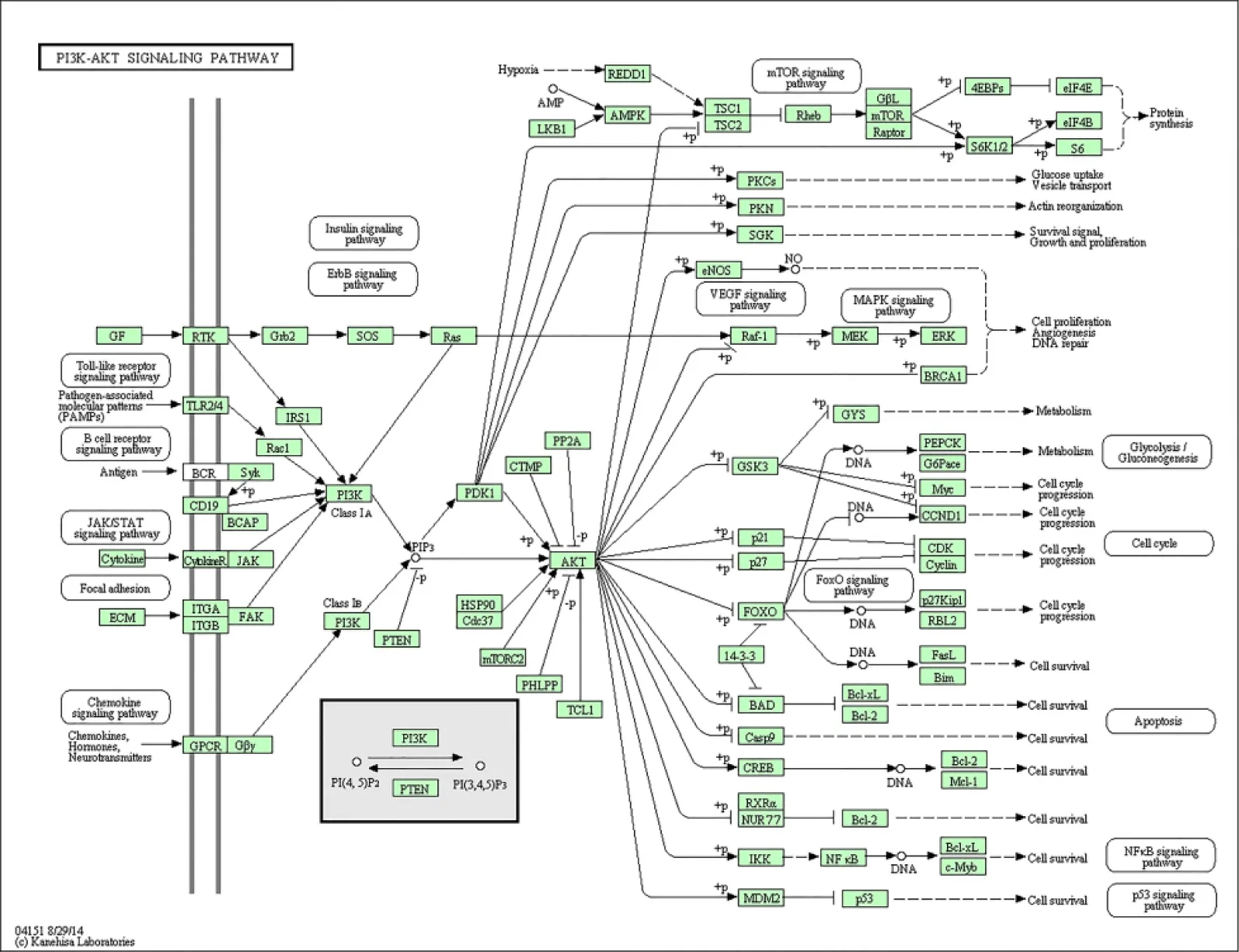
图6 PI3K-AKT信号通路图(https://www.kegg.jp/kegg-bin/show_pathway) Figure 6 The signaling pathway of PI3K-AKT
2.5 虾青素对乳腺癌细胞增殖的影响
结果显示,分别用ASX(50、150和300 μmol/L)处理乳腺癌4T1细胞24、48和72 h后发现,与空白组相比,150和300 μmol/L的ASX显著抑制4T1细胞生长(图7)。
2.6 虾青素对p-AKT、PI3K表达的影响
由结果可知,ASX作用于乳腺癌4T1细胞48 h后,与空白组相比,150和300 μmol/L的ASX可显著降低AKT的磷酸化;300 μmol/L的ASX可显著降低PI3K的表达水平(图8)。
3 讨论与结论
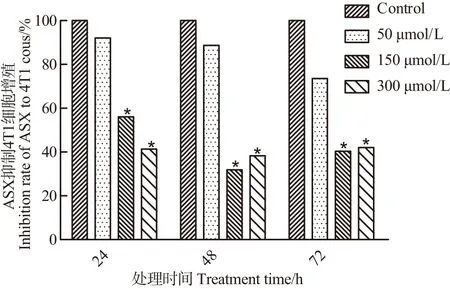
*:P<0.05。图7 虾青素对4T1乳腺癌细胞增殖的影响Figure 7 Effect of astaxanthin on proliferation of 4T1 breast cancer cells
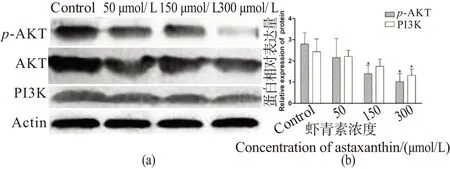
(a)虾青素对p-AKT、PI3K蛋白表达的影响; (b)虾青素对p-AKT、PI3K蛋白表达影响的分析结果。图8 虾青素对4T1乳腺癌细胞p-AKT、PI3K表达的影响Figure 8 Effect of astaxanthin on p-AKT and PI3K in 4T1breast cancer cells
ASX治疗是减少乳腺癌细胞增殖和迁移的有效方法[6,8-9],若ASX纳入抗癌治疗,将有助于控制肿瘤生长,并可能减少放疗和化疗相关副作用的影响,ASX抗乳腺癌的作用机制到底是什么,目前还未见相关报道。癌症本身就是一个多基因参与、涉及多种分子机制的复杂过程。网络药理学因其整体性、系统性的特点恰好解决了“药物-多靶点-多途径”的问题。
本研究利用网络药理学相关网页及软件,筛选和整理得到ASX 3个关键靶点与抗乳腺癌作用极为密切,包括ADIPOQ、BECNI和PGR。ADIPOQ干预乳腺癌细胞增殖与凋亡[13];BECNI是NF-kappa-B的必需调节剂,而NF-kappa-B与肿瘤发生和发展密切相关[14];PGR在调节乳腺癌细胞增殖和分化中发挥重要作用[15]。这3个靶点共同参与乳腺癌信号通路,干预癌细胞增殖与凋亡,调控乳腺癌的发生发展,这与网络药理学的药物成分-多靶点的特点一致,且ASX抗乳腺癌的作用靶点并非单独起作用,靶点间存在着相互作用关系,是一个相互作用的复杂网络。
为进一步分析ASX抗乳腺癌靶点所涉及的信号通路,本研究对ASX的靶点进行了KEGG通路分析。结果显示,PI3K/AKT途径为抑制乳腺癌主要的信号转导系统,ASX与乳腺癌交互基因CD40LG、NOTCH2、MMP2、ANXA1、GCLM、RAD51、ADIPOQ和BECN1也均富集于PI3K/AKT信号通路,且PI3K/AKT信号通路与网络药理学预测的多种差异明显的ASX的作用通路相互作用,因此本研究采用Western Blot方法验证了ASX对4T1乳腺癌中PI3K/AKT信号通路的影响。由于该通路多与免疫调控相关,后期为了验证PI3K/AKT在乳腺癌中的免疫调节作用,常选用具有免疫调节功能的BalB/C小鼠建立乳腺癌模型。前期本课题组曾将人癌细胞系接种于Balb/C小鼠,但未建模成功;而4T1细胞能成功接种于Balb/C小鼠,所以本研究后期选用该细胞系作为验证对象。结果显示ASX作用于乳腺癌4T1细胞后,显著降低了p-AKT和PI3K的表达水平,说明ASX可以通过PI3K/AKT调控乳腺癌细胞的凋亡及增殖,且本研究也证实ASX可以促进4T1乳腺癌细胞凋亡。此结果与网络药理学的分析结果一致。
研究发现,多种药物成分可通过PI3K/AKT信号通路抑制乳腺癌。如金雀异黄酮[16]通过抑制PI3K/AKT信号通路下调ADIPOQ的表达进而抑制三阴乳腺癌MDA-MB-231细胞生长;红花[17]多糖经PI3K/AKT通路诱导乳腺癌细胞MDA-MB-435 的凋亡;山慈菇[18]能通过PI3K/AKT 信号通路抑制乳腺癌细胞增殖。PI3K/AKT信号通路动态调控乳腺癌[19]等多种癌症的发生发展。有研究表明,ASX可以显著降低AKT的磷酸化,进而减少ADIPOQ,最终导致肠癌、口腔癌细胞的凋亡[20]。除PI3K/AKT信号通路外,本研究还发现了由TNF、Ras等介导的通路与ASX抗乳腺癌相关。文献报道ASX可以调节TNF信号通路中TNF-α的含量[21],并下调TNF-α诱导的IκB-α磷酸化[22]。TNF-α促进乳腺癌的转移[23],Takuya等[24]发现,Ras/Raf/MEK/ERK参与调控乳腺癌生长发育。而体内、外数据表明,PI3K / AKT和Ras / MEK / ERK具有多个交叉点和反馈回路,影响乳腺癌细胞的凋亡[25]。因此,我们选取PI3K/AKT信号通路作为验证对象。
本研究通过GO富集分析ASX防治乳腺癌的生物过程发现,ASX的作用靶点ADIPOQ、NOTCH2、ANXA1、RAD51和WNT4参与乳腺癌细胞的生长增殖调控;CXCL2、TGFB2和MMP2参与乳腺癌的免疫调节作用,并参与调控癌细胞的转移;NQO1 参与乳腺癌中的氧化应激反应。由此推断ASX可通过多靶点相互作用的机制,干预PI3K/AKT通路从而实现对乳腺癌的防治作用。且本课题组前期研究也发现,ASX具有抑制乳腺癌4T1细胞生长的作用,并可以增强免疫低下小鼠的免疫功能。
综上所述,本研究利用网络药理学,快速构建出“ASX-靶点-乳腺癌”的网络模型,有利于预测与分析ASX的作用途径和机制;并从网络分子药理学角度为ASX防治乳腺癌提供依据,并发现ASX通过PI3K/AKT信号通路多靶点干预乳腺癌,为临床上更有效地利用ASX防治乳腺癌提供理论依据,继而为防治乳腺癌提供新的指导。
