瘦素对骨关节炎中软骨细胞线粒体自噬状态的影响
2021-08-14运行,魏钰,魏民
运 行,魏 钰,魏 民
解放军总医院第一医学中心 骨科,北京 100853
骨关节炎(osteoarthritis,OA) 作为常见的退行性疾病,以软骨退变为特征表现[1]。当关节软骨中的唯一细胞群——软骨细胞受损时,其分泌的细胞外基质(extracellular matrix,ECM) 代谢 紊乱,导致关节内稳态失衡,最终发展为OA。线粒体自噬可清除去极化或受损的线粒体,保护细胞,是维持细胞稳态的主要机制[2]。当线粒体自噬受损时,损伤线粒体堆积在胞质内,促进胞内炎性反应,进一步导致软骨细胞死亡,ECM 降解,造成OA。瘦素是由脂肪、软骨等组织产生、ob基因表达的肽类激素[3]。既往研究表明,瘦素主要通过促进软骨细胞的分解代谢起到推动OA 发展的作用。但瘦素是否通过干预软骨细胞线粒体自噬过程促进细胞分解代谢目前未见报道。因此,本研究使用瘦素干预OA 软骨细胞,分别从mRNA及蛋白水平检测自噬相关因子的表达变化规律,从而探索瘦素在线粒体自噬调节中的作用及其与软骨细胞退变的关系。
材料和方法
1标本来源 软骨组织标本均来源于解放军总医院第一医学中心骨科因重度OA 行全膝关节置换术患者的废弃软骨组织。纳入标准:1)符合骨关节炎临床表现、影像学诊断标准;2)否认其他疾患。排除标准:1)既往关节感染病史;2)类风湿关节炎病史;3)术前传染病筛查乙肝、梅毒等阳性。取材位置分别位于胫骨平台内外侧,共14 例,其中男性4 例,女性10 例,年龄(60.6±4.26)岁。原发性OA 的诊断标准参照美国风湿病学会膝OA 诊断标准[4]。本研究获得解放军总医院第一医学中心医学伦理委员会批准,并征得患者术前知情同意。
2主要试剂和抗体 α-MEM 培养基、Ⅱ型胶原酶、HBSS 缓冲液、胎牛血清(Gibco)、GAPDH 单克隆抗体、Parkin 单克隆抗体、LC3A 单克隆抗体、LC3B 单克隆抗体、MMP-13 单克隆抗体(Abcam)、PBS 缓冲液(Corning);重组人瘦素(菲恩生物科技公司);总RNA 提取试剂盒、通用逆转录试剂盒(翊圣生物公司);Realtime PCR 荧光定量试剂盒、膜封闭液、SDS-PAGE 试剂盒(索莱宝公司)等。
3OA 原代软骨细胞的分离培养与干预 于全膝置换术中取下废弃的人胫骨平台软骨,无菌低温保存。在超净工作台内,采用无菌眼科剪将软骨片剪碎成1 mm3的小软骨块,加入8 倍体积的0.2%Ⅱ型胶原酶、2 倍体积的HSBB 液(含Ca2+),37℃消化2 h,离心5 min,弃上清。底部沉淀使用含20% FBS 软骨细胞培养基混匀,接种至75 mL 培养瓶中,置于37℃恒温、5% CO2体积分数及饱和湿度的孵箱中培养10 d,定期更换培养液。取生长状态良好的OA 原代细胞悬液以5×105/mL 的细胞密度接种于大号培养皿中,37℃、5% CO2孵育箱培养,每2 d 换液1 次,待细胞铺满70% 皿底后,更换为无血清的α-MEM 培养基培养24 h,使细胞周期相对同步化。将软骨细胞随机分为瘦素低浓度组(10 ng/mL)、瘦素高浓度组(100 ng/mL)以及空白对照组,瘦素原液稀释为工作液后采用移液枪分别加入细胞培养基中,轻晃摇匀。
4Parkin、LC3A、LC3B 和MMP13 基因表达检测 6 孔板培养软骨细胞,待细胞融合率达30%~40%时,采用Total RNA Extraction Kit 试剂盒提取细胞RNA,核酸蛋白分析仪检测RNA 含量与纯度,1%琼脂糖凝胶电泳确定RNA 片段的完整性。采用反转录试剂盒将RNA 反转录为cDNA。按照PCR 试剂盒说明书进行Parkin、LC3 和MMP13 mRNA 的检测。采 用ACTB(β-Actin) 为内参基因。利用2-ΔΔCT法分析相应基因表达,实验重复3 次,取均值。
5Parkin、LC3A、LC3B 和MMP13 蛋白表达检测 于瘦素干预24 h 后,检测线粒体自噬蛋白表达量。步骤如下:将培养液吸出,4℃预冷PBS 漂洗两遍,加入200 µL RIPA 蛋白抽提试剂(50 mmol/L Tris-HCl(pH 7.4),150 mmol/L NaCl,1% NP-40,0.1% SDS)和蛋白酶抑制剂Protease inhibitor cocktail(Roche),冰上孵育20 min 后,离心机1 200 r/min(4℃)离心20 min,取上清。95℃变性5 min。每组蛋白上样量为15 µg/孔,15% SDS-PAGE 电泳分离。之后采用恒定电流将目的蛋白转移至PVDF 膜上,转膜时间约90 min。将PVDF 膜完全浸没于5% BSA-TBST 中,水平摇床轻摇1 h。1%BSA/5% milk 稀释一抗,4℃水平摇床孵育过夜。次日,使用TBST 洗膜3 次,每次5 min 30 s。Milk Blocking Buffer 稀释二抗,山羊抗兔,山羊抗鼠IgG(H+L) HRP 1∶5 000,室温孵育50 min。TBST洗膜4 次,每次5 min。ECL 滴加到膜的蛋白面,反应3 min 30 s;胶片曝光10 s~5 min(曝光时间随不同光强度而调整),显影2 min,定影。应用Image J 软件扫描测定灰度值。
6JC-1 染色测定OA 软骨细胞线粒体膜电位 JC-1是一种广泛使用的小分子线粒体膜电位探针,当细胞内线粒体膜电位处于高水平状态时,JC-1 探针大多聚集在线粒体的基质中以聚合物形式存在,此时主要产生红色荧光;当线粒体膜电位下降偏低时,JC-1 主要为单体状态而产生绿色荧光,红/绿荧光强度比值降低。在共聚焦小皿中接种OA 细胞后,在37℃ 5% CO2培养箱中过夜培养。取适量JC-1 DMSO 储存液转移至微型管中后,加入适量的培养基立即吹打10 次混匀后配置成工作液加入培养皿中。在37℃ 5% CO2培养箱中培养30~60 min。除去上清液,用HBSS 洗涤细胞2 次。加入Imaging Buffer Solution 后在共聚焦显微镜下观察细胞线粒体红绿荧光强弱变化,应用Image J 软件定量分析红绿荧光比例。
7统计学方法 应用SPSS 22.0 软件进行统计学分析,所有数据以表示,两组间比较采用t检验,多组间比较采用单因素方差分析,多重比较采用LSD-t检验,P<0.05 为差异有统计学意义。
结果
1Parkin、LC3A、LC3B 和MMP13 基因表达结果 瘦素干预OA 软骨细胞后24 h,实验组软骨细胞内自噬相关基因Parkin、LC3A 及LC3B 表达量低于对照组,其中Parkin 与LC3A 基因表达量较对照组呈下降趋势,但差异无统计学意义;LC3B表达明显,差异有统计学意义(P<0.01);MMP13表达高于空白对照组(P<0.01)(图1)。

图1 不同浓度瘦素组干预人OA 软骨细胞24 h 后不同基因表达量(aP<0.01,vs control group)Fig.1 Expression of genes in human OA chondrocytes treated with different concentrations of leptin for 24 hours (aP<0.01,vs control group)
2Parkin、LC3A、LC3B 和MMP13 蛋白表达结果 瘦素干预正常软骨细胞24 h 后,低浓度组与高浓度组软骨细胞内自噬相关蛋白Parkin 和LC3B表达量低于空白对照组(P<0.05);LC3A 表达量低于空白对照组,但差异无统计学意义;随着瘦素浓度的增加,两个浓度组MMP13 表达量均逐渐增加,两组差异有统计学意义(图2,图3)。
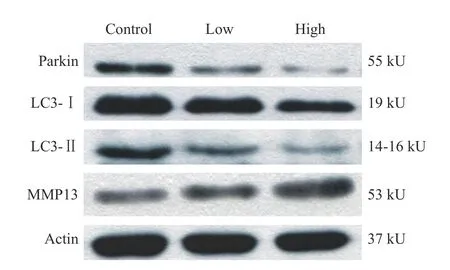
图2 不同浓度瘦素组干预24 h 后OA 软骨细胞线粒体自噬相关蛋白表达条带Fig.2 Expression of mitophagy related proteins in OA chondrocytes after 24 hours of intervention with different concentrations of leptin
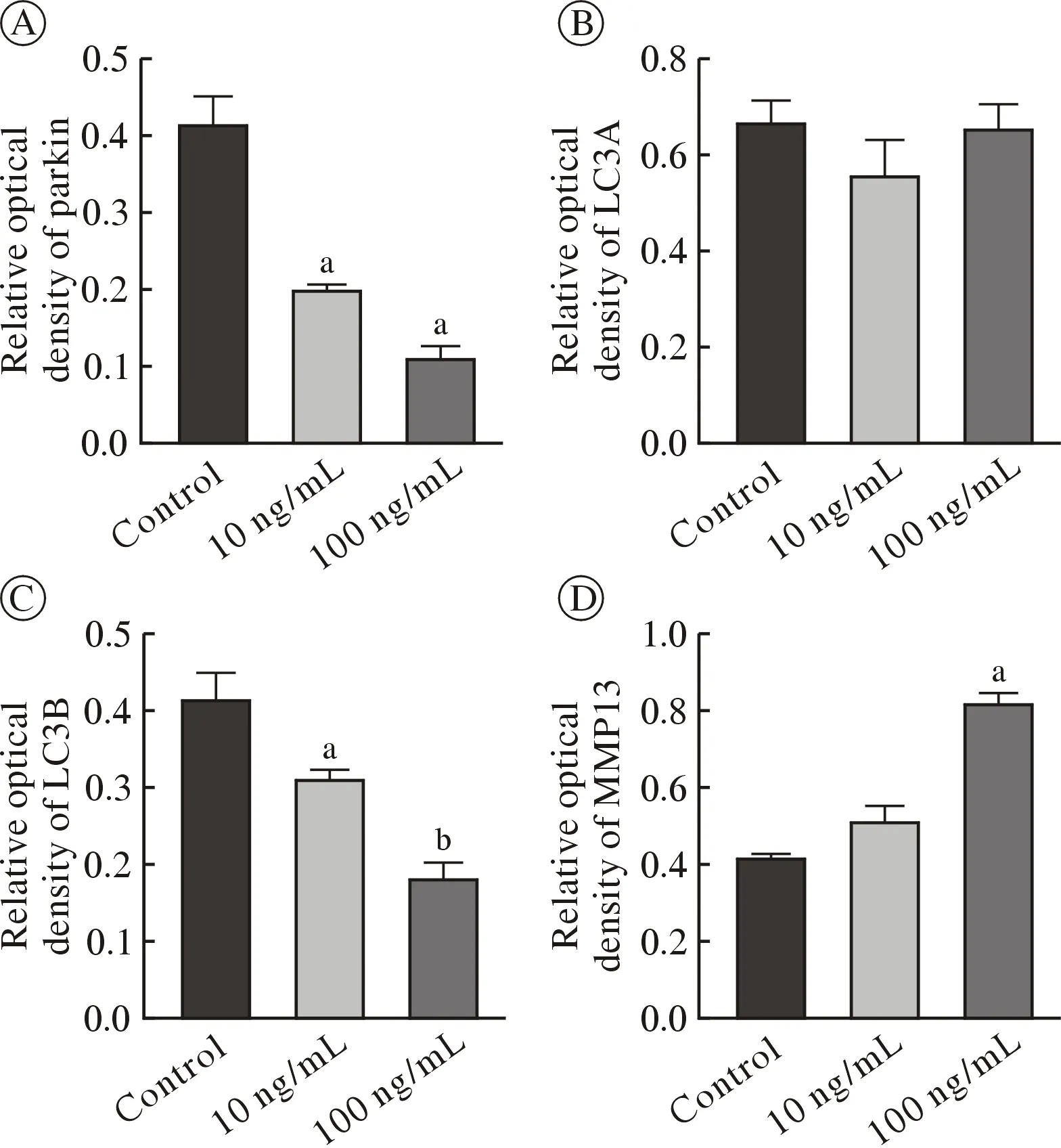
图3 不同浓度瘦素组干预OA 软骨细胞后线粒体自噬相关蛋白表达(aP<0.01 vs control group,bP<0.05 vs control group)Fig.3 Expression of mitophagy-related proteins in OA chondrocytes treated with different concentrations of leptin (aP<0.01 vs control group,bP<0.05 vs control group)
3OA 软骨细胞JC-1 探针观察及荧光强度测定 本研究中,OA 软骨细胞红绿荧光比值为1.36,瘦素干预后高、低浓度瘦素组红绿荧光比值均明显下降(P<0.05)(图4、图5)。

图4 共聚焦显微镜观察瘦素干预后线粒体膜电位的变化Fig.4 Changes of mitochondrial membrane potential after leptin intervention observed by confocal microscope
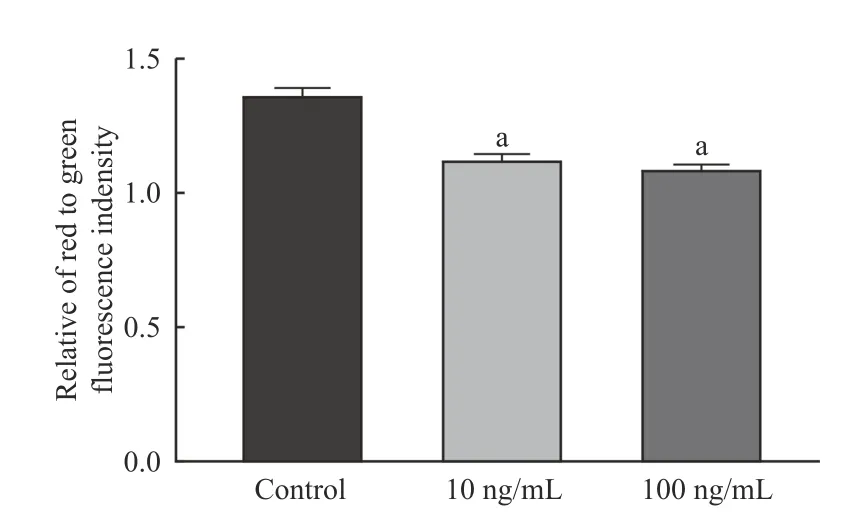
图5 不同浓度瘦素组干预OA 软骨细胞后荧光变化定量分析(aP<0.01 vs control group)Fig.5 Quantitative analysis of fluorescence changes after intervention in OA chondrocytes (aP<0.01 vs control group)
讨论
OA 是最常见的关节退行性疾病,通常表现为关节疼痛、肿胀以及活动受限等,影响了世界约2.5 亿人口[5]。OA 的病理过程非常复杂,主要表现为关节软骨退变,同时伴有软骨下骨硬化等诸多病理学改变[1]。成熟软骨由软骨细胞及其自身合成的ECM 共同构成。软骨细胞是关节软骨中唯一的细胞成分,其受损可导致ECM 合成及分解代谢失衡,关节内环境紊乱并进展为OA[6-7]。因此,寻找新的靶向信号通路和有效治疗途径,以提高软骨细胞活性,维持关节内环境稳态,是当前OA 研究的重要任务。
线粒体自噬可保护软骨细胞并为细胞提供能量,是维持细胞稳态的重要机制,对软骨细胞的正常运行具有重要意义[8-9]。Parkin 是一种泛素化连接酶,通过与上游分子联合对线粒体膜电位丢失做出应答,可启动受损线粒体清除过程。近年来发现OA 软骨细胞中线粒体自噬受损,Parkin 表达调控在其中起到重要作用[10]。当线粒体膜去极化时,膜外电位降低导致线粒体外膜内外失去电位梯度,Parkin 上游分子PINK1 无法进入内膜在线粒体膜外聚集。大量PINK1 聚集在线粒体表面可召集Parkin 及其他因子,启动线粒体自噬,将受损线粒体从线粒体网中分离出来,通过Parkin招募泛素结合因子p62,后者与LC3A 结合促进孤立膜对线粒体的包裹。通常LC3A 位于细胞质中,当游离的LC3A 转化为磷脂酰乙醇胺共轭的LC3B 黏附在自噬体外膜上,标志着自噬小体的形成,随后与溶酶体结合对其进行降解[11-13]。受损线粒体清除后可有效减少软骨细胞内的活性氧,降低氧化应激对细胞的损害,提高软骨细胞存活率。
瘦素是由ob 基因编码、167 个氨基酸组成的肽类激素,除脂肪组织外,包括各种关节组织在内的许多其他组织和细胞也产生瘦素[3]。研究证明关节软骨内存在瘦素受体表达,且瘦素对OA 的发展具有两面性。一方面,外源性瘦素应用后关节软骨的胰岛素样生长因子等蛋白表达增加,提示瘦素可能延缓软骨退化;另一方面,瘦素可介导和调节软骨和其他关节组织的许多炎症和破坏性反应[3,14-15]。瘦素在OA 关节软骨稳态中发挥促进分解代谢的作用[16-17]。前期研究发现瘦素干预人软骨细胞后,MMP1、MMP3 及MMP13 和其他炎性因子表达均增加[18]。体外实验证明敲低瘦素后MMP13 表达下降,软骨分解代谢减慢[19]。
为探究瘦素调控线粒体自噬对软骨细胞的影响,本课题组选取了Parkin、LC3A、LC3B 及MMP13 作为研究指标。结果发现,瘦素干预OA软骨细胞24 h 后,红绿荧光比值下降,提示软骨细胞线粒体膜电位进一步降低;Parkin 和LC3B 蛋白表达下降,且100 ng/mL 浓度干预较10 ng/mL浓度干预下降更多,提示线粒体自噬受损;MMP13 表达升高,100 ng/mL 浓度干预较10 ng/mL浓度干预升高更多(P<0.01),与既往研究一致[18]。此外,当MMP13 表达升高时,细胞代谢失衡,内环境紊乱,促进软骨退化[20]。而LC3A在瘦素干预后无明显变化,这可能是因为LC3A位于细胞质中,当线粒体自噬受抑制时,LC3A 未能转化为磷脂酰乙醇胺共轭LC3B,完成自噬小体对受损线粒体的包裹,这也从侧面解释了LC3B 表达下降的原因。瘦素作为促分解代谢的脂肪因子,不仅促进了MMP13 的表达,同时抑制了线粒体自噬Parkin、LC3B 蛋白的胞内表达。因此,可以推测瘦素可能通过降低线粒体膜电位使线粒体功能受损,同时抑制软骨细胞线粒体自噬,促进细胞分解代谢,打破关节软骨稳态,导致软骨退变。
本研究通过不同浓度的瘦素干预OA 软骨细胞,初步证明了瘦素对线粒体去极化的促进作用,以及瘦素在线粒体自噬调控中的抑制作用,这一作用可能是通过介导Parkin 信号通路来完成的。本研究从分子机制上部分验证了瘦素对OA 发展的促进作用,并论证了瘦素对线粒体自噬的抑制机制,可为OA 治疗提供新的靶点。
综上所述,瘦素可通过抑制Parkin 及LC3B等自噬蛋白表达,同时促进MMP-13 表达,一定程度上抑制软骨细胞线粒体自噬。然而,瘦素在线粒体自噬相关信号通路中的作用机制以及瘦素对软骨下骨中成骨细胞、破骨细胞等细胞中线粒体自噬的作用有待下一步研究。
