2 079例COVID-19患者主要并发症与基础疾病的关联性分析
2021-08-14王冠珍姚雅萍徐若男李元元穆秀颖王福生
王冠珍,姚雅萍,石 磊,陈 辉,张 超,甄 诚,徐若男,李元元,穆秀颖,7,黄 磊,王福生,4,7
1 解放军医学院,北京 100853;2 解放军总医院第五医学中心 感染病医学部,北京 100039;3 国家感染性疾病临床医学研究中心,北京 100039;4 南方医科大学,广东广州 510515;5 火神山医院,湖北武汉 430101;6 联勤保障部队第940 医院,甘肃兰州 730050;7 北京大学医学部,北京 100191
2019 年12 月起,新型冠状病毒肺炎(COVID-19)疫情在全球范围内肆虐。虽国内疫情已得到有效控制,但多地仍有散发病例[1]。患者感染新型冠状病毒(2019 novel coronavirus,2019-nCoV) 后以急性呼吸系统症状为主,由于其受体分布广泛,还可造成多器官损伤。除最常见的肺部病变外,心血管系统、消化系统、神经系统等均可累及。8%~12% 的患者出现心肌肌钙蛋白Ⅰ升高[2],2%~2.8%的患者曾出现脑卒中[3]。随着病情的进展,部分患者还会出现多脏器功能衰竭、脓毒症、休克、急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS)等严重并发症。已有研究证明COVID-19 患者合并恶性肿瘤与急性呼吸窘迫综合征的发生存在显著关联性,合并艾滋病与黄疸的发生也存在显著关联性[4]。根据患者入院时合并的基础疾病和基本信息提前判断患者可能出现的主要并发症,及早进行医疗干预,对于降低病死率和社会卫生经济成本有重大意义。本研究对患者的并发症发生情况进行了分析,探讨基础疾病与严重并发症的关联性,以期及早对特定人群做出预警,并为早期临床干预提供依据,减少严重并发症发生,降低临床死亡率。
资料与方法
1资料 收集火神山医院2020 年2 月4 日 -3 月29 日收治的2 970 例患者的临床资料,缺乏病情严重程度评估的病例(n=37)、出入院诊断不完整的病例(n=877)不纳入本研究。最终本研究共纳入2 079 例COVID-19 确诊患者,入组患者均为鼻咽拭子实时逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR) 阳性,或抗2019-nCoV 抗体检测阳性,或有典型的临床表现、影像学特征和密切接触史确诊入院。
2相关定义 截至火神山医院闭院,COVID-19 治愈出院、COVID-19 治愈转院进一步治疗其他疾病的患者定义为存活,院内死亡患者定义为死亡,个别未治愈转院者不在本研究范围内。一些患者患有某种疾病的同时还伴有影响代谢、免疫等功能的长期慢性并存性疾病,我们将入院诊断中的既往并存疾病定义为基础疾病,出院诊断中感染2019-nCoV 后新增疾病定义为并发症。所有数据均自火神山医院入院及出院记录中提取获得。
3方法 将患者按照年龄(青年组<45 岁、中年组45~69 岁、老年组>69 岁)、性别(男性、女性)、临床结局(生存、死亡)进行分组,描述患者临床特征。筛选与死亡事件关联性最强的主要并发症,并应用二元logistic 回归对主要并发症与基础疾病的关联性进行分析。
4统计学方法 本研究使用SPSS26.0 软件进行统计分析,患者的流行病学和临床特征采用描述性分析。计量资料以表示,计数资料以例数(百分比)表示。计数资料的差异性分析采用χ2检验或Fisher 精确概率检验;二分类变量的关联性分析采用logistic 回归。统计推断检验水准为双侧α=0.05。
结果
1患者基本资料 本研究所收集的2 079 例COVID-19 患者中,男性1 085 例(52.19%),女性994 例(47.81%);患者平均年龄(58.460± 14.477)岁。青年组377 例,中年组1 200 例,老年组502 例。合并至少一种基础疾病者1 088 例(52.33%),有至少一种并发症者173 例(8.32%);死亡49 例(2.36%)。死亡组患者中男性32 例(65.31%),女性患者17 例(34.69%),死亡组与存活组的性别分布无统计学差异(χ2=3.461,P=0.063);死亡组年龄显著高于存活组[(70.86±10.90)岁vs(58.16±14.42) 岁,P<0.001],不同年龄段患者在两组中的分布有统计学差异(χ2=52.343,P<0.001),老年组死亡人数、死亡比例最高,其次为中年组;合并基础疾病(χ2=10.807,P=0.001) 和患有并发症(χ2=253.568,P<0.001)者在两组中的分布有统计学差异。死亡组与存活组住院时间无统计学差异[(15.88±12.76) dvs(14.76±8.57) d,P=0.545]。见表1。
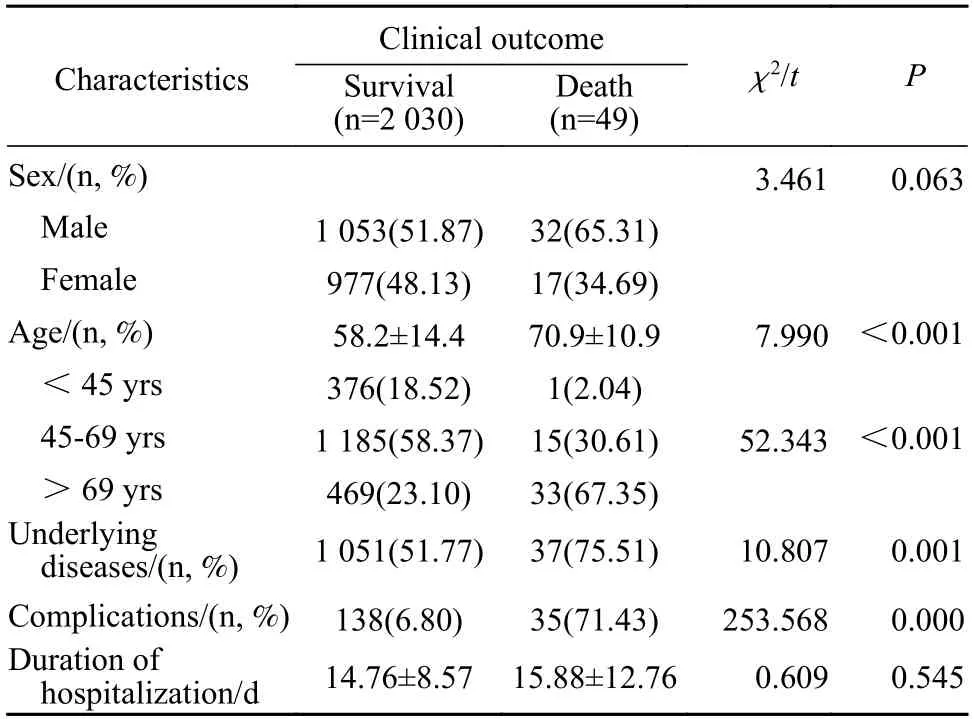
表1 COVID-19 患者基本资料Tab.1 Basic information of COVID-19 patients
2并发症相关死亡率分析 生存组与死亡组多脏器功能衰竭(χ2=686.596,P<0.001)、呼吸衰竭(χ2=391.827,P<0.001)、休克(χ2=389.881,P<0.001)、心功能不全(χ2=335.260,P<0.001)、ARDS(χ2=247.216,P<0.001)、脓毒症(χ2=167.289,P<0.001)、肾功能不全(χ2=62.737,P<0.001)、电解质紊乱(χ2=47.363,P<0.001)、弥散性血管内凝血(disseminated intravascular coagulation,DIC)(χ2=45.904,P=0.001)、血液系统异常(χ2=39.231,P<0.001)、消化道出血(χ2=34.305,P<0.001)、胸腔积液(χ2=12.334,P=0.006)、肝功能异常(χ2=8.329,P=0.008) 发生率差异均有统计学意义。不同并发症与死亡事件的相关程度并不相同,多脏器功能衰竭、呼吸衰竭、休克是对死亡事件影响程度最高的3 种主要并发症。见表2。
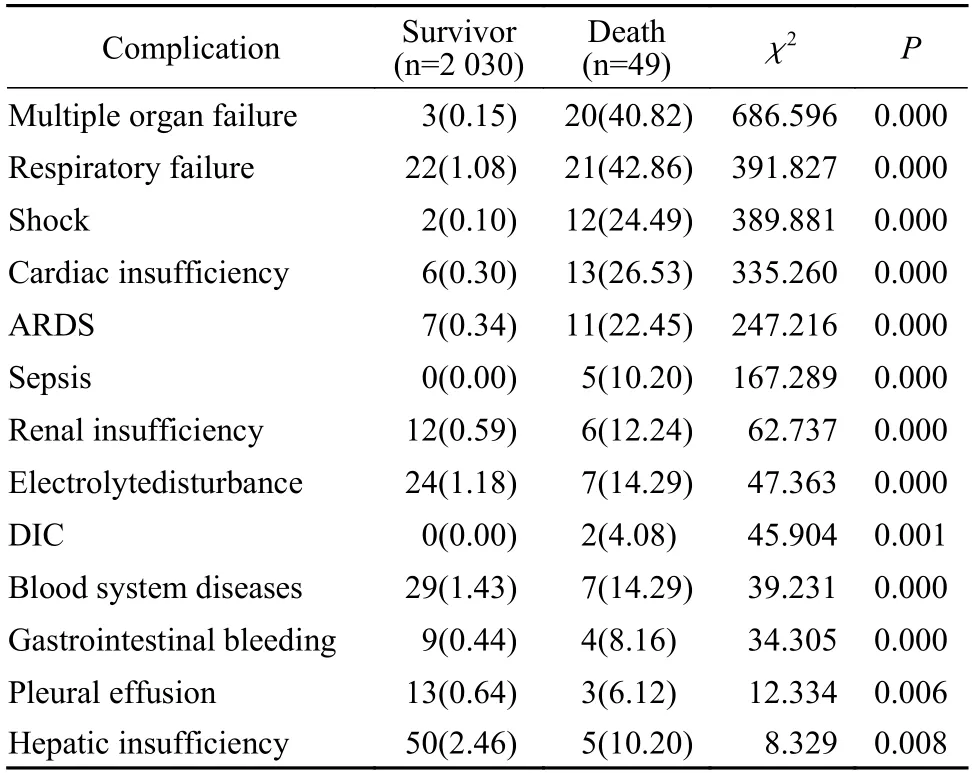
表2 生存组与死亡两组并发症发生率比较(n,%)Tab.2 Comparison of complication rates between the survival group and the death group (n,%)
3基础疾病与严重并发症的关联性分析 我们将入院患者的基础疾病进行整理,其中高血压是患病率最高的疾病,低蛋白血症(P=0.002)和心脏病(P=0.003)与死亡事件有显著关联性(表3)。我们进一步分析了基础疾病对主要并发症的影响,虽然DIC 和脓毒症的死亡率、凶险程度较高,但由于这两种疾病的患病人数较少,导致统计学结果误差较大,χ2较小,因此未进行进一步分析。研究发现,基础疾病不仅可直接影响死亡事件的发生,还可通过增加并发症的发生率加重感染症状、提高死亡风险。低蛋白血症(P=0.038)、心脏病(P=0.002)、糖尿病(P=0.017) 与多脏器功能衰竭有显著关联性;同时,低蛋白血症(P<0.001)、心脏病(P=0.001)、糖尿病(P=0.013) 还与呼吸衰竭有显著关联性;低蛋白血症与休克有显著关联性(P<0.001)(表4~ 表6)。
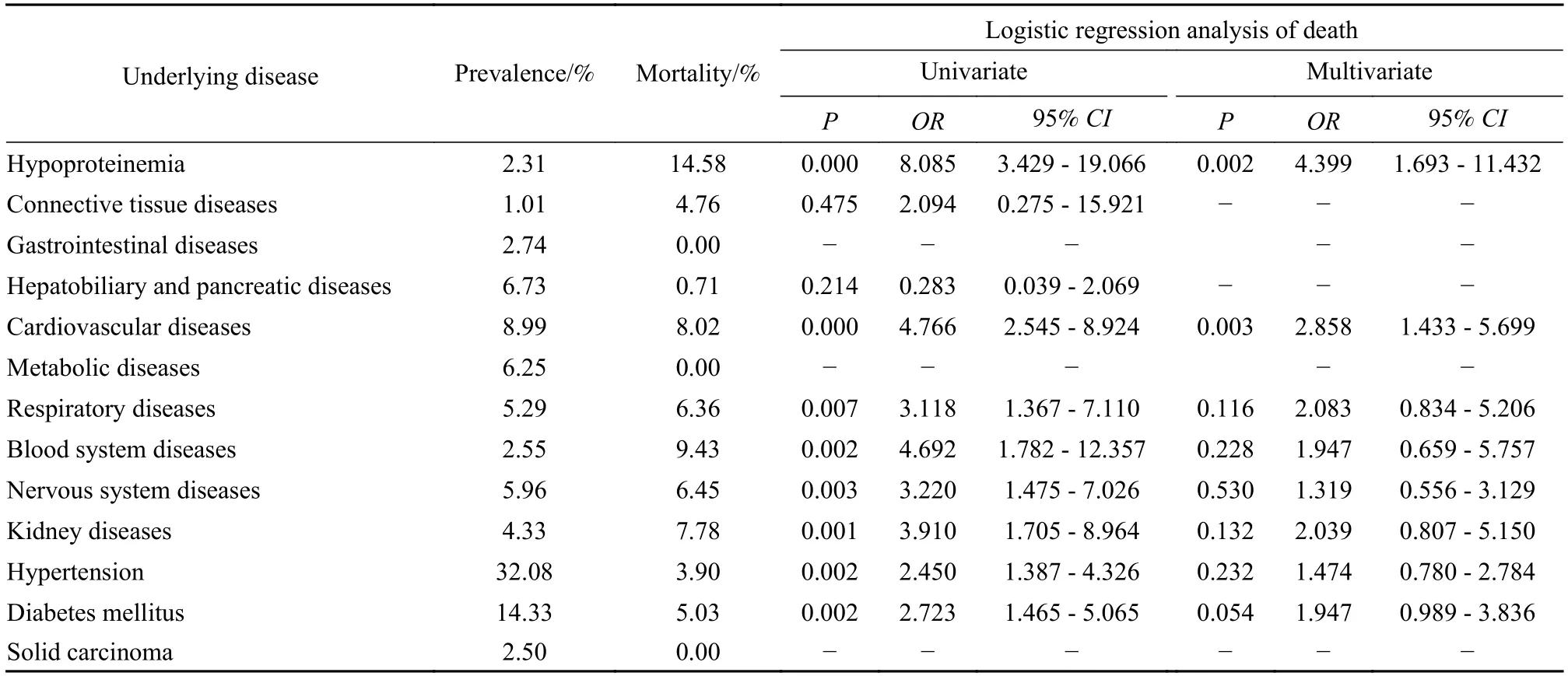
表3 基础疾病发生情况及死亡的单因素及多因素回归分析Tab.3 Logistic regression analysis of association between underlying diseases and death
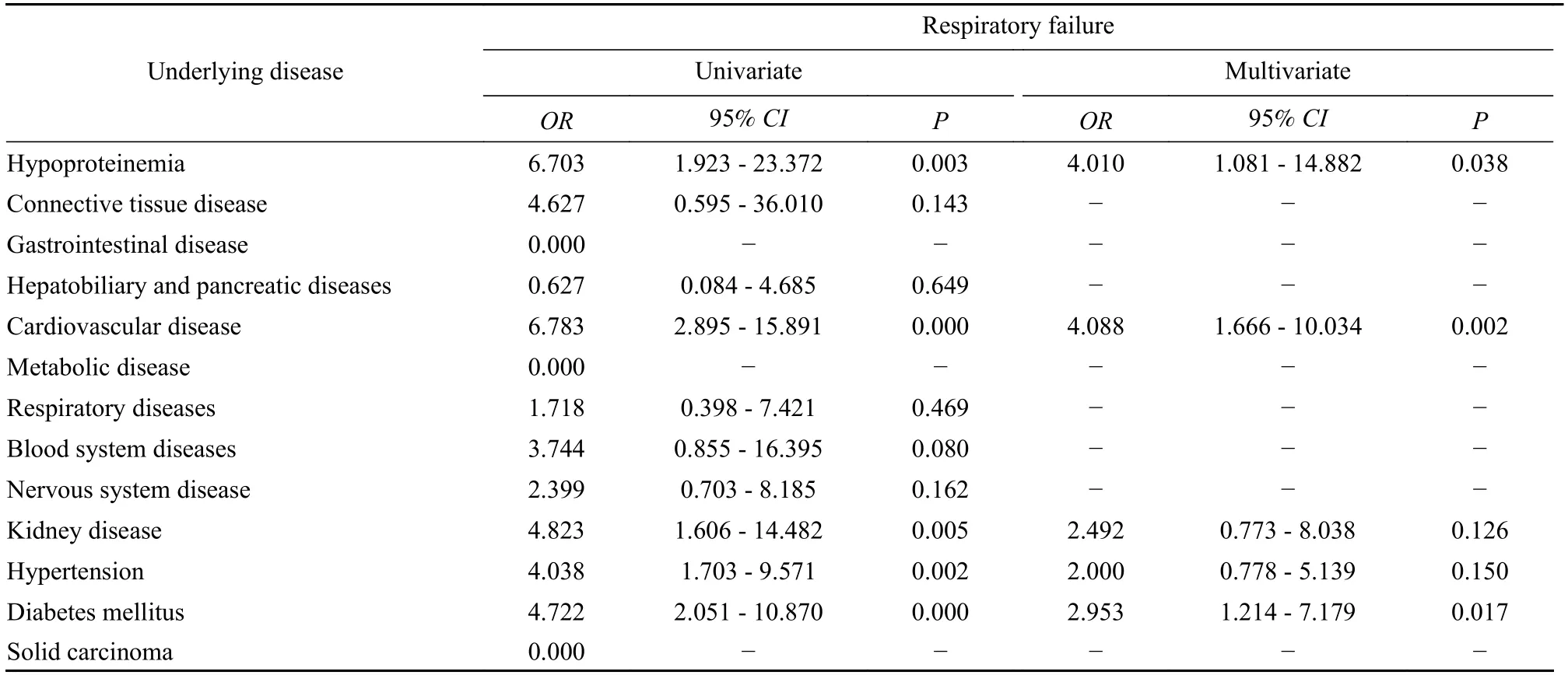
表4 多脏器功能衰竭的单因素及多因素logistic 回归分析Tab.4 Logistic regression analysis of association between underlying diseases and multiple organ failure
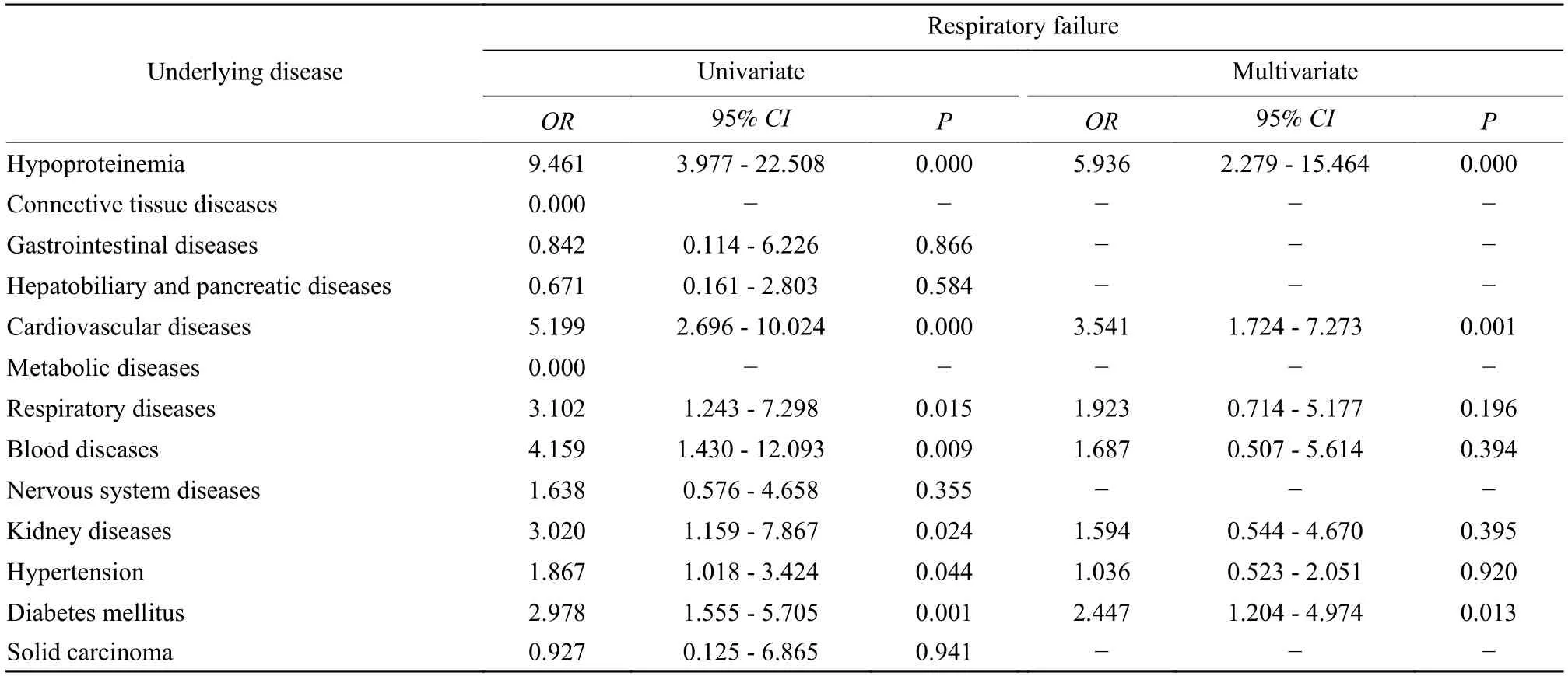
表5 呼吸衰竭的单因素及多因素logistic 回归分析Tab.5 Logistic regression analysis of association between underlying diseases and respiratory failure
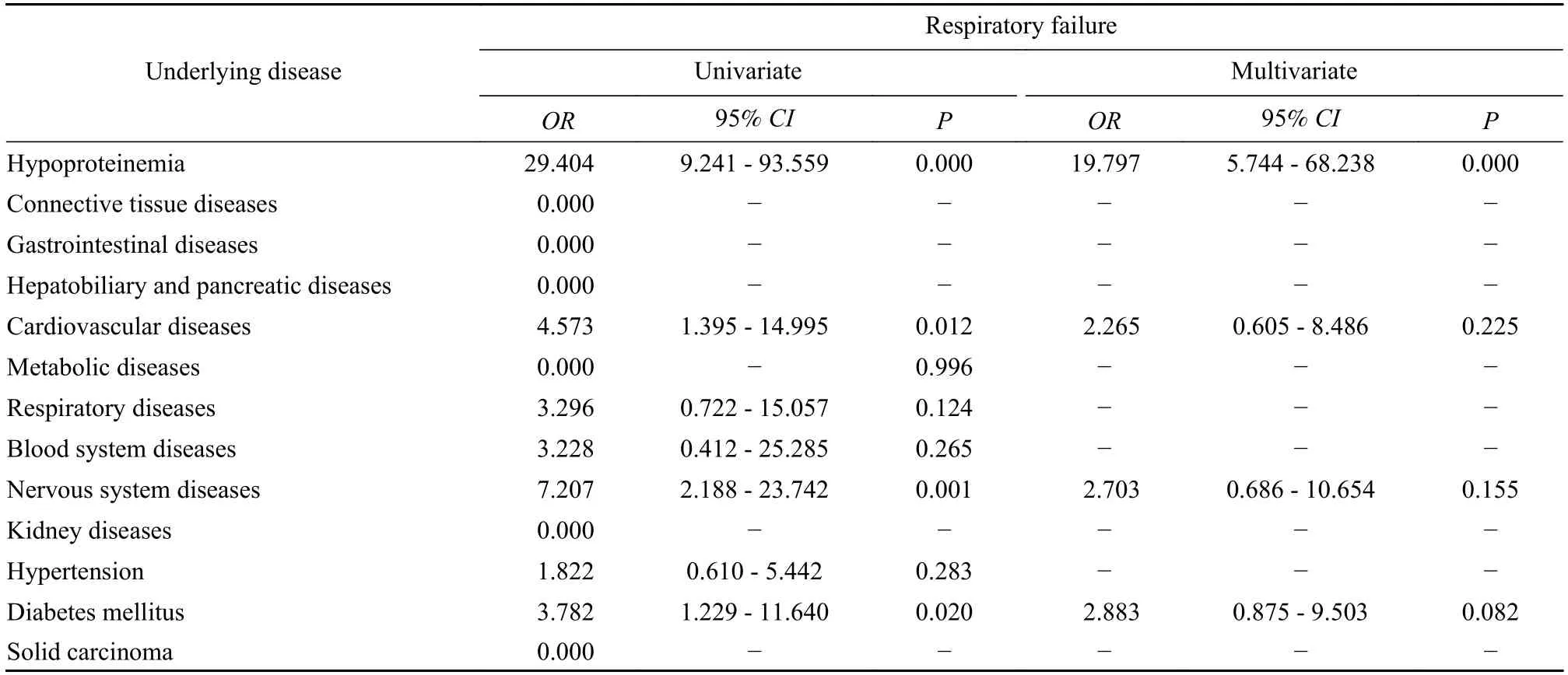
表6 休克的单因素及多因素logistic 回归分析Tab.6 Logistic regression analysis of association between underlying diseases and shock
讨论
COVID-19 的大流行在全球范围内给人类健康造成重大威胁,感染后可出现多系统受累[1],已有研究证明,合并某些基础疾病的患者更易继发严重并发症,加重疾病严重程度,提高病死率。根据患者的基础疾病早期预判特定严重并发症发生的可能,并予以医疗干预可降低患者病死率。
糖尿病对COVID-19 患者预后的影响被研究者广泛关注。有研究显示Ⅱ型糖尿病与患者呼吸衰竭的发生有显著关联性[1,5],且通过与高血压的协同作用,进一步增加患者进展为重症的风险[6]。我们的研究发现糖尿病还与多脏器功能衰竭和呼吸衰竭有显著关联性,这可能与甲型流感病毒感染中细胞因子风暴发生的机制类似,高血糖状态下N-乙酰氨基葡萄糖转移酶/干扰素调节因子5(OGT/IRF5)通路活化,可增加病毒复制及IL-6 等细胞因子的产生[7],增加细胞因子风暴的风险,在感染的基础上加重组织损伤,继而出现多脏器功能衰竭和呼吸衰竭。心脏病不仅与休克和多脏器功能衰竭有显著关联性,也增加了死亡事件的风险。机体的免疫状态与凝血功能息息相关[8-9],高凝状态可使心肌缺血、缺氧程度加重,且感染2019-nCoV 后,机体处于相对高代谢的状态,心脏的代谢需求增加,可能加重心肌缺血,诱发有心脏基础疾病的患者出现心功能不全,而心功能不全又可导致全身组织器官灌注不佳,肺泡组织可能更易出现通气-血流比例失衡、肺淤血、肺水肿等情况,继而出现呼吸衰竭或多脏器功能衰竭[10-12]。已有研究证明低蛋白血症与患者合并休克有显著关联性,这可能是因为白蛋白作为一种抗炎蛋白,可参与抑制细胞因子风暴;炎症反应还可通过增加毛细血管渗透性,使血清白蛋白渗透到组织间隙中,加重低蛋白血症的程度[13-14]。我们的研究还发现低蛋白血症与COVID-19 患者发生呼吸衰竭、多脏器功能衰竭和死亡有显著关联性,这可能与低蛋白血症促使慢性阻塞性肺疾病(chronic obstructive plumeria disease,COPD)患者进展为呼吸衰竭的机制类似[13,15-17]。虽然在研究中很难衡量低蛋白血症是原发疾病还是在病程中出现的一种并发表现,但在疾病初期的低白蛋白水平可作为预后不佳的预测因素是毋庸置疑的。除对特定基础疾病的患者予以关注外,年龄也与患者继发呼吸衰竭有显著关联性,老年个体中的初始T 细胞比例较少,随着年龄的增长淋巴细胞百分比降低,肺组织中抗原呈递细胞的数量减少,从而导致感染后肺泡T 细胞反应减弱[18-19],肺部损伤程度较青中年患者更重。
这些结果提示我们,糖尿病患者的临床管理中要控制其血糖水平,心脏病患者应调整其容量负荷、密切监测心功能,低蛋白血症患者应及时补充白蛋白。同时,应密切关注这三类患者的肝肾功能、动脉血气及血流动力学指标,这对多脏器功能衰竭、呼吸衰竭和休克的预防是非常必要的。通常,患者的基础疾病与发病后的并发症存在相互影响、相互促进的关系。密切关注COVID-19 患者基础疾病,如糖尿病、心脏病、低蛋白血症,监测相应检验、检查结果,及早发现某些严重并发症的发生倾向并进行医疗干预,可在一定程度上减少严重并发症的发生,降低病死率。
