Aurora-A调控间充质干细胞向肝癌相关成纤维细胞转化对肝癌细胞增殖、侵袭和迁移的影响
2021-08-07王以浪
冯 秀,陈 颖,王以浪
(1南通大学第二附属医院肿瘤科,南通 226001;2南通大学附属肿瘤医院肿瘤内科;*通讯作者,E-mail:1764119488@qq.com)
肿瘤微环境(tumor microenvironment,TME)由包括成纤维细胞、内皮细胞、免疫细胞、前体细胞、癌细胞在内的异质细胞以及细胞外环境组成,这些细胞类型及环境的变化可影响肿瘤的生长和转移[1-3]。间充质干细胞(mesenchymal stem cells,MSCs)具有多向分化潜能,是TME的重要构成部分,对肿瘤的发生和转移具有重要影响[2]。肿瘤相关性成纤维细胞(carcinoma-associated fibroblasts,CAFs)在促进和维持癌症方面具有重要作用,其来源的主要前体细胞是骨髓和脂肪成纤维细胞及间充质干细胞[4,5]。Aurora-A在多数细胞类型中均有表达,在调节细胞周期从G2期到胞质分裂过程中具有极其重要的作用,在已有的研究中发现,Aurora-A作为癌基因在肝癌等多种肿瘤中发挥促癌作用[6]。目前关于Aurora-A在肿瘤中的作用机制研究甚多,但关于其对肝癌细胞增殖、侵袭和迁移的影响是否可能与其参与调控MSCs向hCAF转化有关还未可知,因此,本研究通过对其研究,以期为Aurora-A在HepG2中的功能机制研究提供进一步的参考依据。
1 材料与方法
1.1 试剂和仪器
hAD-MSCs细胞(货号:ZQ0309)、DMEM培养基(货号:ZQ-100)购自上海中乔新舟生物科技有限公司;HepG2细胞系(货号:CL-0103)购自武汉普诺赛生命科技有限公司;细胞增殖及毒性检测试剂盒(Cell counting Kit-8,CCK-8,货号:BB-4202)购自上海贝博生物科技有限公司;LipofectamineTM2000 Transfection Reagent(货号:11668027)、NC和shRNA慢病毒质粒购自赛默飞世尔科技;兔抗人Aurora-A抗体(货号:abs110826-50ul)购自爱必信(上海)生物科技有限公司;兔抗人α-SMA、Desmin、FSP、GAPDH、山羊抗兔IgG二抗抗体(货号:K10018-WXC、K14063-KHR、K28020、K16389-KDP、WE0381-QAN)均购自北京百奥莱博科技有限公司;兔抗人FAP、Tsp-1抗体(货号:orb579794、orb124902)购自武汉博欧特生物科技有限公司;蛋白提取试剂盒(货号:SD-001/SN-002)英文特生物技术(北京)有限公司;BCA蛋白检测试剂盒(货号:23250)购自上海嵘崴达实业有限公司。
蛋白凝胶成像仪购自美国Bio-Rad公司;RT2100C全自动酶标仪购自德国IFP公司。
1.2 细胞培养
将hAD-MSCs细胞和HepG2细胞系复苏,在DMEM培养基(含胎牛血清10%、100 U/ml青霉素-100 mg/ml链霉素)中置于37 ℃、5% CO2恒温培养箱中培养。每两天更换一次培养基,通过胰酶消化进行传代培养,将所得细胞以1 000 r/min,离心5 min,弃上清,PBS洗涤去酶液备用。
1.3 实验方法
1.3.1 hAD-MSCs细胞和HepG2细胞共培养 将已复苏的hAD-MSCs细胞和HepG2细胞分别接种到Transwell 6孔板上层和下层,37 ℃、5%CO2共培养3 d。
1.3.2 shRNA慢病毒转染 将HepG2及hAD-MSCs细胞分为HepG2组(单独HepG2培养)、hAD-MSCs组(单独hAD-MSCs培养)、hAD-MSCs+HepG2组(hAD-MSCs+HepG2共培养)、NC组(用无关序列NC转染肝癌HepG2细胞系后与hAD-MSCs细胞共培养)和Aurora-A-shRNA组(用shRNA慢病毒转染肝癌HepG2细胞系后与hAD-MSCs细胞共培养)。在96孔板中使用NC和shRNA慢病毒质粒转染HepG2细胞于37 ℃、5%CO2恒温培养箱中培养过夜,更换无病毒DMEM培养基(无双抗)培养过夜后进行传代培养,2 d后添加1 μl/ml嘌呤霉素进行阳性克隆筛选,直至筛选出阳性克隆进行细胞扩大培养,然后将NC组和Aurora-A-shRNA组HepG2细胞分别与hAD-MSCs细胞共培养3 d。
1.3.3 Western blot检测hAD-MSCs细胞、HepG2蛋白表达情况 采用BCA蛋白试剂盒对hAD-MSCs、HepG2总蛋白含量进行测定(n=6)。采用SDS-PAGE电泳后低温转膜,用脱脂奶粉封闭1 h,添加兔抗人Aurora-A、α平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)、肌间线蛋白(Desmin)、成纤维细胞激活蛋白(fibroblast activation protein,FAP)、血小板反应蛋白/凝血酶敏感蛋白1(Tsp-1)、成纤维细胞特异性蛋白(FSP)、GAPDH一抗,4 ℃孵育过夜,添加山羊抗兔IgG抗体二抗孵育2 h。在蛋白凝胶成像仪下对Aurora-A、α-SMA、Desmin、FAP、Tsp-1、FSP蛋白进行定量分析。
1.3.4 CCK-8法检测HepG2细胞增殖抑制率 取对数生长期细胞,并将细胞浓度稀释为1×105个/ml接种于96孔板中培养。根据试剂盒说明书使用CCK-8法检测HepG2组、共培养组、NC组和Aurora-A-shRNA组HepG2细胞增殖抑制率(n=6),在570 nm处测定吸光度OD值,计算细胞增殖抑制率:细胞抑制率(%)=[(对照组OD值-实验组OD值)/(对照组OD值-空白组OD值)]×100%。
1.3.5 Transwell法检测HepG2细胞侵袭和迁移能力 侵袭实验:分离出HepG2细胞,Transwell小室上室用Matrigel胶所包被,将HepG2细胞浓度调整为2.5×105个/ml,取200 μl悬液接种于上室,下室加入DMEM培养基500 μl后培养24 h,PBS清洗;用棉签擦去上室未穿膜细胞;甲醇进行30 min固定、0.1%结晶紫溶液进行30 min染色,随机选取6个视野内所观察到的穿膜细胞并计数。
迁移实验:Transwell小室上室未被Matrigel胶所包被,其余处理与侵袭实验相同。
1.4 统计学方法

2 结果
2.1 hAD-MSCs细胞中CAF相关蛋白表达情况
与hAD-MSCs组相比,hAD-MSCs+HepG2组和NC组hAD-MSCs细胞中CAF相关蛋白α-SMA、Desmin、FAP、Tsp-1、FSP表达水平显著增加(P<0.05)。与hAD-MSCs+HepG2组相比,NC组细胞内CAF相关蛋白表达水平无显著变化(P>0.05),而在Aurora-A-shRNA组则显著降低(P<0.05,见图1)。

与hAD-MSCs组相比,aP<0.05;与hAD-MSCs+HepG2组相比,bP<0.05图1 不同处理后hAD-MSCs细胞中CAF相关蛋白表达情况Figure 1 Expression of CAF-related proteins in hAD-MSCs after different treatment
2.2 Aurora-A转染效果检测
与hAD-MSCs+HepG2组相比,NC组Aurora-A表达水平无显著变化(P>0.05),Aurora-A-shRNA组Aurora-A表达水平显著降低(P<0.05,见图2)。
2.3 HepG2细胞增殖情况
与HepG2组相比,hAD-MSCs+HepG2组和NC组HepG2细胞增殖抑制率显著降低(P<0.05);与hAD-MSCs+HepG2组相比,NC组细胞增殖抑制率无显著变化(P>0.05),而在Aurora-A-shRNA组则显著增加(P<0.05,见图3)。
2.4 检测HepG2细胞的侵袭和迁移能力
与HepG2相比,hAD-MSCs+HepG2组与NC组HepG2细胞侵袭和迁移细胞数显著增加(P<0.05);与hAD-MSCs+HepG2组相比,NC组细胞侵袭和迁移细胞数无显著变化(P>0.05),而Aurora-A-shRNA组则显著降低(P<0.05,见图4)。
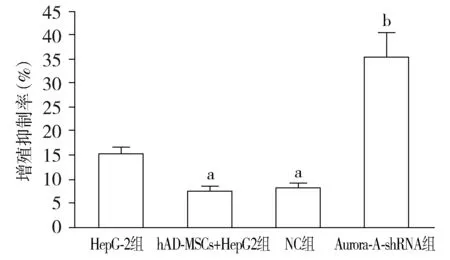
与HepG2组相比,aP<0.05;与hAD-MSCs+HepG2组相比,bP<0.05图3 不同处理后HepG2细胞增殖Figure 3 Proliferation of HepG2 cells after different treatment
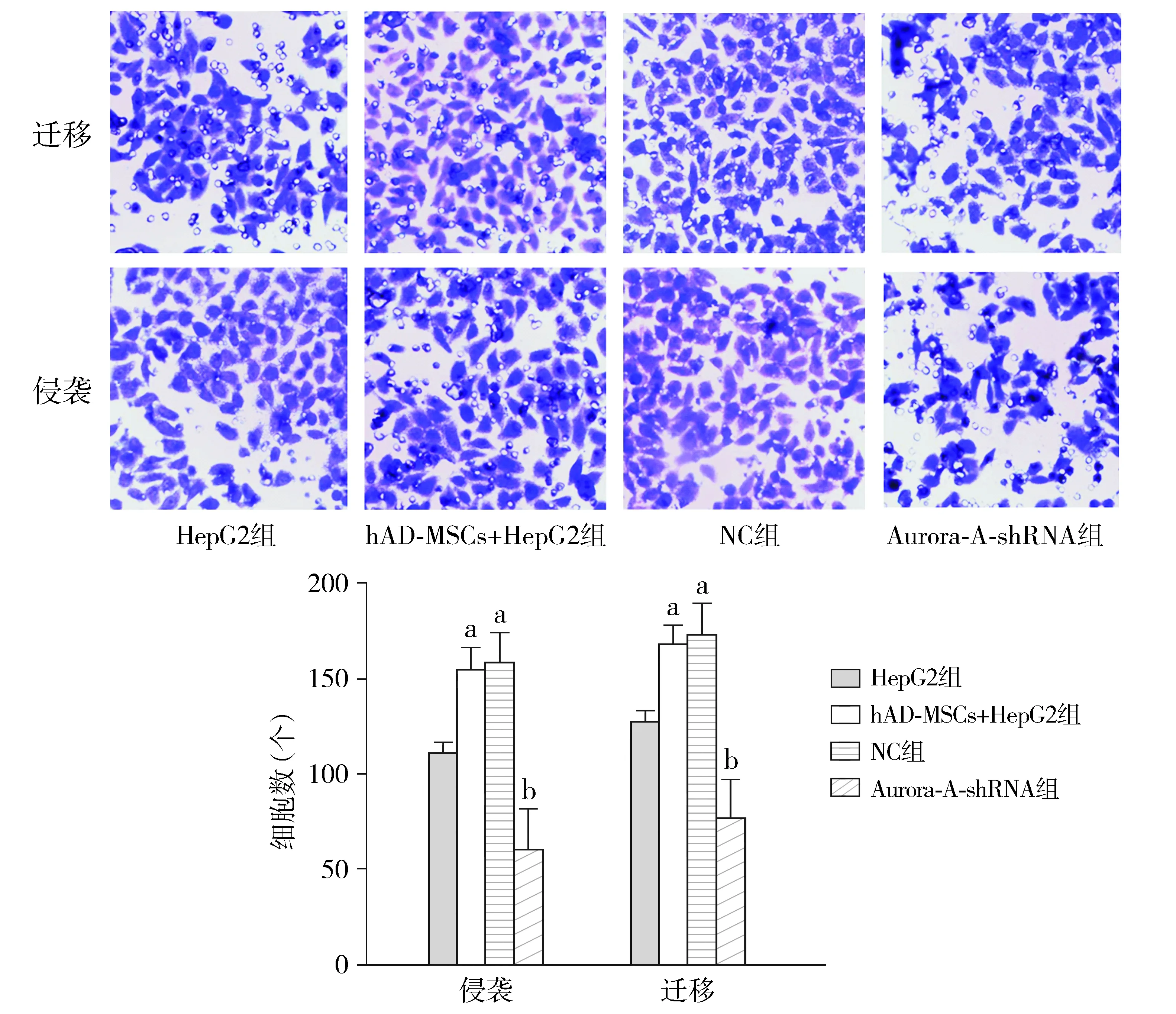
与HepG2组相比,aP<0.05;与hAD-MSCs+HepG2组相比,bP<0.05图4 不同处理后HepG2细胞的侵袭和迁移能力 (结晶紫染色×100)Figure 4 Invasion and migration of HepG2 cells after different treatment (crystal violet staining,×100)
3 讨论
肝癌是全球范围内第三大死亡相关肿瘤疾病,而肝脏微环境是肝癌发生发展的特殊场所[7,8]。TME是指存在肿瘤或肿瘤干细胞的细胞环境,除含有恶性细胞外还含有脂肪细胞和成纤维细胞,而肿瘤可经过淋巴系统或循环系统与其存在的微环境相互作用[9,10]。有研究表明,肿瘤通过募集或调节细胞表型及功能影响TME[10]。MSCs是一种具有多向分化潜能的细胞,能够募集到炎症或肿瘤部位,还可通过分泌细胞因子调节肿瘤的增殖和迁移[11,12]。CAFs作为TME中的基质细胞,不仅可以由MSCs等细胞通过上皮间质转化形成,还可通过IL-6、FGF等分泌因子的作用由正常成纤维细胞转化而来,而肿瘤细胞可通过激活CAFs促进癌症的发展[10,12-14]。目前关于MSCs向CAFs转化的研究越来越多,有研究表明miR-210参与调控MSCs向CAFs的转化,促进乳腺癌的发展,而慢病毒转染后可抑制其转化[15]。有研究发现,在有乳腺癌细胞的条件培养基中,在肿瘤细胞因子的作用下脂肪和骨髓来源的MSCs可转化为CAFs[13]。还有研究发现肝癌HepG2所分泌的Exosome可促进MSCs细胞内CAFs特异性标志物α-SMA、波形蛋白(Vimentin)等表达水平的增加,诱导MSCs向CAFs的转化[16]。
Aurora-A属于Aurora激酶家族成员之一,在细胞有丝分裂和肿瘤的发生发展中起重要作用,有研究表明其在包括肝细胞癌(HCC)在内的多种恶性肿瘤中过表达,而抑制其表达则能有效地逆转肿瘤细胞的恶性表型[17-19]。有研究发现Aurora-A过表达可异常激活NF-κB信号通路从而诱导HCC化学耐药性的产生[17]。Aurora-A可通过增加甲状腺乳头状癌细胞中CFL-1的非磷酸化活性形式,促进癌细胞的迁移和淋巴结转移[20]。还有研究发现,Aurora-A不仅可通过激活AKT/mTOR信号通路来促进子宫内膜癌细胞增殖还能增强细胞对紫杉醇的耐药性[21]。有报道称,慢病毒转染抑制Aurora A表达后胃癌SGC-7901细胞的侵袭迁移能力显著降低[22]。但目前关于Aurora-A的研究多为其在癌症中的作用机制或与其化学耐药性相关,而关于其对肝癌细胞增殖、侵袭和迁移的影响是否可能与其参与调控MSCs向hCAF转化有关还未可知。CAFs可特定表达α-SMA、FAP、Vimentin、FSP等生物标志物,并且在不同细胞中这些生物标志物的表达水平有所不同,研究表明,α-SMA、Desmin、FAP、Tsp-1、FSP作为识别CAFs的特异性标志物在CAFs单独培养后仍旧存在[5,23]。有研究表明在hAD-MSCs向CAFs的转化过程中CAFs细胞内α-SMA、FAPA和Vimentin表达水平显著增加[15]。本研究发现,hAD-MSCs与HepG2细胞共培养后hAD-MSCs细胞中CAF相关蛋白α-SMA、Desmin、FAP、Tsp-1、FSP表达水平显著增加,呈现CAFs表型;而shRNA慢病毒转染后,hAD-MSCs细胞中α-SMA、Desmin、FAP、Tsp-1、FSP表达水平均显著降低,这表明Aurora-A表达下调可抑制hAD-MSCs向CAFs的转化。
此外,研究发现hAD-MSCs细胞影响HepG2细胞恶性化能力,诱导肿瘤细胞高侵袭、迁移能力[24]。本研究发现与HepG2组相比,hAD-MSCs+HepG2组与NC组HepG2细胞增殖抑制率显著降低,而侵袭和迁移能力升高;与hAD-MSCs+HepG2组相比,Aurora-A-shRNA组细胞增殖抑制率显著增加,而侵袭和迁移能力下降。这表明hAD-MSCs细胞可能通过向hCAF转变,改变肿瘤微环境,促进肿瘤细胞的恶性增殖、转移,而Aurora-A可能在其中发挥重要作用,即抑制肝癌细胞中Aurora-A表达可能通过抑制hAD-MSCs向hCAF转化来抑制肝癌细胞的恶性转化。
综上所述,Aurora-A低表达对肝癌细胞增殖、侵袭和迁移的抑制作用与其抑制hAD-MSCs向CAFs转化有关。本研究不仅填补了Aurora-A在hAD-MSCs向CAFs转化过程中作用研究的一大空白,而且对Aurora-A在肝癌功能机制中的进一步研究具有重要参考价值,但在hAD-MSCs向CAFs转化过程中Aurora-A是否参与某些信号通路的调控还需进一步研究。
