STAT6和PAX8在肺内孤立性纤维性肿瘤中的表达及临床意义
2021-08-07陈诗军刘海涛王效静慈红非李其才
陈诗军,刘海涛,王效静,2,慈红非,李其才,李 伟*
(1蚌埠医学院第一附属医院呼吸与危重症医学科,蚌埠 233000;2呼吸系病基础与临床安徽省重点实验室;3蚌埠医学院第一附属医院病理科;4蚌埠医学院第一附属医院胸外科;*通讯作者,E-mail:bbmcliwei@126.com)
孤立性纤维性肿瘤(solitary fibrous tumors,SFTs)是一种罕见的成纤维细胞分化的间质肿瘤,一般认为起源于胸膜,目前无证据表明其发病与吸烟、石绵接触等危险因素有明显关系[1]。SFTs多见于脏、壁层胸膜、腹膜等间质组织[2,3],也偶发于肌肉、软组织等结缔组织[4],但原发于肺内的非常罕见[5]。目前关于肺内SFTs报道较少,并且诊断时容易与肺部其他软组织肿瘤混淆,采用免疫组织化学法进行诊断及鉴别是必要的。目前,临床常规采用CD34、CD99、Bcl-2、Ki-67免疫标记物进行标记,但其特异性和敏感性均不强,因此需要寻找更加理想的标志物来提高诊断及鉴别诊断。近年,有研究报道STAT6和PAX8在不同部位的SFTs中有不同程度的表达,有的甚至阳性表达极高,但对肺内SFTs中STAT6和PAX8标志物表达情况报道少见。因此,本实验通过免疫组化检测STAT6和PAX8在肺内SFTs及肺部其他软组织肿瘤中的表达,比较其与常规检测标志物CD34、CD99、Bcl-2对于该疾病诊断以及鉴别诊断的临床价值,并结合临床病例资料,探讨其表达与临床病理特征的关系,为肺内SFTs的诊断提供更准确的免疫标记物。
1 材料和方法
1.1 一般资料
收集2012年8至2020年12月蚌埠医学院第一附属医院诊治的原发性肺内SFTs的患者临床资料(包括性别、年龄、疾病史、治疗方案、影像学、预后等)和组织标本。入组标准:①病理确诊为孤立性纤维性肿瘤;②肿瘤位于肺内。排除标准:①既往有其他肿瘤病史;②手术后复发病例;③院外未进行放化疗。符合两项标准的患者共19例。其中,男性10例,女性9例,男女比例1.0 ∶0.9,年龄17-77岁,中位年龄61岁。同时另外选取14例肺内常见的软组织肿瘤(神经鞘瘤3例,神经纤维瘤2例,炎症性肌纤维母细胞瘤8例,平滑肌肉瘤1例)作为对照组。本研究获得蚌埠医学院伦理委员会的批准并对患者知情同意书的豁免(批号:2020139)。
1.2 方法
1.2.1 主要试剂 STAT6兔单克隆抗体(稀释比例1 ∶250),PAX-8兔单克隆抗体,CD34鼠单克隆抗体,Bcl-2兔单克隆抗体,CD99鼠单克隆抗体,Ki-67鼠单克隆抗体,STAT6和PAX-8染色需用pH9.0的EDTA修复液,试剂及DAB显色试剂盒均购自福州迈新生物科技有限公司。
1.2.2 免疫组织化学检测 所有病例标本采用ElivisionTMplus法按照说明书进行免疫组织化学染色。10%的中性福尔马林固定标本,常规脱水、石蜡包埋,切片厚3 μm,HE染色,显微镜下观察。STAT6兔单克隆抗体为稀释比例1 ∶250,STAT6和PAX-8染色需用pH9.0的EDTA修复液进行水煮加热抗原修复,按照说明书进行操作。按照实验要求常规设置阴性及阳性对照。
1.2.3 免疫组织化学结果判定 采用独立双盲法,所有切片的免疫组化染色结果由两位经验丰富的的病理医师进行判读。CD34、CD99、Bcl-2表达定位于胞质或胞膜,STAT6和PAX-8定位于胞核,Ki-67定位于胞核。选择染色阳性的细胞区域,镜下至少观察10个具有代表性的高倍镜视野(HPF,放大400倍),然后按照染色阳性细胞的染色强度和阳性细胞所占百分比进行评分。根据染色强度评分:无明显着色,1分;淡黄色,2分;棕黄色,3分;棕褐色,4分。根据阳性细胞所占百分比评分:阴性,0分;阳性细胞<11%,1分;10%<阳性细胞<51%,2分;50%<阳性细胞<76%,3分;阳性细胞>75%,4分。细胞染色强度评分乘以阳性细胞占比评分为最终得分,范围为0-12分。分数>2分被认为是阳性结果。
1.3 统计学方法
采用SPSS23.0软件对数据进行分析,抗体在肺内SFTs组及对照组肿瘤中的表达情况采用Fisher确切概率法进行比较;STAT6和PAX-8的表达与各临床病理参数之间的关系亦采用Fisher确切概率法进行比较。P<0.05为差异有统计学意义。
2 结果
2.1 临床和影像学特征
19例患者中,9例(47.37%)为女性,10例(52.63%)为男性,平均年龄56.95岁,60岁及以上12例(63.16%);14例患者以胸闷、气喘、咳嗽等为主要临床表现,5例无任何临床症状;肿瘤直径≥10 cm以上8例(42.11%)。肺内SFTs最常见于左肺,11例(57.89%),尤其是左下肺。胸部CT平扫示:左下肺可见巨大不规则团块状软组织密度影,密度均匀,边界尚清楚(见图1A);胸部增强CT示:边界尚清楚,内部轻度不均匀强化,可见血管影,呈“地图样”分布,平均CT值约45 Hu(见图1B)。14例行手术治疗,所有肿瘤全部切除,术后1例患者出现包裹性液气胸并发症,术后CT复查无复发或转移,现生存状态良好,5例行保守治疗(其中3例死亡,2例失访)(见表1)。
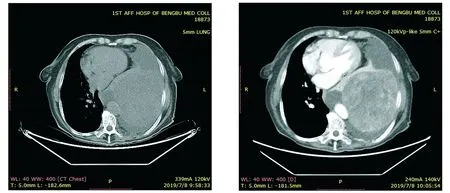
A.CT平扫显示巨大软组织肿块影,密度均匀B.增强CT提示肿瘤内部不均匀强化图1 左下肺孤立性纤维性肿瘤强化前后的CT图像Figure 1 CT features of isolated fibrous tumor of left lower lung before and after enhancement
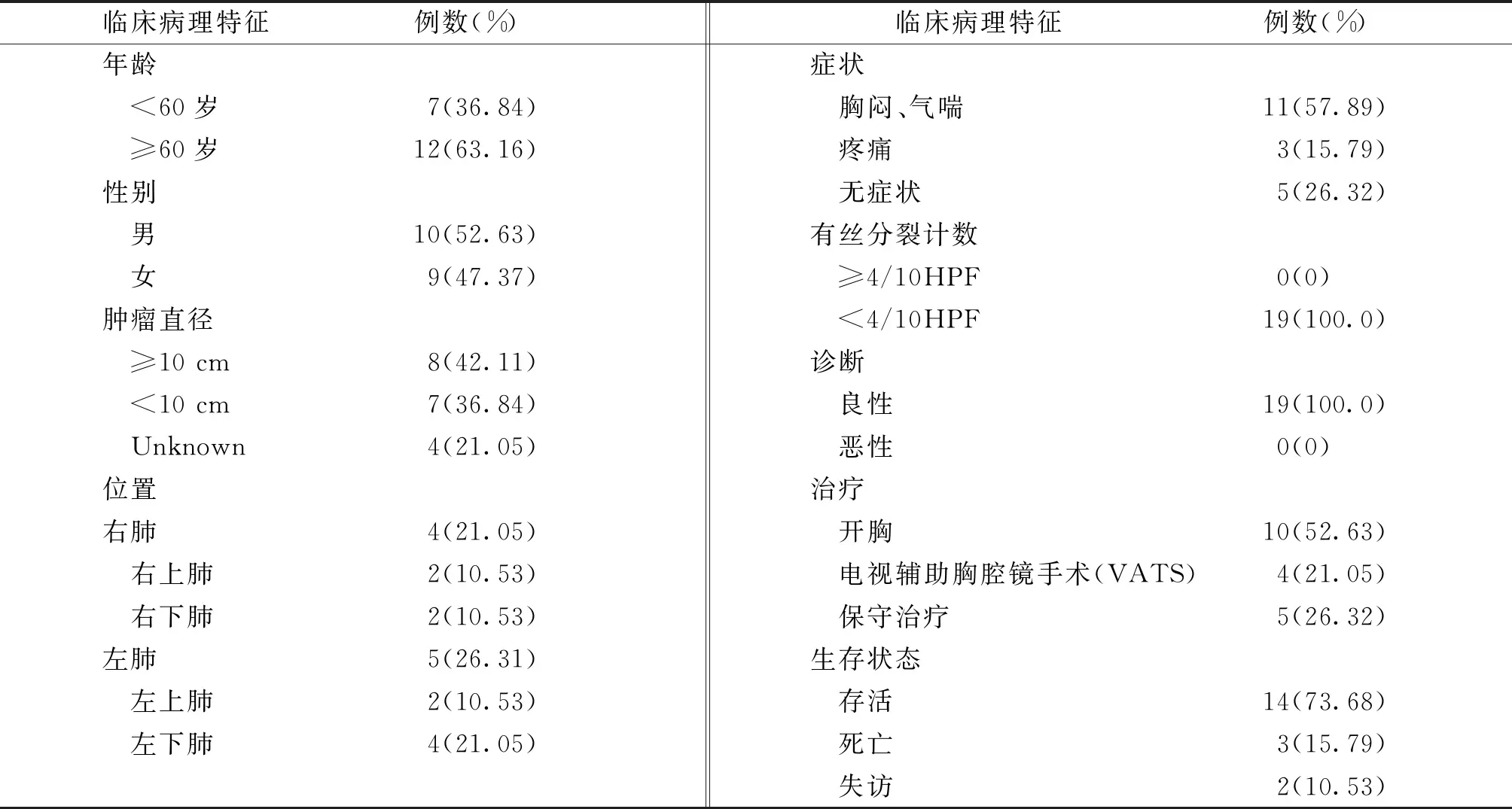
表1 19例原发肺内孤立性纤维性肿瘤患者的临床病理特征、治疗及预后情况
2.2 STAT6和PAX8在肺内SFTs及对照组肿瘤中的表达水平
根据免疫组织化学结果显示,19例肺内SFTs中,STAT6和PAX8的阳性率分别为94.74%(18/19)和31.58%(6/19),而在对照组肿瘤中STAT6仅2例阳性表达(均为炎症性肌纤维母细胞瘤),阳性率为14.29%(2/14),PAX8仅1例阳性表达(炎症性肌纤维母细胞瘤),阳性率为7.14%(1/14);STAT6和PAX8在两组肿瘤中均定位于细胞核(见图2,表2),但仅STAT6在两组中表达具有明显差异,差异有统计学意义(P<0.001)。同时,CD34在两组肿瘤中表达也具有明显差异(P<0.001)。CD34、CD99、Bcl-2、Ki-67表达定位于胞质或胞膜(见图2);5种标志物的敏感度和特异度表达如下:STAT6分别为94.74%和85.71%;PAX-8分别为31.58%和92.86%;CD34分别为78.95%和85.71%;CD99分别为68.42%和35.71%;Bcl-2分别为84.21%和21.43%。其中,STAT6和CD34在两组肿瘤中敏感度和特异度均较高,但PAX-8特异度最高(见表2)。
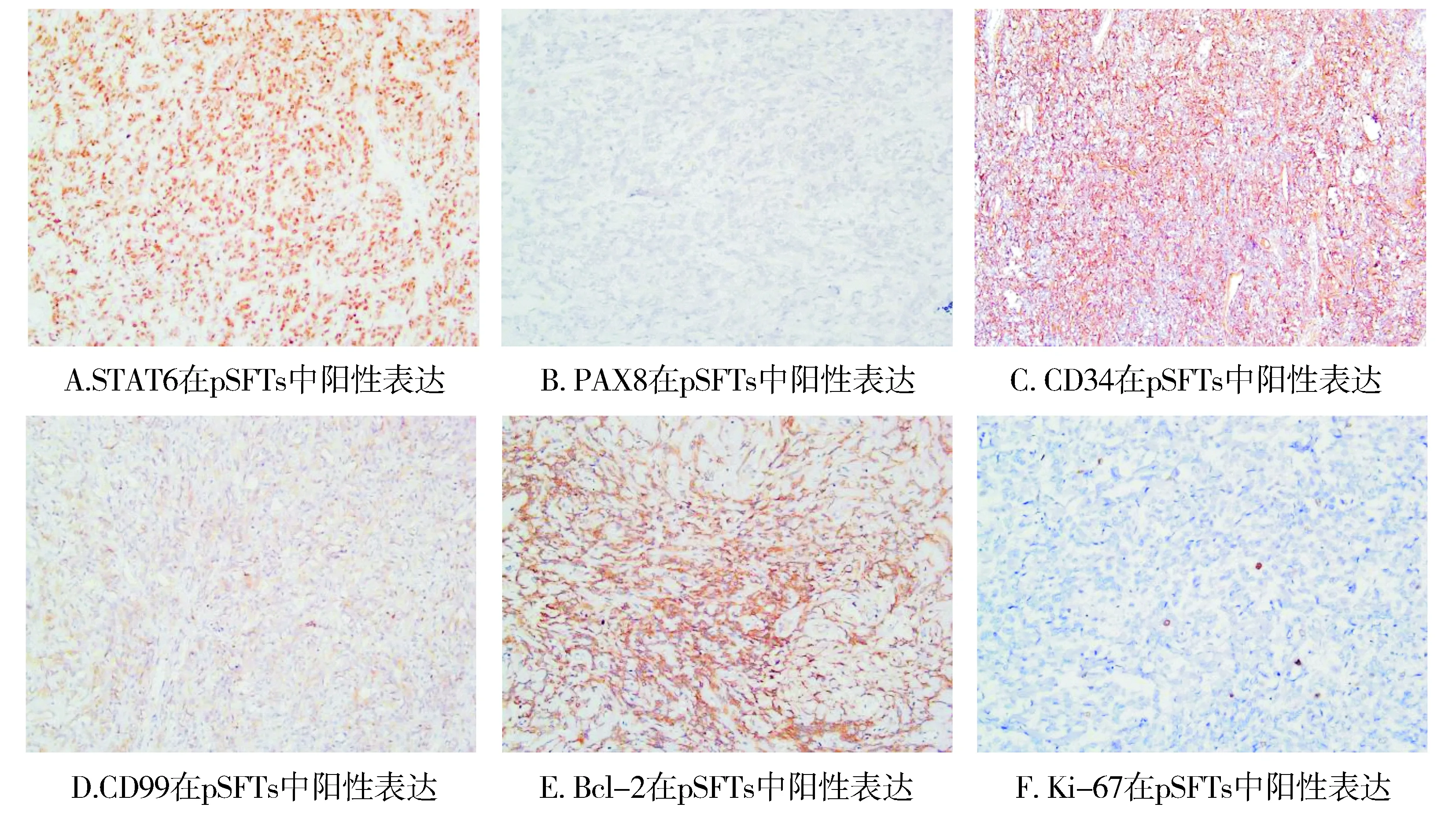
图2 肺内孤立性纤维性肿瘤中免疫组织化学检测 (ElivisionTM plus法,×400)Figure 2 Immunohistochemical staining of primary intrapulmonary solitary fibrous tumors (ElivisionTM plus,×400)

表2 肺内SFTs和对照组肿瘤中抗体的表达情况
2.3 肺内SFTs中STAT6和PAX8表达与临床病理参数的关系
根据免疫组化结果提示,STAT6和PAX8在原发肺内SFTs的表达与患者性别、年龄、肿瘤部位、肿瘤直径大小、细胞增殖指数(Ki-67)、细胞核核分裂象等临床特征之间无明显差异(P>0.05,见表3)。

表3 肺内SFTs中STAT6和PAX8免疫组织化学表达与临床病理参数关系 (例)
3 讨论
1931年Klemperer等[6]首次报道胸膜孤立性纤维性肿瘤,其是一种罕见的表达CD34抗原的树突状纤维母细胞瘤,认为其起源于间皮下。然而,随着免疫组化和超微结构研究,人们逐渐认为SFTs起源于结缔组织中的原始成纤维细胞样细胞,肿瘤细胞为间叶细胞[7]。SFTs最常见于胸膜,SFT极少出现在肺、肾脏、中枢系统等部位,原发于肺内的SFTs占肺间叶性肿瘤的比例不到0.2%。
肺内SFTs患者通常于临床偶然发现,可能与胸痛、咳嗽有关。有研究报道[8],肺内SFTs发病年龄7-81岁,最常见于左肺,临床多无明显症状,可表现为咳嗽、胸闷、胸痛、胸腔渗出等。我们报告的19例患者中,发病年龄为17-77岁,左下肺最常见,以中老年为主,男女比例1.0 ∶0.9,5例患者为临床偶然发现,14例患者表现为胸闷、气喘、咳嗽,其余有腰痛、发热、腹部隐痛等少见临床表现,与既往的相关报道具有相似性[8]。值得注意的是,我们其中1例患者出现难治性反复发生的低血糖,因其无法手术最终导致死亡。目前这种情况考虑由肺内SFTs继发的非胰岛素细胞瘤低血糖症,称之为Doege-Potter syndrome(DPS),低血糖(出汗、震颤、焦虑和意识丧失)是其主要症状,可作为诊断SFTs的初始指标,其机制可能为IGF-Ⅱ与胰岛素亚型A和IGF-1R结合,导致低血糖,同时也促进肿瘤有丝分裂和恶性转化,表明伴有低血糖的SFTs更有恶性倾向,对于鉴别良恶性有重要意义,但本例患者Ki-67及增殖指数均未达到恶性诊断标准,原因有待进一步研究[9]。
肺内SFTs在胸部X线和CT扫描上显示卵圆形或圆形肺结节及肿块影,但它们是非特异性的表现。有学者认为[10],肺内SFTs的肿块CT增强后大多数可以呈现地图样改变,动脉期细胞密集区可见迂曲匍行的血管影,细胞稀疏区强化较弱,坏死区无强化,各种区域同时存在形成“地图样”分布的外观,认为是其特征性表现。而本组收集的19病例中15例强化后也呈现上述“地图样”影像学表现,其间可有散在血管影通过,其他病例表现可有不明显强化、强化不均等,因此这种影像学表现对诊断肺内SFTs具有指导意义。然而,在增强CT上,增强类型有相当大的重叠,100%的恶性和60%的良性胸膜SFT表现出异质性增强,说明单凭CT征象很难区分[11]。
由于肺内SFTs的临床特点和影像学表现不明确、组织学上的多样性,使得与肺内其他软组织肿瘤相互鉴别具有一定难度,因此免疫组织化学标记检查对确诊肺内SFTs的诊断尤为重要。
传统上认为,SFTs中常见标志物阳性表达多见于CD34,存在于高达95%的病例中,然而在其他相似的SFTs,如软组织会阴瘤、隆突皮肤纤维肉瘤和梭形细胞脂肪瘤中也存在表达,并且有5%-10%的明显组织学特征的SFTs中CD34甚至可以不表达[12]。此外,CD99和Bcl-2在SFTs中的阳性率可超过70%[13],甚至有研究显示[14],Bcl-2阳性见于几乎所有的SFTs,但这种标志物是非特异性的,因为在各种其他间充质肿瘤中也观察到其表达。本研究显示,在19例肺内SFTs中,CD34的阳性率为78.95%(15/19)、CD99的阳性率为68.42%(13/19)、Bcl-2的阳性率为84.21%(16/19),并且其特异性:CD34为85.71%、CD99为35.71%、Bcl-2为21.43%,与以往的研究具有一致性。因此,常见的SFTs免疫组化标志CD34、CD99、Bcl-2对于疾病的诊断及鉴别诊断其敏感性和特异性不是十分理想。
STAT6是胞质转录因子STAT家族的一员,通过将信号传递到细胞核并结合特定的DNA启动子序列来调控基因表达,对细胞分化、生长和凋亡的调控等正常细胞过程至关重要。与STAT6相比,NAB2与转录因子EGR家族的相互作用而发挥转录抑制因子的作用,并定位于细胞核[15]。然而,NAB2在与STAT6融合时获得激活结构域,NAB2-STAT6融合基因充当转录激活因子,诱导EGR靶基因的表达,从而导致增殖增加,与正常组织和其他肿瘤相比,融合蛋白可导致细胞核易位和高水平的表达[16]。2013年在SFTs中发现关键的NAB2-STAT6基因融合,染色体12q13.3内存在倒置,导致NAB2(NGFI-A结合蛋白2)和STAT6基因在90%以上的病例中存在基因融合体,从而促进了随后的免疫组织化学检测核STAT6的表达,其作为SFTs的一种新的辅助诊断手段,具有极高的敏感性和特异性[17,18]。一项中枢神经系统间充质肿瘤的研究中,Schweizer等[19]在脑膜SFTs和血管周细胞瘤中发现了NAB2-STAT6融合基因,证实了脑膜“血管周细胞瘤”确实是SFTs的一种超细胞变异,并通过免疫组化的方法检测发现,核STAT6蛋白的表达与NAB2-STAT6基因检测具有高度的一致性[20]。因此,检测STAT6蛋白表达能反映融合基因信息,其对于诊断SFTs及鉴别其他软组织肿瘤具有明显的优势。Demicco等[21]大范围检测间充质肿瘤中STAT6表达情况时发现,STAT6核强阳性表达在2 021例肿瘤中表达285例,其中240例SFT中206例,同时也发现在未分化/分化脂肉瘤(49/408)、未分类肉瘤(8/65)、纤维瘤病(14/184)中核/质阳性表达,STAT6完全缺失最常见于多形性脂肪肉瘤(60%)和肺泡软组织肉瘤(72%)。本研究使用单克隆抗体STAT6,在19例肺内SFTs中,STAT6阳性表达于细胞核,其阳性率为94.74%(13/14);STAT6标志物的敏感度和特异度表达分别为94.74%和85.71%。STAT6在对照组肺部平滑肌肉瘤、神经鞘瘤、神经纤维瘤均不表达,然而在肺部炎症性肌纤维母细胞瘤中有阳性表达(3/8),提示确诊肺内SFTs时需要与此鉴别。最新的WHO肿瘤分类指南对SFTs进行一些调整[22],SFTs的ICD-O编码由既往为0改为1,即良性肿瘤定义为潜在恶性,恶性的SFTs的ICD-O编码为3。Diebold等[23]对SFTs的多变量分析中指出,增殖指数(Ki-67)≥10%、核分裂象≥4/10HPF、肿瘤>10 cm与不良结局独立相关,并且多见于恶性。本研究结果提示,患者性别、年龄、肿瘤部位及直径大小、细胞增殖指数(Ki-67)、细胞核核分裂象等临床参数与肺内SFTs中STAT6的表达情况无关,因此肺内SFTs细胞增殖指数、核分裂象、肿瘤直径等对于肿瘤良恶性的区分仍具有一定的局限性,并非绝对关系。那么对于STAT6表达情况与患者预后之间的关系仍需要进一步研究。
PAX8是由9个基因组成的家族成员之一,基因编码参与调节转录配对盒DNA结合结构域,对胚胎发生过程中器官形成以及维持某些器官功能至关重要,尤其是肾脏、甲状腺[24]。事实上,PAX8常见于肾脏、甲状腺滤泡和上皮性妇科肿瘤中,此外,甲状旁腺、胸腺和某些神经内分泌肿瘤,特别是胰腺、阑尾和直肠起源的肿瘤,可以表达PAX8,而在肺、乳腺等肿瘤中几乎不表达,因此PAX8对于鉴别肺部肿瘤具有重要的意义[24,25]。Ullman等[26]研究显示,在30例SFTs中PAX8和STAT6阳性率分别为43%(13/30)和93%(28/30),其中PAX8中有8例弥漫性阳性表达,5例局部阳性表达,并且胸膜外SFTs比胸膜SFTs更容易表达PAX8(77%vs18%,P=0.001);对照组肉瘤样肾细胞癌或梭形细胞肿瘤中PAX8阳性率可达50%-87%,而STAT6均为阴性表达。与此同时,有学者研究了41例SFTs中PAX8阳性率(26.8%,11/41)与临床病理参数的关系,结果提示其阳性率与患者性别、年龄、肿瘤直径、分布位置、恶性与否及转移复发均无明显关系[27]。本研究结果显示,在19例肺内SFTs中,PAX8阳性率为31.58%(6/19),细胞信号位于细胞核,而14例对照组肿瘤中仅1例出现PAX8阳性信号表达,显示出现92.86%(13/14)特异性,特异性明显高于其余4种标志物。并且,肺内SFTs中PAX8的表达与患者性别、年龄、肿瘤大小、肿瘤部位、肿瘤细胞增殖指数(Ki-67)、肿瘤细胞核核分裂象等临床特征之间无明显相关性。由此可见,PAX8对于鉴别肺内SFTs具有重要作用,但同时也可能对SFTs的诊断过程中容易造成误判,诊断前最好排除转移性肉瘤样癌或者梭形细胞样的其他肿瘤。
综上所述,鉴别诊断肺内SFTs需要临床表现、影像学、免疫组织化学等联合判断,而免疫标志物检测至关重要。其中,STAT6和PAX8联合检测在肺内SFTs的诊断及鉴别诊断具有重要作用,相较传统标志物具有更高的敏感性和特异性。
