卷丹的显微及组织化学观察
2021-12-08刘孟奇王小巧徐璐郭涛陈随清
刘孟奇 王小巧 徐璐 郭涛 陈随清


摘要:采用冰冻切片法、徒手切片法,利用亮视野显微镜、荧光显微镜、偏振光和扫描电子显微镜,对卷丹进行显微结构研究;利用荧光和组织化学染色的手段对卷丹进行组织化学研究。结果表明:(1)卷丹鳞叶内表皮和外表皮都由1层紧密排列的长方形细胞构成,外表皮细胞较长,大小为(230±60) μm×(50±10) μm,垂周壁略微弯曲,内表皮细胞大小为(120±30) μm×(70±10) μm,垂周壁微弯曲或浅波状;内表皮和外表皮都分布有少量气孔,无副卫细胞。(2)卷丹鳞叶有12~16个维管束,导管为螺纹导管。(3)薄壁细胞所含淀粉粒较多,都为单粒,卵圆形和长椭圆形,脐点偏心,层纹清晰可见。(4)荧光显微及组织化学染色表明,生物碱、多酚类和脂类物质主要分布在内表皮和外表皮细胞中,而多糖和皂苷类物质在内表皮、外表皮以及叶肉细胞中都有分布。卷丹不同部位的表皮、淀粉粒特征较为一致,维管束数目一定,大小差别较大。组织化学研究结果为百合的加工、评价、鉴定及进一步研究提供了基础。
关键词:百合;卷丹;显微;组织化学;鳞叶
中图分类号:S567.901 文献标志码: A
文章编号:1002-1302(2021)22-0153-05
收稿日期:2021-04-27
基金项目:第62批中国博士后项目基金(一等)(编号:2017M623342)。
作者简介:刘孟奇(1971—),男,河南洛阳人,博士,副教授,主要从事中药资源与鉴定研究。 E-mail:2009liumq@163.com。
通信作者:郭 涛,博士,教授,主要从事中药资源与中药新药开发研究。E-mail:gt010010@163.com。
2020版《中国药典》百合项下收载卷丹(Lilium lancifolium Thunb.)、百合(Lilium brownii F. E. Brown var. viridulum Baker)和細叶百合(Lilium tenuifolium DC.)。中药百合有养阴润肺、清心安神之功效[1]。中药百合的主流品种为卷丹和百合,细叶百合仅见于野生。目前,对于中药百合及其主要混淆品种的显微研究仍停留在普通光学显微镜下对淀粉粒、导管和表皮细胞的简单描述[2-6]。对于不同生长年限的及其鳞叶不同部位的表皮、淀粉粒和维管束的显微特征,缺少利用荧光显微镜和扫描电镜进行深入的研究。现行药典仅有中药百合的性状鉴定和薄层鉴定,而无显微鉴定特征的描述,缺少指标成分和量化指标[1]。研究表明中药百合含有皂苷类、酚类、生物碱类、多糖类、磷脂类等活性成分[7-9]。当前有关中药活性化学成分的研究大多集中于皂苷类和多糖等方面[10],而对其他成分的了解非常有限,而且百合的组织化学定位研究还没有展开。因此,本研究以卷丹为对象,拟选取一年生栽培卷丹为研究材料进行显微和组织化学研究,旨在为中药百合在鉴定、质量控制和加工等方面的深入研究提供理论依据。
1 材料与方法
1.1 试验材料
卷丹,一年生植物,于2020年9月采集于湖南省邵阳市隆回县北山乡北山村(110°5′24.86″E、27°4′46.25″ N,海拔304 m),经河南中医药大学郭涛教授鉴定为卷丹的鳞叶。新鲜材料一部分直接用于制片,一部分用标准固定液(FAA固定液)固定保存。
FAA固定液自制:(甲醛、70%乙醇、乙酸体积比为5 ∶90 ∶5)、改良碘化铋钾(Dragendorffs试剂)、固蓝B、0.02%的钌红、耐尔蓝、香草醛-冰乙酸-高氯酸。
OlympusBX53正置荧光显微镜,由日本奥林巴斯株式会社生产;Quorum K850临界点干燥仪、Quorum SC7620离子溅射镀膜仪、Zeiss EVO10钨灯丝扫描电镜,均由德国卡尔蔡司公司提供。
1.2 试验方法
1.2.1 性状鉴别
对采集的新鲜百合鳞茎的外观进行观察和描述,用刻度尺测量其直径,对不同位置不同大小的鳞叶的长、宽和厚度进行测量,精确到1 mm。用放大镜在光线明亮处观察干燥的鳞叶,对边缘及内、外表面和断面的特征进行观察。
1.2.2 光学显微镜观察
采用撕表皮的方法,在不同位置(外、中、内层)鳞叶的不同部位(上、中、下)分别撕取外表皮和内表皮,一部分样品用水合氯醛处理后,用OlympusBX53正置荧光显微镜,在亮视野下观察并照相;一部分在紫外光(UV)下观察并照相。采用徒手切片法将不同位置鳞叶横切或纵切,一部分样品用水合氯醛透化处理后,用OlympusBX53正置荧光显微镜,在亮视野下观察内表皮、外表皮和维管束的显微特征并照相;另一部分在紫外光下观察并照相。选取不同位置鳞叶,切成小块,采用挤压法挤出淀粉粒,用OlympusBX53正置荧光显微镜,分别在亮视野和偏振光下观察并照相。
1.2.3 扫描电镜观察
取不同位置的新鲜卷丹鳞叶,切成小块后在FAA固定液中固定10 h,乙醇梯度脱水(分别为 50%、70%、85%、90%乙醇各脱水1次,无水乙醇2次,15 min/次),而后用乙酸异戊酯置换乙醇2次(20 min/次),在Quorum K850临界点干燥仪中干燥,在Quorum SC7620离子溅射镀膜仪中喷金,用Zeiss EVO10钨灯丝扫描电镜观察拍照内表皮、外表皮和横切面。
1.2.4 组织化学观察
取不同位置的新鲜鳞叶,采用徒手切片法将鳞叶横切,用OlympusBX53正置荧光显微镜分别在亮视野和紫外光下观察并照相。
用徒手切片法对不同位置的新鲜鳞叶横切制片,或撕取外表皮和内表皮,用组织化学试剂染色:(1)检测生物碱用改良碘化铋钾(Dragendorffs试剂);(2)检测酚类用固蓝B;(3)检测多糖用0.02%的钌红[11];(4)检测脂类用耐尔蓝[12];(5)检测皂苷类用香草醛-冰乙酸-高氯酸。染色后用OlympusBX53正置荧显微镜观察并照相。
2 结果与分析
2.1 性状特征
鳞茎扁球形,直径4~7 cm,鳞叶白色,呈阔卵形,长2~4 cm,宽1.5~2.5 cm,厚度为1.0~2.5 mm,表面较光滑,表面淡黄白色,有5~8条较为清晰的白色维管束平行排列。顶端稍尖,边缘平整;质地较脆,易折断,断面较平坦;味微苦。
2.2 鳞叶的显微特征
2.2.1 外表皮、内表皮及叶肉细胞
卷丹不同位置鳞叶的不同位置的外表皮和内表皮特征都由1层排列紧密的长方形细胞构成。外表皮细胞长方形大小为(230±60) μm×(50±10) μm,垂周壁较为平直或略微弯曲(图1-A),用荧光显微镜在紫外光下观察到横向的垂周壁荧光微弱,而纵向的垂周壁荧光较为强烈,呈平行排列式样(图1-B)。外表皮上稀疏分布有气孔,气孔器为近圆形,大小为(48±2) μm×(50±2) μm,气孔长轴方向与外表皮细胞排列方向一致(圖1-A)。扫描电镜观察外表皮的外表面较为平滑,垂周壁略微突出,气孔与表皮细胞在同一水平(图1-C)。内表皮细胞也为长方形,大小为(120±30) μm×(70±10) μm,明显比上表皮细胞短宽,垂周壁微弯或呈浅波状,内表皮上气孔少于外表皮,气孔的大小、方向和形状与外表皮相似(图1-D),外表皮和内表皮气孔的长轴方向与鳞叶的长轴方向一致,气孔周围都有4个表皮细胞(图1-A、图1-D)。内表皮细胞也为纵行排列,荧光显微下观察到垂周壁荧光比上表皮的强烈(图1-E)。扫描电镜下观察到的内表皮有些褶皱(图1-F)。
卷丹鳞叶横切制片后观察到外表皮只有1层细胞,无淀粉粒,无色透明,而叶肉细胞中充满淀粉粒(图2-A)。水合氯醛处理后可以清晰看到外表皮细胞的宽度和厚度显著小于相邻的叶肉细胞。外表皮细胞外切向壁较厚,有明显的角质层,外表皮细胞与相邻的一层叶肉细胞结合紧密(图2-B)。内表皮细胞也只有1层细胞,细胞的宽度和厚度也显著小于相邻的叶肉细胞,横切观察到叶肉细胞为等径形(图2-C)。从鳞叶的纵切面观察,叶肉细胞为长方形,呈现整齐的纵行排列,因而容易丝状剥离出来(图2-D)。
2.2.2 维管束、淀粉粒
横切制片后观察,维管束的导管直径较小,为外韧维管束(图2-E),荧光显微镜下对鳞叶横切面进行观察,可以看到维管束有2层,总数在12~16条之间变化,维管束的直径大小不等,相差较大(图2-F),大的肉眼可见,小的在显微镜下才能观察到。纵切观察维管束中的导管类型为螺纹导管(图2-G)。叶肉细胞中淀粉粒都为单粒,大多呈长卵形,脐点可见多为点状,少数为短缝状,层纹可见而不显著(图2-H),偏振光下观察脐点位于狭窄一端的靠近边缘处,偏光十字较为暗淡(图2-I)。淀粉粒的大小多数在(20±5) μm× (40±5) μm,最长可达70μm,其大小变化范围较大。
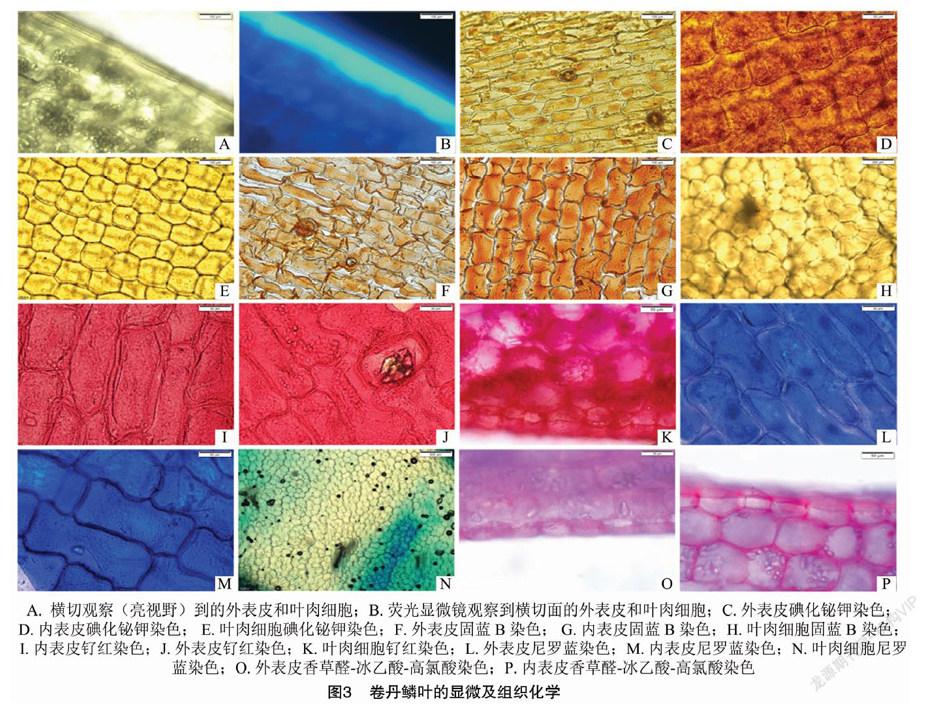
2.3 组织化学
对鳞叶横切制片观察发现, 内表皮和外表皮都只有1层细胞,无色透明,外切向壁较厚,外表皮的外切向壁比内表皮的厚些,且明显可以看到外面的1层角质层(图3-A),在荧光显微镜下有明显的青色的自发荧光(图3-B),而叶肉细胞则无此特征。外表皮和内表皮都很容易剥离,用改良后的碘化铋钾试剂染色后,表皮细胞和气孔的保卫细胞中都产生橘红色沉淀,内表皮中产生的橘红色沉淀多于外表皮(图3-C、图3-D),叶肉细胞中未发现橘红色沉淀(图3-E),表明内表皮的生物碱含量多于外表皮,叶肉组织中不含生物碱。用固蓝B染色,内、外表皮细胞甚至气孔的保卫细胞中都产生橘红色沉淀,表明酚类物质存在,并且内表皮中产生的橘红色沉淀多于外表皮(图3-F、图3-G),在叶肉细胞中未发现橘红色沉淀(图3-H)。用钌红染色发现,内表皮和外表皮都显示红色(图3-I、图3-J),表明内表皮和外表皮细胞内都存在多糖,在叶肉细胞中也存在有淀粉粒以外的多糖(图3-K);用尼罗蓝染色发现,外表皮和内表皮细胞都显示蓝色(图3-L、图3-M),表明内、外表皮细胞中存在脂类物质,在叶肉细胞中未产生蓝色物质(图3-N)。用香草醛-冰乙酸-高氯酸染色发现,外表皮和内表皮细胞都显示红色(图3-O、图3-P),表明其中存在皂苷类物质,在叶肉细胞中也存在皂苷类物质。组织化学观测结果具体见表1。
3 讨论与结论
2020版《中国药典》[1]仅有关于中药百合性状的描述,刘畅宇等对中药百合各个品种及主要混淆品种的性状进行了描述,其中提到卷丹“鳞叶长 2.0~3.5 cm,宽1~3 cm,厚1~3 mm”[3],本研究卷丹鳞叶的大小与刘畅宇等的描述[3]基本一致。本研究发现卷丹鳞叶的表面淡黄白色,与刘畅宇等的描述“表面乳白色或淡黄棕色”[3]略有不同。刘畅宇等描述“维管束数量在3~8条”[3],本研究对卷丹不同位置的鳞叶进行观察,用放大镜能够清晰看到的维管束数量在5~8条之间。用荧光显微镜对百合断面观察可以看到的维管束数量在 12~16条之间,这是由于部分维管束直径小,而且被包埋在叶肉细胞中,使用放大镜难以观察到。2020版《中国药典》[1]对中药百合描述只提到“有数条纵直平行的白色维管束”,建议对中药百合各品种维管束数量进行统计时,选用荧光显微镜进行观察更为精准。所有维管束的类型都为外韧维管束,导管类型为螺纹导管,刘畅宇等所述的网纹导管[3]在本研究中并未发现。鳞叶的外表皮和内表皮都由1层排列紧密的长方形细胞构成,外表皮和内表皮细胞的长度分别在(230±60) μm和(120±30) μm范围内,有显著的区别,这一显著区别需要在中药百合及易混淆品种的研究中深入展开。宽度上分别在(50±2) μm 和(70±10) μm范围内,区别并不显著。在外表皮和内表皮上都稀疏分布有近圆形的气孔器,大小相近,周围一般有4个表皮细胞。鳞叶的叶肉细胞在横切面上观察为近圆形,纵切面上观察为长方形,排列成行。
显微镜下观察结果表明,卷丹不同位置鳞叶的不同部位,外表皮和内表皮显微大小显著不同,各自都有一定的尺寸范围,维管束的类型都为外韧型,数量都在12~16条之间,且导管类型为螺纹导管,都为单粒淀粉粒、脐点靠近狭窄一端,层纹可见而不清晰,偏振光观察较为暗淡,这些特征都是比较稳定的显微特征,可以作为显微鉴定的科学依据。另一方面,卷丹鳞叶薄壁细胞中均匀分布有大量的淀粉粒,维管束纤细且无机械组织,其显微特征决定了其饮片具有一些性状特点:质硬而脆,断面平坦,角质样。
卷丹鳞叶的内、外表皮在亮视野下观察为无色透明,在紫外光下发出青色的自发荧光,鳞叶的叶肉细胞则无此特征。组织化学染色表明,生物碱、酚类和脂类物质都分布在外表皮和内表皮中,而多糖和皂苷类在外表皮、内表皮和叶肉细胞中都有分布。卷丹中的活性成分包括多糖、皂苷类、脂类、生物碱和酚类等物质,其中活性成分含量最高的是多糖和皂苷类物质[13-15],这与本研究所证明的多糖和皂苷类物质在叶肉细胞和表皮细胞中广泛分布的结论一致。
在卷丹鳞叶的内表皮和外表皮中分布有酚类和生物碱物质,在新鲜的卷丹鳞叶中这些物质以溶解状态存在于细胞液中,亮视野下为无色透明,而在紫外光下会产生青色的自发荧光。酚类是天然化合物中的一大类物质,多具抗氧化能力[16-17],同时也是构成植物化学防御系统的重要组成部分[18]。新鲜的卷丹鳞叶常为白色,在加工和存放过程中由于酚类物质氧化变色,因此表面为黄白色至淡棕黄色,有的微带紫色[1]。生物碱在防御微生物感染和抵御食草动物摄食方面有重要的作用[19-20];卷丹味微苦,其苦味来源主要与内表皮和外表皮中分布有少量的生物碱有关。
参考文献:
[1]国家药典委员会. 中华人民共和国药典(一部) [M]. 2020版. 北京:中国医药科技出版社,2020.
[2]刘秀菊,李 炀. 兰州百合与药用百合生药鉴定比较 [J]. 西部中医药,2016,29(7):34-37.
[3]刘畅宇,周日宝,陈 勋,等. 百合药材质量标准研究进展 [J]. 中医药导报,2018,24(16):117-120,123.
[4]孙法丽,徐凌川,左 曦. 10种商品百合的来源和性状鉴别 [J]. 山东中医杂志,1999(8):371-372.
[5]娄海林,马剑波,马吉余. 百合及其混淆品种的鉴别 [J]. 北方药学,2010,7(2):55.
[6]刘振启,刘 杰. 百合的性状鉴别与炮制工艺 [J]. 首都医药,2011(19):44.
[7]李玉帆,明 军,王良桂,等. 百合基本营养成分和活性物质研究进展 [J]. 中国蔬菜,2012(24):7-13.
[8]高淑怡,李卫民,帅 颖,等. 药用植物百合甾体皂苷研究进展 [J]. 中国实验方剂学杂志,2012,18(16):337-343.
[9]张黄琴,严 辉,钱大玮,等. 不同产地百合药材中8种活性成分的分析与评价 [J].中国中药杂志,2017,42(2):311-318.
[10]李 艳,苗明三. 百合的化学、药理与临床应用分析 [J]. 中医学报,2015,30(7):1021-1023.
[11]Johansen D A. Plant microtechnique[M]. 1st ed. New York:McGraw-Hill Book Company UK Ltd,1940:200-201.
[12]Cain A J. The use of Nile Blue in the examination of lipoids[J]. The Quarterly Journal of Microscopical Science,1947,88:383-392.
[13]聶 慧. 百合药材质量影响因素探讨 [D]. 镇江:江苏大学,2014.
[14]孙 俊,张科卫,秦昆明,等. 不同产地百合多糖的含量测定[J]. 南京中医药大学学报(自然科学版),2010,26(1):65-66.
[15]高淑怡,李卫民,高 英. HPLC法测定百合、卷丹、细叶百合中3种甾体皂苷的含量 [J]. 中药新药与临床药理,2012,23(6):675-678.
[16]童晓翠. 卷丹化学成分及其化感作用的研究 [D]. 杨凌:西北农林科技大学,2008.
[17]靳 磊,张延龙,牛立新,等. 3种百合鳞茎中多酚类物质的抗氧化活性分析[J]. 西北植物学报,2014,34(5):995-1001.
[18]Wuyts N,De Waele D,Swennen R. Extraction and partial characterization of polyphenol oxidase from banana (Musa acuminata grande naine) roots [J]. Plant Physiology and Biochemistry,2006,44(5/6):308-314.
[19]Harborne J B. Introduction to ecological biochemistry [M]. 3rd ed. New York:Academic Press,1988:281.
[20]Rosenthal G A,Berenbaum M R. Herbivores:their interaction with secondary plant metabolites,Vol.Ⅰ: The chemical participants [M]. 2nd ed. San Diego:Academic Press,1991:79-121.
