基于iPBS标记的石斛兰种质资源遗传多样性分析及DNA指纹图谱构建
2021-08-06崔学强唐璇黄昌艳邓杰玲李秀玲卢家仕张自斌
崔学强 唐璇 黄昌艳 邓杰玲 李秀玲 卢家仕 张自斌

摘 要:以48份石斛兰种质资源为对象,采用iPBS分子标记技术对其遗传多样性进行分析并构建DNA指纹图谱。结果表明:从83条iPBS引物中筛选出7条扩增条带清晰、多态性高、重复性好的引物;利用筛选出的引物对48份石斛兰基因组DNA进行PCR扩增,共获得279条谱带,其中多态性条带279条,多态性比例为100%;采用GenAlEx 6.5软件计算48份石斛兰的平均观测等位基因数(Na)为2.000,平均有效等位基因数(Ne)为1.202,平均Neis遗传多样性指数(He)为0.153,平均Shannon信息多样性指数(I)为0.274,48份石斛兰表现出丰富的遗传多样性;采用NTSYS-pc 2.1软件计算得到48份石斛兰间的遗传相似系数为0.6667~0.9211,基于遗传相似系数进行UPGMA聚类,在相似系数0.75处,可将48份石斛兰划分为7个类群。利用2对引物构建的DNA指纹图谱可单独鉴别出48份石斛兰种质资源,该图谱可为石斛兰分类与鉴定提供科学依据。
关键词:石斛兰;iPBS分子标记;遗传多样性;DNA指纹图谱
Abstract: The genetic diversity of 48 Dendrobium germplasm resources was analyzed and DNA fingerprint was constructed by the iPBS molecular marker technique. The results showed that seven primers with clear amplification bands, high polymorphism and good repeatability were selected from 83 iPBS primers. The selected primers were used to amplify the genomic DNA of 48 Dendrobium germplasm resources by PCR, and a total of 279 bands were generated, of which 279 were polymorphic bands, and the polymorphic ratio was 100%. By GenAlEx 6.5 software, average value of observed allele number, effective number of alleles, Nei's gene diversity and Shannon's information index was 2.000, 1.202, 0.153 and 0.274, respectively, indicating that a high level of genetic diversity among the 48 Dendrobium germplasm resources. The genetic similarity coefficient among the 48 Dendrobium germplasm resources ranged from 0.6667 to 0.9211 by NTSYS-pc 2.1 software. UPGMA clustering based on genetic similarity coefficient revealed the 48 Dendrobium germplasm resources could be divided into seven groups when genetic similarity was 0.75. The DNA fingerprint map constructed with two pairs of primers could separately identify the 48 Dendrobium germplasm resources, which could provide a scientific basis for the classification and identification of Dendrobium.
Keywords: Dendrobium; iPBS molecular marker; genetic diversity; DNA fingerprinting
石斛蘭(Dendrobium)是兰科(Orchidaceae)石斛属植物的总称,全球约2000个原生种,中国原产80余种[1]。石斛兰因其花色鲜艳,花姿优美,花期长,具芳香气味,而与卡特兰(Cattleya)、蝴蝶兰(Phalaenopsis)、文心兰(Oncidium)并列为观赏价值最高的“四大观赏洋兰”[2]。部分石斛兰还是我国传统的名贵中药材,其中铁皮石斛(Dendrobium officinale)、金钗石斛(Dendrobium nobile)、鼓槌石斛(Dendrobium chrysotoxum)、流苏石斛(Dendrobium fimbriatum)等均被收录在《中国药典》中[3-4]。目前,石斛兰已被广泛栽培于世界各地,经过育种家开展的新品种的选育工作,已有不少经典石斛兰品种流行于市场。中国开展石斛兰新品种选育较晚,目前市场上流行的品种大部分都是从国外引进的品种。如何挖掘利用这些经典品种并结合我国石斛兰资源自身优势,培育具有自主知识产权的石斛兰新品种已成为产业发展的关键。然而要挖掘和利用石斛兰种质资源,就必须对种质资源进行精准鉴定,并对其遗传多样性及亲缘关系有深入了解,才能更有目的地选择亲本,加快新品种选育进程。
分子标记技术可在DNA水平上检测生物的遗传多样性。该技术不依赖基因表达和环境条件,并且操作简单,快速且易于自动化。在分子标记辅助育种、群体遗传研究、种质资源鉴定、遗传关系分析和遗传图谱构建中起着重要作用[5]。Inter-primer binding site(iPBS)分子标记技术是Kalendar等[6]提出的以长末端重复序列(long terminal repeats, LTRs)类反转录转座子保守位点设计引物进行扩增的一种新型分子标记技术,该技术简单、有效且无需预先获知相关的LTR序列,与传统的分子标记技术相比,iPBS分子标记技术在品种鉴定、遗传多样性分析等更有优势[7]。目前,该分子标记技术已应用于牡丹[5]、葡萄[8-9]、枸杞[10]、杨梅[11]、番石榴[12]、杏子[13]、豌豆[14]、胡萝卜[15]、亚麻[16]等植物的品种鉴定、遗传多样性分析及DNA指纹图谱构建,而对石斛兰的相关研究尚未见报道。因此,本研究以收集保存的48份石斛兰种质资源为对象,采用iPBS分子标记技术,研究种质资源间的遗传多样性及亲缘关系,并构建DNA指纹图谱,以期为石斛兰品种鉴定、遗传图谱构建及分子育种等提供科学理论依据。
1 材料与方法
1.1 材料
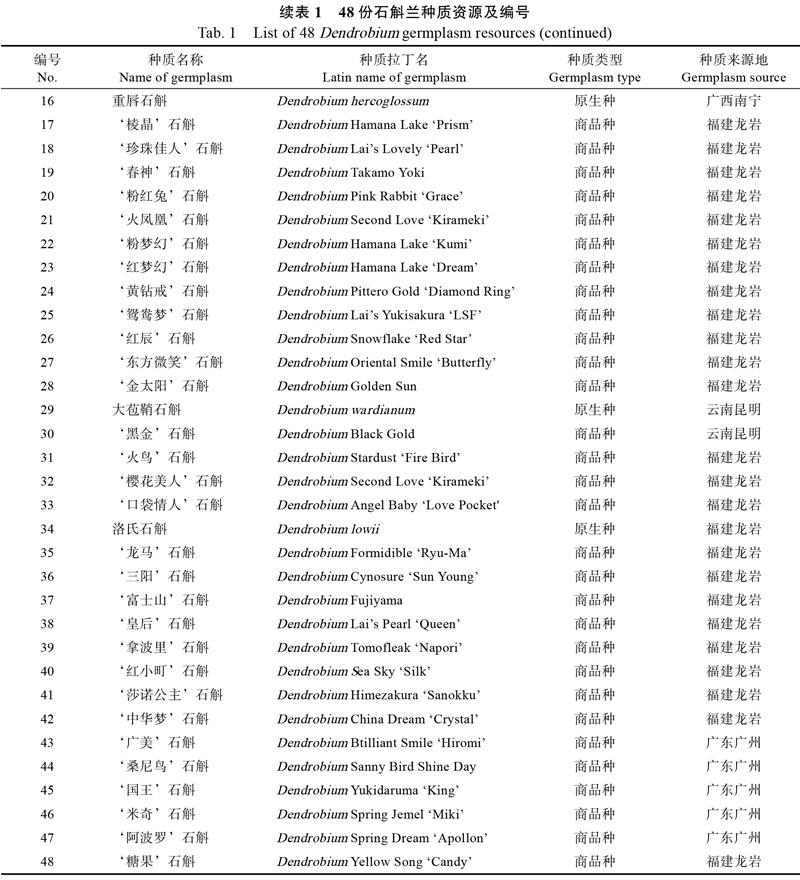
本研究以48份石斛兰种质资源为材料,供试样本均种植于广西农业科学院花卉研究所兰科植物种质资源圃。选取幼嫩的健康叶片用封闭的塑料袋包装,保存于冰盒中,及时带回实验室,液氮速冻,保存于?80 ℃冰箱中,用于基因组DNA的提取,样品采集编号见表1。
1.2 方法
1.2.1 基因组DNA提取 石斛兰基因组DNA采用EasyPure Genomic DNA Kit(北京全式金生物技术有限公司)试剂盒提取,用1.0%琼脂糖凝胶电泳检测DNA的完整性,并用紫外分光光度计检测其浓度和纯度,将提取的DNA用TE缓冲液稀释浓度至20 ng/μL,于?20 ℃冰箱保存备用。
1.2.2 引物筛选及iPBS-PCR扩增 试验采用的引物序列选用Kalendar等[6]发表的83个iPBS引物序列,引物由生工生物工程(上海)股份有限公司合成。从合成的引物中筛选出扩增条带清晰、多态性高、稳定性强的引物对供试样品进行PCR扩增。PCR反应总体系为20 μL,其中2×EasyTaq? PCR SuperMix 10 μL、模板DNA 1 μL、引物1 μL、无菌水8 μL。PCR扩增程序为:94 ℃预变性4 min;94 ℃变性1 min,50 ℃(不同引物退火温度见表2)退火45 s,72 ℃ 1 min,35个循环;72 ℃延伸7 min,扩增产物放置于4 ℃冰箱中保存。取10 μL PCR扩增产物用1.0%琼脂糖凝胶进行电泳检测。
1.3 数据处理
根据扩增产物的电泳图谱,同一迁移位置上有条带的记“1”,无条带的记为“0”。将扩增引物记录的条带构建“0,1”矩阵。采用NTSYS-pc 2.1统计软件进行数据分析,采用UPGMA方法聚类,建立树状图。利用GenAlEx 6.5软件计算等位基因数(Na)、有效等位基因数(Ne)、Neis遗传多样性指数(He)、Shannon信息多样性指数(I)。根据聚类结果,筛选出可鉴别供试材料的引物,根据引物组合的“0,1”矩阵,手动构建DNA指纹图谱。
2 结果与分析
2.1 引物扩增多态性分析
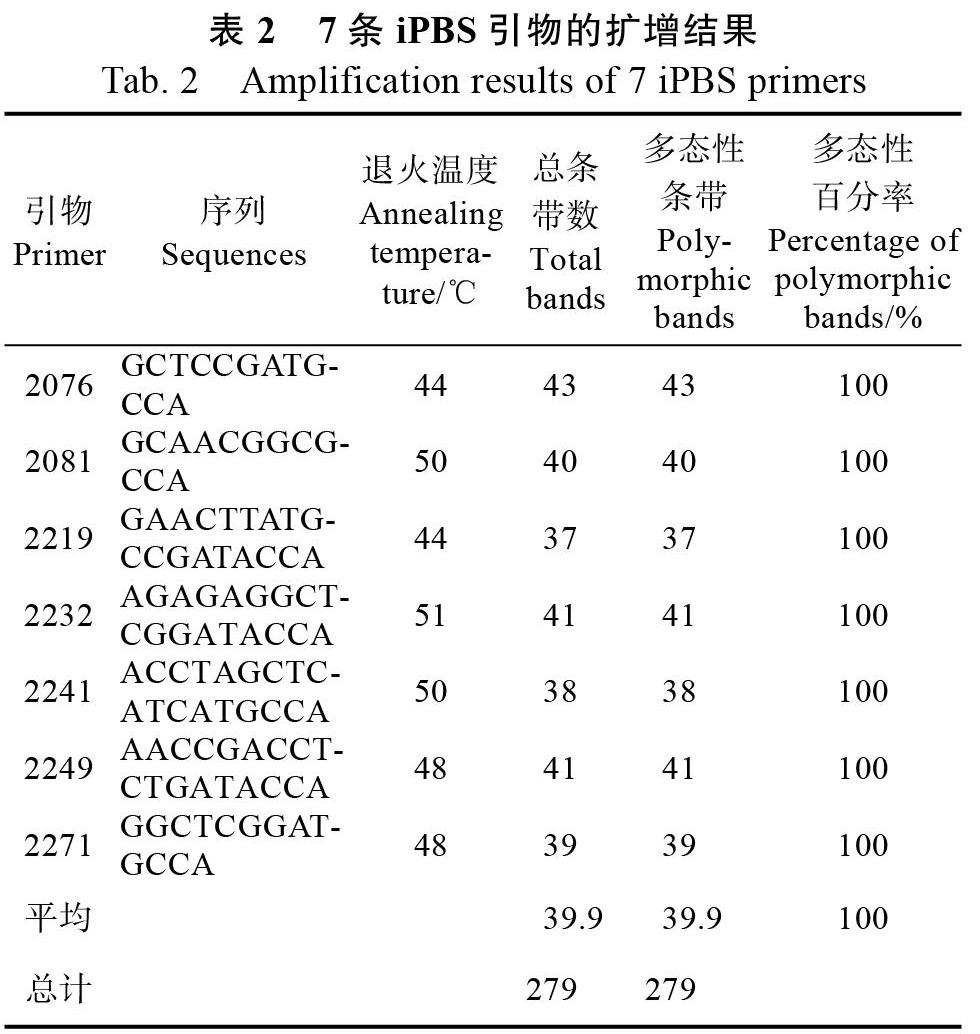
从83条iPBS引物中筛选出扩增条带清晰、多态性高、重复性好的引物7条,对48份石斛兰基因组DNA进行PCR扩增,结果见表2,扩增总条带为279条,其中多态性条带为79条,多态性比率为100%,每条引物扩增产生的条带数在37~43条之间。其中扩增位点数最多的引物为
2076,扩增位点43个,最少的引物为2219,扩增位点37个,平均每条引物多态性条带数为39.9,说明用iPBS分子标记方法检测石斛兰种质资源遗传多样性效率很高。引物2076对48份石斛兰基因组DNA的扩增结果如图1所示。
2.2 48份石斛兰种质资源遗传多样性及亲缘关系分析
利用7条iPBS引物产生的标记信息,经NTSYS-pc 2.1软件计算48份石斛兰种质资源遗传相似系数变化范围为0.6667~0.9211。其中‘莎诺公主石斛(Dendrobium Himezakura ‘Sanokku)和‘中华梦石斛(Dendrobium China Dream ‘Crystal)遗传相似系数最大为0.9211,说明二者亲缘关系最近,遗传差异相对较小。‘黄钻戒石斛(Dendrobium Pittero Gold ‘Diamond Ring)和铁皮石斛(Dendrobium catenatum)遗传相似系数最小为0.6667,说明二者亲缘关系最远,遗传差异相对较大。采用GenAlEx软件计算48份石斛兰种质资源遗传多样性指数(表3),平均观察等位基因数(Na)为2.000,平均有效等位基因数(Ne)为1.202,平均Neis基因多样性指数(He)为0.153,平均Shannon多样性信息指数(I)为0.274,表明48份石斛兰种质资源间存在丰富的遗传多样性。
2.3 48份石斛兰种质资源聚类分析
为了确定48份石斛兰种质资源间的遗传关系,采用NTSYS-pc 2.1分析软件对遗传矩阵按UPGMA进行聚类分析,构建树状聚类图(图2)。在遗传相似系数为0.75时,可将48份石斛兰种质资源划分为7个类群。第Ⅰ类群包括麝香石斛、檀香石斛和铁皮石斛3份种质,该类群均是石斛兰原生种,该类群又可分为2个分支,其中麝香石斛、檀香石斛為1个分支,铁皮石斛单独聚为1个分支。第Ⅱ类群包括束花石斛、金钗石斛、美花石斛、大晶帽石斛、紫苑石斛、扭瓣石斛、球花石斛、钩状石斛、梳唇石斛等13份种质,该类群除‘龙马石斛为商品种外,其余均为原生种。第Ⅲ类群包括‘皇后石斛、‘拿波里石斛、‘红小町石斛、‘中华梦石斛、‘国王石斛、‘米奇石斛、‘糖果石斛等11份种质,该类群全部为石斛商品种。第Ⅳ类群包括‘重唇石斛、‘棱晶石斛、‘粉梦幻石斛、‘红梦幻石斛、‘春神石斛、‘口袋情人石斛、‘三阳石斛等18份种质,该类群除‘重唇石斛为原生种外,其余均为商品种。第Ⅴ类仅有大苞鞘石斛1份种质,且为石斛原生种。第Ⅵ类群仅有喇叭唇石斛1份种质,且为石斛原生种。第Ⅶ类群仅有‘富士山石斛1份种质,且为石斛商品种。
2.4 48份石斛兰种质资源DNA指纹图谱构建
利用筛选出的7条iPBS引物对48份石斛兰种质资源构建DNA指纹图谱,通过对比发现引物2076和2271均可单独鉴别出48份石斛兰。本研究利用引物2076构建了48份石斛兰种质资源的DNA指纹图谱(图3),其中黑色表示该位点有条带,即该位点在“0,1”矩阵中为“1”,无色表示该位点无条带,即该位点为“0”。构建的指纹图谱可用于48份石斛兰的分类与鉴定。
3 討论
3.1 iPBS分子标记的多态性分析
iPBS是一类基于反转录转座子基础的新型分子标记技术,之前iPBS分子标记在石斛兰品种鉴定、遗传多样性分析等方面的研究鲜有报道。本研究从83条iPBS引物中筛选出7条扩增条带清晰、多态性高、重复性好的引物,对48份石斛兰种质进行扩增,共检测到279条谱带,且均为多态性条带,多态性比例为100%。其引物多态性与利用ISSR分子标记开展石斛兰遗传多样性及亲缘关系等研究的引物多态性一致[17-19],略高于利用RAPD[20-21]、AFLP[22]、SRAP[23 ]等分子标记的引物多态性。研究结果充分表明iPBS标记是一种简单高效、扩增多态性较好的分子标记,该分子标记用于石斛兰种质资源品种鉴定、遗传多样性及亲缘关系等研究是可行的。
3.2 遗传多样性及亲缘关系分析
遗传多样性是生物多样性的核心内容,是生命进化和物种分化的基础,为研究物种的遗传基础、品种鉴定、亲本优选等提供理论依据。本研究的48份供试材料中,18份为石斛兰原生种,30份为石斛兰商品种,从引物多态性比例、遗传相似系数变化范围及遗传多样性指数等方面进行研究,结果表明48份石斛兰种质间遗传多样性较丰富,种质遗传基础较宽。分析其主要原因是原生种和商品种遗传背景差异较大,尤其大部分商品种资源都是经过多代杂交选育获得,其血缘关系非常复杂。从聚类结果也可看出,石斛兰原生种和商品种各自单独聚为一个分支。本研究构建的聚类图在遗传相似系数为0.75处,可将48份石斛兰种质资源划分为7个类群。第Ⅰ类群中麝香石斛、檀香石斛聚为1个分支,该聚类结果与林榕燕等[23]的聚类结果一致,表明麝香石斛、檀香石斛二者亲缘关系较近。早期已有研究者利用麝香石斛和檀香石斛进行杂交,获得杂交后代Dendrobium Nestor,并于1892年在皇家园艺协会进行登录[1]。第Ⅱ类群13份种质除‘龙马石斛为商品种外,其余均为原生种,‘龙马石斛与原生种洛氏石斛聚在一起,表明二者亲缘关系较近,‘龙马石斛可能有洛氏石斛的血统。第Ⅲ类群11份种质全为商品种且单独聚在一起,表明11份商品种间亲缘关系近,杂交更易亲和。但第Ⅲ类群与第Ⅰ类群和第Ⅱ类群的石斛兰原生种遗传距离相对较近,也说明第Ⅲ类群的商品种在与原生种石斛进行杂交时,可能存在一定的亲和性。第Ⅳ类群18份种质,主要都是商品种,但其与第Ⅲ类群单独分开,说明这18份商品种间亲缘关系近,杂交更易亲和。第Ⅳ类群的商品种与原生种石斛兰遗传距离相对较远,说明第Ⅳ类群的商品种在与原生种石斛进行杂交时,较第Ⅲ类群商品种亲和性差。任羽等[24]基于分子分类的石斛兰杂交结实性探讨的研究中,发现石斛兰商品种间杂交组合结实率>原生种之间杂交组合结实率>商品种与原生种间杂交组合结实率。本研究石斛兰原生种和商品种的聚类结果,与任羽等[24]的研究结论较为一致。通过本研究对石斛兰商品种和原生种的遗传多样性和亲缘关系分析,有助于充分利用石斛资源和提高育种效率,但由于石斛遗传背景比较复杂,单一标记只能检测到石斛基因组的部分位点,仅凭一种分子标记分析其遗传多样性和亲缘关系可能不够准确,因此,今后应结合多种标记对其进行深入研究。
3.3 DNA指纹图谱构建
DNA指纹图谱是指DNA样品用特定分子标记技术处理显示出具有特定DNA片段的总称[25]。DNA分子标记具有不受环境因子和时空条件影响且高效、快捷等优点,可直接反映品种间的遗传差异,已成为品种鉴定的有效方法之一。前期利用分子标记技术构建石斛兰DNA指纹图谱有少量报道,其中刘士辉等[26]利用SSR分子标记技术构建的特征指纹图谱,可将供试的10份石斛材料区分开。李怀志等[27]利用SRAP分子标记技术构建的特征指纹图谱可将供试的20份铁皮石斛种质完全区分开。本研究中采用的iPBS分子标记技术已在葡萄指纹图谱构建中成功应用[9],但应用在石斛兰DNA指纹图谱构建确是较少;筛选出的7条引物中有2条引物扩增的“0,1”矩阵构建的DNA指纹图谱,可区分48份石斛兰种质资源,这说明iPBS分子标记应用于石斛兰DNA指纹图谱构建是可行的,但如供试样本改变,则可能需要重新筛选适合的引物,构建指纹图谱对供试材料进行鉴定和区分。
参考文献
王 雁, 周进昌, 郑宝强, 等. 石斛兰[M]. 北京: 中国林业出版社, 2014.
郑宝强, 朱胜蕾, 李 奎, 等. 中国原生种石斛兰的育种价值分析[J]. 北京林业大学学报, 2018, 40(4): 102-108.
林榕燕, 叶秀仙, 钟淮钦, 等. 基于SRAP分子标记的石斛兰种质资源遗传多样性分析[J]. 福建农业学报, 2018, 33(5): 469-473.
李振坚, 王元成, 韩 彬, 等. 石斛属植物生物碱成分研究进展[J]. 中草药, 2019, 50(13): 3246-3254.
Duan Y B, Guo D L, Guo L L, et al. Genetic diversity analysis of tree peony germplasm using iPBS markers[J]. Genetics and Molecular Research, 2015, 14(3): 7556-7566.
Kalendar R, Antonius K, Smykal P, et al. iPBS: a universal method for DNA fingerprinting and retrotransposon isolation[J]. Theoretical and Applied Genetics, 2010, 121(8): 1419-1430.
Kalendar R, Flavell A J, Ellis T H N, et al. Analysis of plant diversity with retrotransposon-based molecular markers[J]. Heredity, 2011, 106(8): 520-530.
Guo D L, Guo M X, Hou X G, et al. Molecular diversity analysis of grape varieties based on iPBS markers[J]. Biochemical Systematics and Ecology, 2014, 52: 27-32.
张安世, 庞金城, 刘 莹, 等. 基于iPBS标记的玫瑰香系葡萄遗传多样性分析与指纹图谱构建[J]. 浙江农业学报, 2019, 31(10): 1624-1631.
尹 跃, 安 巍, 赵建华, 等. 枸杞种质资源遗传多样性的iPBS分析[J]. 福建农林大学学报(自然科学版), 2017, 46(6): 612-617.
Chen F Y, Liu J H. Germplasm genetic diversity of Myrica rubra in Zhejiang Province studied using inter-primer binding site and start codon-targeted polymorphism markers[J]. Scientia Horticulturae, 2014, 170: 169-175.
Mehmood A, Jaskani M J, Ahmad S, et al. Evaluation of genetic diversity in open pollinated guava by iPBS primers[J]. Pakistan Journal of Agricultural Sciences, 2013, 50(4): 591-597.
Baránek M, Meszáros M, Sochorová J, et al. Utility of retrotransposon-derived marker systems for differentiation of presumed clones of the apricot cultivar Velkopa vlovicka[J]. Scientia Horticulturae, 2012, 143: 1-6.
Baloch S F, Alsaleh A, De Miera L E S, et al. DNA based iPBS-retrotransposon markers for investigating the population structure of pea (Pisum sativum) germplasm from Turkey[J]. Biochemical Systematics and Ecology, 2015, 61: 244-252.
?etin B. Plant regeneration from hypocotyls of black carrot via direct somatic embryogenesis and determination of its genetic stability by RAPD and iPBS methods[J]. Indian Journal of Genetics and Plant Breeding, 2018, 78(3): 373-377.
Smykal P, Bacova-Kerteszova N, Kalendar R, et al. Genetic diversity of cultivated flax (Linum usitatissimum L.) germplasm assessed by retrotransposon-based markers[J]. Theoretical and Applied Genetics, 2011, 122(7): 1385-1397.
宋 爽, 周洋帆, 劉正杰, 等. 利用ISSR和AFLP标记分析石斛种质资源的遗传多样性[J]. 云南农业大学学报(自然科学版), 2016, 31(4): 688-695.
李永清, 江金兰, 叶 炜, 等. 37份药用石斛种质资源亲缘关系的ISSR分析[J]. 福建农业学报, 2015, 30(02): 131-135.
卢家仕, 卜朝阳, 吕维莉, 等. 不同产地石斛属种质资源的ISSR遗传多样性分析[J]. 中草药, 2013, 44(01): 96-100.
朱胜男, 周振华, 冯尚国, 等. 31种石斛属植物的RAPD遗传多样性分析[J]. 杭州师范大学学报(自然科学版), 2011, 10(4): 333-339.
金 波, 蒋福升, 施 宏, 等. 石斛属野生种质资源的遗传多样性RAPD分析[J]. 中华中医药学刊, 2009, 27(8): 1700-1702.
郑勇平, 郑 泉, 俞继英, 等. 春石斛杂交育种及亲缘关系的AFLP分析[J]. 浙江林学院学报, 2009, 26(1): 137-141.
林榕燕, 叶秀仙, 钟淮钦, 等. 基于SRAP分子标记的石斛兰种质资源遗传多样性分析[J]. 福建农业学报, 2018, 33(5): 469-473.
任 羽, 王呈丹, 陆顺教, 等. 基于分子分类的石斛兰杂交结实性探讨[J]. 核农学报, 2015, 29(10): 1909-1916.
Vos P, Hogers R, Bleeker M, et al. AFLP: a new technique for DNA fingerprinting[J]. Nucleic Acids Research, 1995, 23(21): 4407-4414.
刘士辉, 李怀志, 沈若刚, 等. 石斛种质资源遗传多样性的SSR分析及指纹图谱构建[J]. 浙江农业科学, 2017, 58(7): 1183-1185, 1189.
李怀志, 刘士辉, 沈若刚, 等. 铁皮石斛种质资源遗传多样性的SRAP分析及指纹图谱构建[J]. 安徽农业科学, 2017, 45(14): 126-128.
责任编辑:黄东杰
