雌激素上调TFF3促进甲状腺乳头状癌细胞增殖的研究
2021-08-05张文静张辰露余鸿杰王佳轩王冬梅
张文静,张辰露,余鸿杰,李 雪,王佳轩,张 静,王冬梅,林 旭
(河北北方学院形态学实验室 张家口市重点实验室,河北 张家口 075000)
甲状腺癌是常见的内分泌系统肿瘤,在中国,甲状腺癌发病率以每年20%的速度增长[1],甲状腺乳头状癌(papillary thyroid carcinoma,PTC)是甲状腺癌的主要病理类型,占甲状腺癌的80%~85%。PTC发病具有明显性别差异,在所有地理区域和种族中都观察到PTC在女性中的流行趋势,提示雌激素可能在PTC发生发展中发挥了作用。本课题组前期研究发现三叶因子3(trefoil factor family 3,TFF3)在PTC组织中高表达,并与淋巴结转移和临床分期相关,TFF3促进了PTC的恶性发展[2]。有研究表明TFF3是雌激素反应基因[3],雌激素通过与其受体(estrogen receptor α,ERα)的结合促进TFF3的转录和翻译,进一步发挥TFF3在PTC中的作用。本研究旨在进一步研究雌激素与TFF3在PTC中的作用。
1 材料与方法
1.1 材料
PTC组织芯片(OD-CT-EdThy03)购自上海芯超生物科技有限公司;人甲状腺乳头状癌K1细胞购自北纳创联生物公司;RPMI-1640、DMEM培养基及胎牛血清(Gibco);pmiR-luc-TFF3-3′UTR(北京合生基因);胰蛋白酶、青链霉素混合液、MTT试剂盒、不含酚红的RPMI 1640培养基(北京索莱宝科技有限公司);碳吸附型胎牛血清(Bioind);17β-雌二醇(E2)、二甲基亚砜(DMSO)、ICI182780(Sigma);双荧光素酶报告基因检测试剂盒(原平皓生物);Trizol、cDNA合成试剂盒(天根生化科技有限公司),qPCR试剂盒(Thermo Fisher Scientific);蛋白提取试剂盒、蛋白定量试剂盒(北京普利莱基因技术有限公司);ECL化学发光检测试剂盒、小鼠抗人β-actin抗体、羊抗小鼠IgG、羊抗兔IgG(康为世纪生物科技有限公司);兔抗人TFF3(Abcam);通用型SV超敏两步法免疫组化检测试剂盒、DAB辣根过氧化酶显色试剂盒(博士德生物工程有限公司)。
1.2 免疫组织化学方法
组织芯片脱蜡至水,枸橼酸缓冲液(pH6.0)微波热修复15 min,3%甲醇-H2O2避光封闭10 min,滴加适当比例稀释的一抗,4 ℃湿盒过夜。次日,PBS冲洗后,滴加适量多聚体抗兔/小鼠IgG-HRP,37 ℃培养箱孵育15 min,PBS冲洗后滴加DAB显色液,显微镜下控制显色时间,自来水终止显色;苏木精复染细胞核,梯度酒精脱水,二甲苯透明,中性树胶封片。显微镜下进行观察和拍摄图片。结果判定:根据阳性细胞范围和染色强度进行综合判断:①阳性细胞范围计分:阳性细胞数<5%,0分;5%~25%,1分;26%~50%,2分;>50%,3分。②染色强度计分:无着色,0分;淡黄色,1分;棕黄色,2分;黄褐色,3分。③两项计分相加,总积分≥3分为阳性。
1.3 细胞培养
K1细胞培养于含10%胎牛血清、1%青链霉素的1640培养基中,置于37 ℃、5%CO2细胞培养箱培养,每隔2 d更换细胞培养液,E2刺激前更换为无酚红1640、含10%碳吸附胎牛血清的培养基。取对数生长期细胞进行后续相关实验。
1.4 实时荧光定量PCR
胰酶消化并收集细胞,Trizol法提取细胞总RNA,NanoDrop2000分光光度计(Thermo Fisher,美国)测定RNA浓度,1μg总RNA反转录为cDNA,而后按照试剂说明书进行实时荧光PCR反应(Applied Biosystems QuantStudio3实时荧光定量PCR,Thermo Fisher)(表1)。实验结果采用2-ΔΔCT法计算mRNA相对表达量。

表1 引物序列
1.5 Western blot检测目的蛋白表达水平
胰酶消化后收集细胞进行裂解和蛋白抽提,获得蛋白膜,加入200~500 μL 2% SDS溶液,金属浴95 ℃溶解,BCA法测定蛋白浓度。配制12%SDS-PAGE凝胶,每孔10 μL上样混合液含30 μg蛋白进行垂直电泳,将蛋白转至0.22 μm PVDF膜上。奶粉封闭后加入一抗,4 ℃孵育过夜,PBS洗膜后加入二抗,室温下摇床孵育1 h,PVDF膜上滴加ECL发光显色液,应用化学发光凝胶成像系统(OmegaLum W,Aplegen,美国)观察和拍照。使用Image J分析蛋白条带灰度值,以目的蛋白与β-actin灰度值的比值表示该蛋白相对表达水平。
1.6 MTT法检测细胞增殖活力
细胞接种于96孔培养板,每孔5×103个细胞,每个实验组设6个复孔,置于5%CO2、37 ℃培养箱中。24 h后加入E2(0、1、10、100 nM),分别处理细胞24 h后加入90 μL新鲜培养液和10 μL MTT溶液,培养4 h后去除培养基,每孔再加入110 μL DMSO,摇床上低速振荡10 min,酶标仪(Multiskan FC,Thermo Fisher)490 nm处测量各孔吸光度(A)值,细胞增殖相对活力=实验组A/对照组A,对照组为0 nM E2(只加入DMSO)。
1.7 双荧光素酶报告基因实验
消化细胞并铺入24孔板中,不同浓度E2刺激24 h后,按照Lipofectamine 3000说明书将TFF3荧光素酶载体、海肾荧光素酶报告基因(50∶1)转染K1细胞24 h后,按照双荧光素酶报告基因检测试剂盒说明进行双荧光素酶报告基因检测(Modulus单管型多功能检测仪,原平皓生物)。荧光素酶活性=萤火虫荧光强度/海肾荧光强度。
1.8 统计学方法
2 结 果
2.1 PTC组织芯片中ERα阳性表达率
31例PTC组织芯片标本中女性22例,男性9例;平均年龄(51.6±8.4)岁;组织芯片共62个点,每例PTC及癌旁组织各1点。ERα免疫组化阳性产物多表达于呈乳头状结构的癌细胞胞浆中(图1),可见淡黄至棕褐色阳性颗粒,分布较密集。在癌旁组织中ERα阳性产物多位于滤泡上皮细胞胞质,间质中可见少量阳性细胞。ERα在PTC组织中多呈中等到强阳性表达,在癌旁组织多呈弱阳性表达,在PTC组织中阳性表达率高于癌旁组织(P<0.05)(表2)。ERα阳性表达率与性别、临床分期、淋巴结转移、TFF3阳性表达相关(P<0.05),与年龄、肿瘤大小不具有相关性(P>0.05)(表3)。
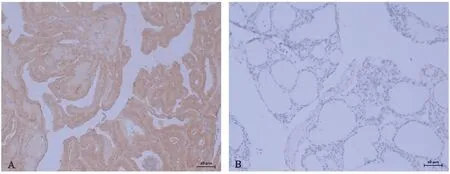
A:ERα在PTC中呈强阳性表达;B:ERα在癌旁组织中呈弱阳性表达。

表2 ERα在PTC组织与癌旁组织中阳性率比较 n(%)
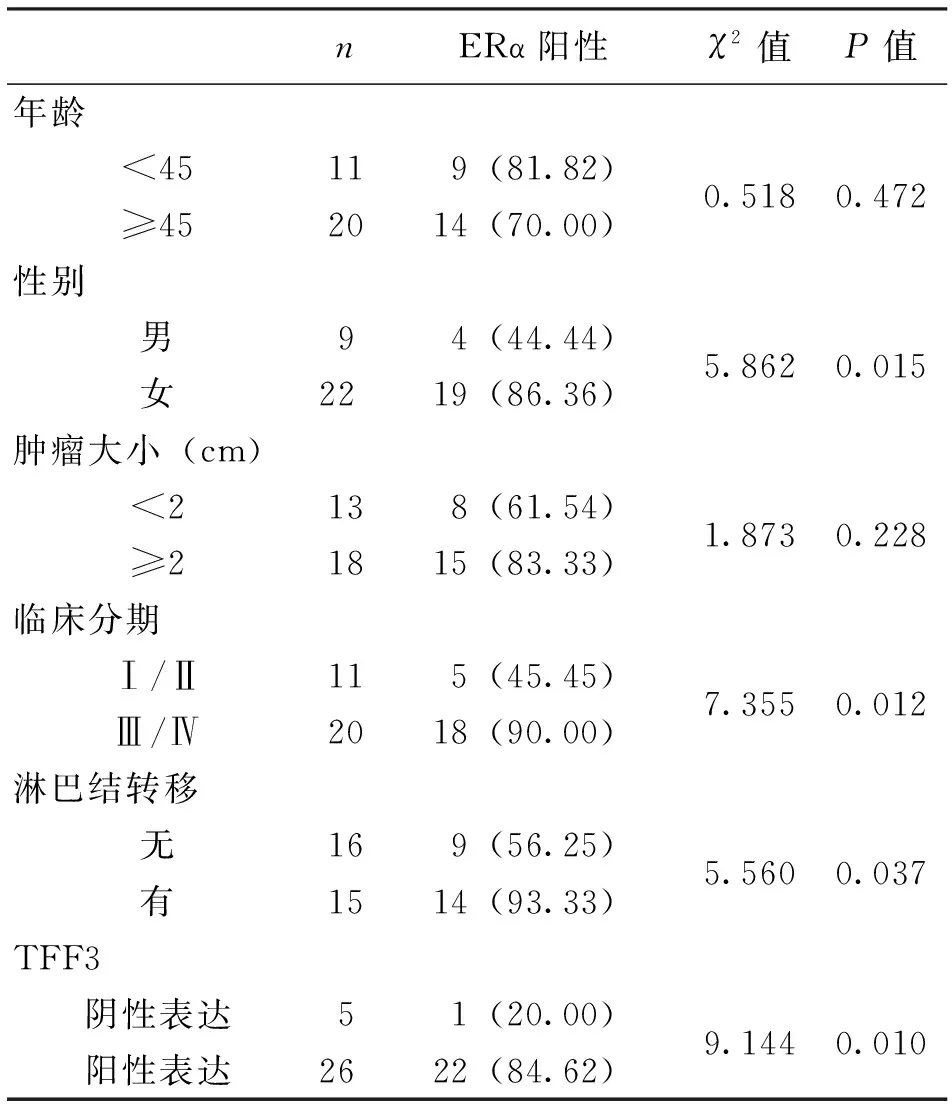
表3 ERα与PTC临床病理参数及TFF3的相关性 n(%)
2.2 E2对K1细胞增殖活力的影响
0、1、10、100 nM E2刺激K1细胞24 h后,MTT实验结果显示,随着E2浓度升高,K1细胞表现为剂量依赖性增殖活力的增加,与对照组相比(0 nM E2)差异均有统计学意义(P<0.01)(图2,表4)。
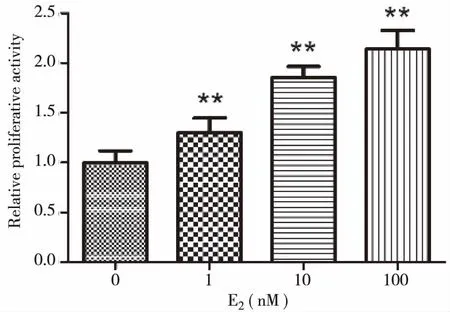
注:与对照组相比**P<0.01。
表4 MTT法检测不同浓度E2对K1细胞增殖活力的影响
2.3 ICI182780对E2刺激K1细胞增殖的影响
10 nM E2刺激可显著促进K1细胞增殖(P<0.01);单独ICI182780处理细胞后K1增殖活力与对照组相比差异无统计学意义(P>0.05),ICI182780刺激后再加入E2可轻微增加K1细胞的增殖活性(P<0.05),提示ICI182780能通过与E2竞争性结合ER从而抑制E2对K1细胞的促增殖能力(图3,表5)。
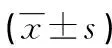
表5 MTT法检测ICI182780对E2刺激K1细胞增殖活力的影响
2.4 E2对K1细胞TFF3转录、蛋白表达及荧光素酶活性的影响
用0、1、10、100 nM E2分别刺激K1细胞24 h后,qPCR及Western blot实验结果显示:TFF3 mRNA及蛋白水平随E2水平升高而增高,与对照组(0 nM E2)相比差异有统计学意义(P<0.01);10 nM E2刺激时TFF3蛋白表达水平最高,100 nM时维持在较高水平(图4)。
随E2水平升高,K1细胞TFF3荧光素酶活性逐渐升高(图5,表6),提示E2可促进K1细胞TFF3基因的转录。
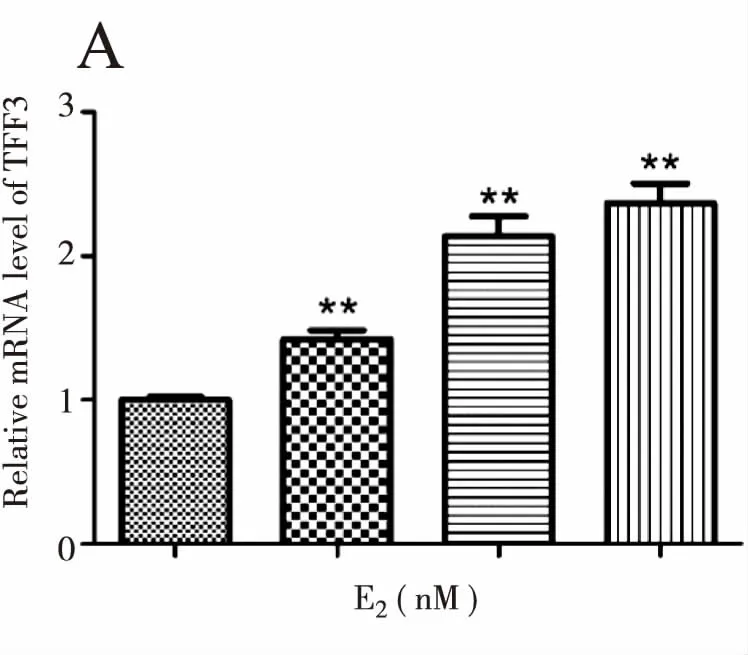
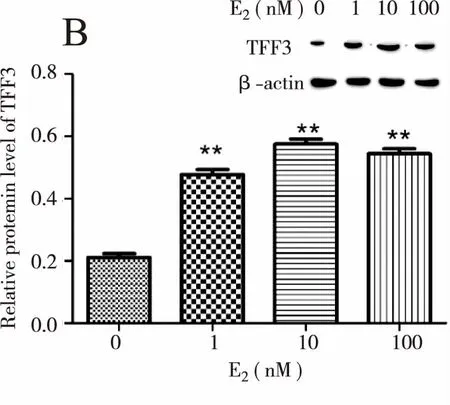
注:与0 nM E2组比较**P<0.01,*P<0.05。
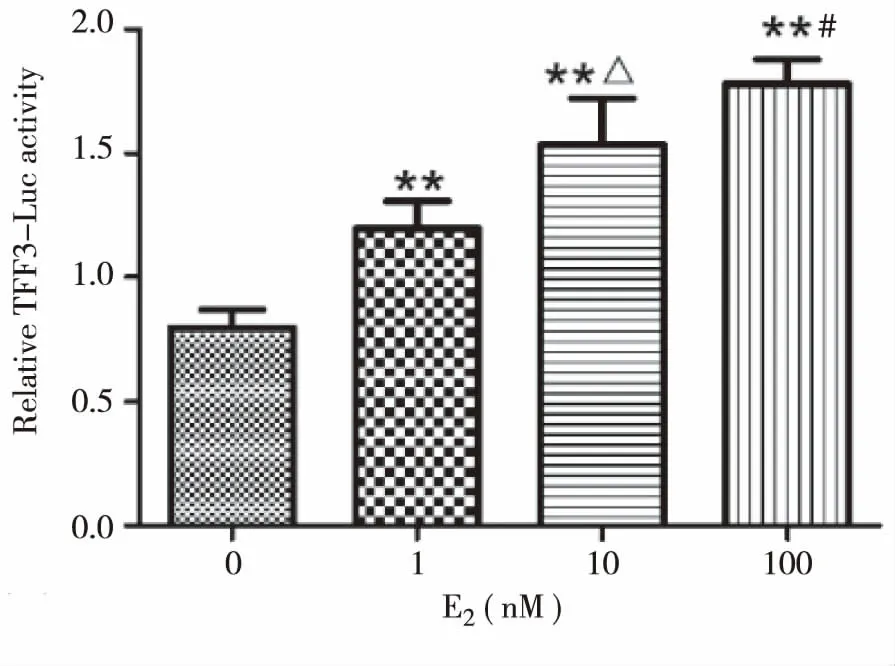
注:与0 nM E2组相比**P<0.01;与1 nM E2组相比△P<0.05;与10 nM E2组相比#P<0.05。
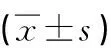
表6 E2对K1细胞TFF3荧光素酶活性的影响
2.5 ICI182780对E2刺激K1细胞表达TFF3蛋白水平的影响
用10 nM E2刺激24 h后,K1细胞TFF3蛋白水平显著升高,与对照组(无任何处理)相比差异有统计学意义(P<0.01);单独E2受体抑制剂ICI182780刺激24 h后TFF3蛋白表达水平与对照组相比差异无统计学意义(P>0.05);ICI182780作用24 h后再加入E2刺激,TFF3蛋白表达水平略高于对照组(P<0.05),但显著弱于E2单独刺激组(P<0.01),提示ICI182780并没有影响TFF3的表达,但减弱了E2刺激的TFF3蛋白水平的提高(图6)。
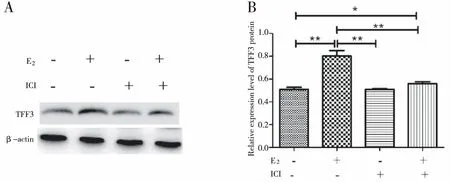
注:与对照组比较*P<0.05,**P<0.01。
2.6 E2对K1细胞TFF1、Bcl-2、cyclinD mRNA水平的影响
10 nM E2刺激K1细胞24 h后,TFF1、Bcl-2、cyclinD mRNA水平均显著高于对照组(P<0.01)(图7)。
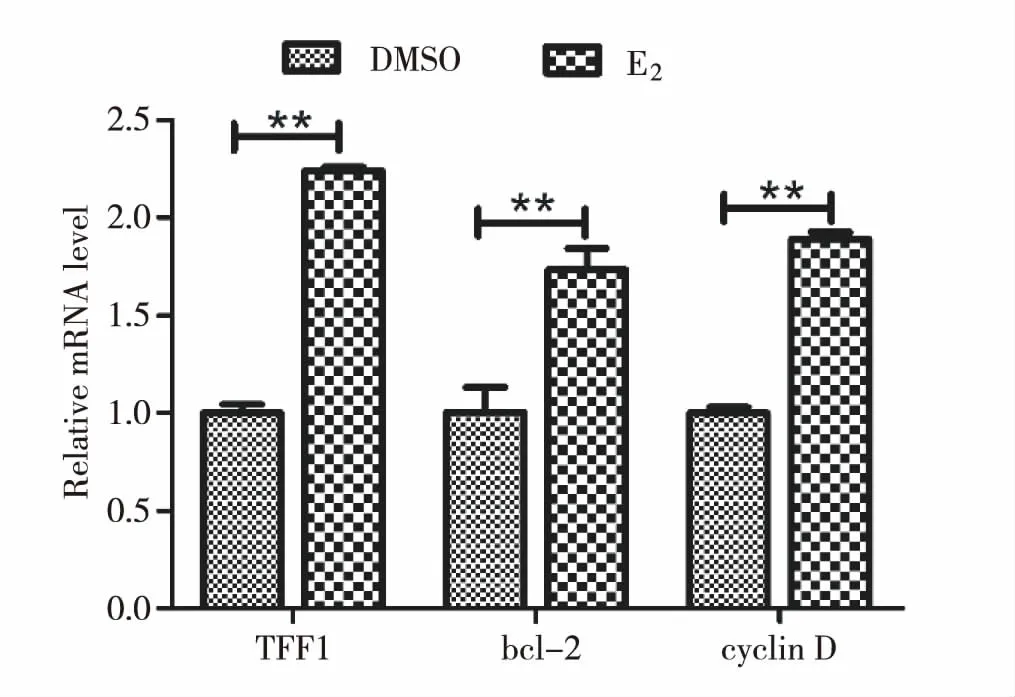
注:与DMSO组相比**P<0.01。
3 讨 论
雌激素及受体在雌激素依赖靶器官肿瘤疾病如乳腺癌、子宫内膜癌中是判断预后、病理诊断、抗雌激素治疗的重要指标,与疾病恶性程度密切相关[4]。20~24岁女性PTC发病率是男性的5倍,35~44岁女性发病率是男性的3.4倍[5],提示雌激素在甲状腺癌发生发展中可能发挥作用。
TFF3既是促进上皮愈合的黏膜保护因子,也是促进多种肿瘤发生发展的癌基因,还是一种雌激素反应基因,因其启动子的第一个-1 kb中具有2个候选雌激素受体反应元件(estrogen response element,ERE)序列[6],因此TFF3的表达受雌激素调控,能被雌激素与其受体形成的受体配体复合物所结合,成为ER调控的靶基因之一。本研究结果显示,ERα在PTC中阳性表达率高于癌旁组织,与性别、临床分期、淋巴结转移、TFF3阳性表达相关,提示ERα在PTC中可能是E2作用的主要内源性介质并与TFF3水平相关。
本研究结果表明,随E2水平升高,TFF3 mRNA及蛋白水平增高,提示E2可促进TFF3的转录和翻译,TFF3作为雌激素反应基因受到雌激素调控,与乳腺癌EFM-19和EFF-3细胞中低浓度E2能够明显上调TFF3 mRNA水平的研究结果一致[7]。随着E2水平升高,K1增殖能力逐渐增强,E2可能直接刺激K1细胞的增殖,也可能通过提高TFF3水平促进K1细胞的增殖。双荧光素酶结果显示随着E2水平升高,K1细胞TFF3荧光素酶活性逐渐增强,提示E2可能直接促进了K1细胞TFF3基因的转录。
ER是雌激素信号传递的重要转录因子,能够调节雌激素相关肿瘤细胞的增殖,是雌激素信号通路的关键因子。乳腺癌细胞中ER可调节TFF3水平。ICI182780(ICI)是特异性ER抑制剂,通过与ER结合从而阻断雌激素与ER的结合,切断了雌激素信号通路。本研究结果显示E2诱导的TFF3蛋白表达能够被ICI减弱,E2刺激并不能解除ICI对K1细胞增殖的抑制作用,ERα在PTC组织中的表达结果提示ERα是传递E2刺激信号、诱导TFF3表达的关键受体,E2通过与ERα结合继而结合TFF3的ERE反应元件,调节TFF3的转录和翻译。
TFF1是第一个被测序的三叶因子家族基因,是典型的雌激素反应基因[8],在SP-1结合位点区域含有ERE[9],在乳腺癌中被证明由E2转录调节,启动TFF1的转录和翻译。Bcl-2、cyclinD是与ER表达相关的基因,在乳腺癌细胞中表达上调[10-11]。有研究表明TFF3可以通过MAPK/ERK依赖方式结合自身启动子的顺式调控元件上调TFF1的转录[9],过表达TFF3的肝癌细胞中Bcl-2启动子荧光素酶报告基因活性明显升高[12],在乳腺癌细胞中TFF3过表达能够上调cyclin D的表达[13],结合本研究结果,我们推测E2可直接促进TFF1、抗凋亡因子Bcl-2、细胞周期调控分子cyclin D的mRNA水平升高,也可通过刺激TFF3水平升高进一步促进Bcl-2、cyclin D转录,从而抑制细胞凋亡、加速细胞周期进程,促进K1细胞增殖与抗凋亡能力。
综上,本研究结果表明雌激素主要通过ERα促进TFF3表达上调,TFF3在雌激素促进PTC癌细胞增殖过程中具有重要作用,是PTC发展机制中的重要环节,ERα high TFF3 high状态预示PTC的恶性进展程度,在伴有复发转移的难治性PTC中抗雌激素治疗抑制TFF3表达有可能成为一种新的治疗策略,可以改善ER(+)PTC患者的预后,有助于提高PTC的临床疗效。
